各論
1 Stage 0~Stage III大腸癌の治療方針
1)内視鏡治療
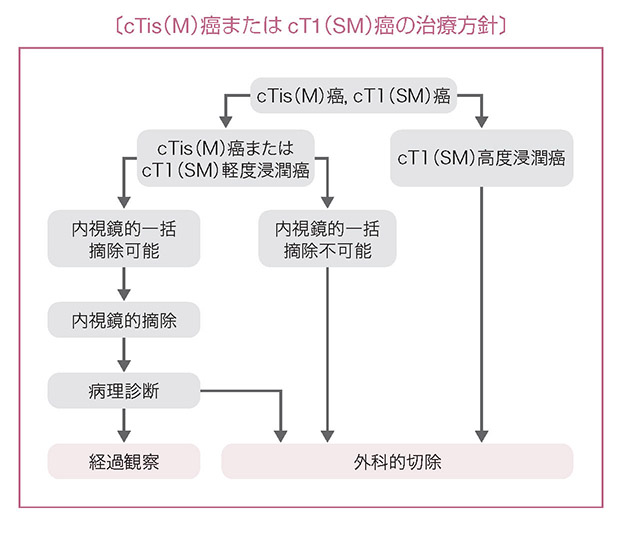
適応の原則
リンパ節転移の可能性がほとんどなく,腫瘍が一括切除できる大きさと部位にある。
内視鏡的摘除の適応基準
(1)粘膜内癌,粘膜下層への軽度浸潤癌。
(2)大きさは問わない。
(3)肉眼型は問わない。
- 本法は内視鏡的に大腸の病巣部を切除し,切除組織を回収する方法である。
- 治療法にはポリペクトミー注1,内視鏡的粘膜切除術(EMR:endoscopic mucosal resection)注2と内視鏡的粘膜下層剝離術(ESD:endoscopic submucosal dissection)注3がある。
- 内視鏡治療の適応と治療法を決める際には,腫瘍の大きさ,予測深達度,形態に関する情報が不可欠である。
注 1 ポリペクトミー
病巣茎部にスネアをかけて高周波電流によって焼灼切除する方法。主として隆起型病変に用いられる。
注 2 EMR
粘膜下層に生理食塩水などを局注して病巣を挙上させ,ポリペクトミーの手技により焼灼切除する方法。スネア法,吸引キャップ法(EMRC:EMR using a cap),などがある。主として表面型腫瘍や大きな無茎性病変に用いられる。
注 3 ESD
病変周囲,粘膜下層にヒアルロン酸ナトリウム溶液などを局注して病巣を挙上させ,専用のナイフで病変周辺の切開,粘膜下層の剝離を進め腫瘍を一括切除する手技である。主として,EMRで一括切除できない大きな腫瘍,特に早期癌が適応である。
コメント
①内視鏡的摘除の目的には診断と治療の両面がある。本法は摘除生検(excisional biopsy)であり,切除標本の組織学的検索によって治療の根治性と外科的追加腸切除の必要性を判定する。(CQ 1)
②cT1(SM)高度浸潤癌の診断指標として,「緊満感,びらん,潰瘍,ヒダ集中,変形・硬化像」などの内視鏡所見,X線造影検査,色素内視鏡観察,拡大内視鏡観察,内視鏡超音波検査所見などを参考にする。
③内視鏡的摘除後の治療方針の決定に際しては,摘除標本の緻密な組織学的検索が必須である。そのため,下記の点に留意する。
- ポリペクトミー標本では切除断端に墨汁などによるマーキングを施し,切除断端を含む最大割面を観察する。
- EMR標本やESD標本では摘除標本を伸展固定し,粘膜筋板と垂直な割面を作製する。
- 治療内容(切除法,併用療法の有無,一括切除か分割切除か,その選択理由など)と切除標本の肉眼所見を記載することが望ましい。
④切除断端および最深部の癌浸潤状況を正確に診断するには,一括切除が望ましい。
- ポリペクトミーやスネアEMRで無理なく一括切除できる限界は2cmである。(CQ 2)
- 大腸のESDは,2012年4月に「早期悪性腫瘍」に対して保険適用が認可された「大きさにかかわらず一括摘除が可能な内視鏡的摘除手技」であるが,技術的難易度が高く合併症(穿孔)の危険性が高いので,施行術者の技量を考慮して施行する。現時点では,径2~5cmまでの病変が保険適用になっている。(CQ 3)
- EMRCは,結腸病変に用いると穿孔の危険性が高いとする報告がある。
- 術前診断で腺腫に伴う癌(粘膜内癌)と確信できれば癌部の分断を避け腺腫部分に関しての分割切除を行ってもよい。しかし,一般的に分割切除では不完全切除率が高く,局所再発率が高いことに留意する。
⑤内視鏡的摘除後は,切除局所を詳細に観察し遺残病変の有無を確認する。
- 遺残病変の診断には色素撒布・拡大観察が有用である。
- 粘膜内病変の遺残があれば追加治療(内視鏡的追加切除,ホットバイオプシー,焼灼など)を行う。
⑥内視鏡治療後の経過観察
- pTis(M)癌で水平(粘膜)断端の評価が困難な場合には,半年~1年後に大腸内視鏡検査にて局所再発の有無を調べる。
- pT1(SM)癌で経過観察する例では,局所再発のみでなくリンパ節再発や遠隔転移再発の検索も必要であるが,現時点では明確なサーベイランス方法や期間についてのコンセンサスは得られていない。pT1(SM)癌内視鏡治療後の再発は3年以内であることが多い。
- 異時性多発病変の検索を目的として,定期的に大腸内視鏡検査による経過観察を行う。ただし,至適な大腸内視鏡検査の間隔は確立していない(参照)。
2)手術治療
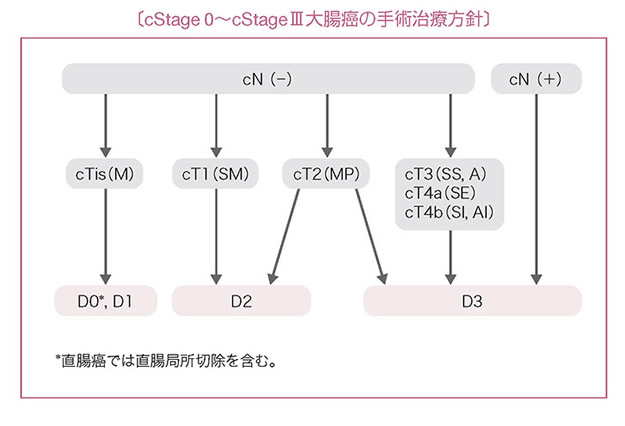
手術の原則
- 大腸癌手術におけるリンパ節郭清度は,術前の臨床所見(c)および術中所見(s)によるリンパ節転移の有無と腫瘍の壁深達度から決定する。
- 術前・術中診断でリンパ節転移を認める,または疑う場合は,D3郭清を行う。
- 術前・術中診断でリンパ節転移を認めない場合は,壁深達度に応じたリンパ節郭清を行う。
- (1)
- pTis(M)癌にはリンパ節転移はないのでリンパ節郭清の必要はないが(D0),術前深達度診断の精度の問題もあり,cTis(M)癌ではD1郭清を行ってもよい。
- (2)
- pT1(SM)癌には約10%のリンパ節転移があること,中間リンパ節転移も少なくないことから,cT1(SM)癌ではD2郭清が必要である。
- (3)
- cT2(MP)癌の郭清範囲を規定するエビデンスは乏しいが,少なくともD2郭清が必要である。しかし,pT2(MP)癌には主リンパ節転移が約1%あること(表3),および術前深達度診断の精度の問題から,D3郭清を行ってもよい。
直腸癌の手術治療
- 直腸切除の原則は,TME(total mesorectal excision)またはTSME(tumor-specific mesorectal excision)である。
- 側方郭清の適応基準は,腫瘍下縁が腹膜反転部より肛門側にあり,かつ固有筋層を超えて浸潤する症例である。
- 第2Houston弁(腹膜反転部)より肛門側にあるcTis(M)癌,cT1(SM)癌(軽度浸潤)が対象となる。
- 切除標本の組織学的検索によって,治療の根治性と追加治療(リンパ節郭清を伴う腸切除)の必要性を判定する。
- 直腸癌手術に関連した自律神経系には,腰内臓神経,上下腹神経叢,下腹神経,骨盤内臓神経,骨盤神経叢がある。
- 癌の進行度,肉眼的な神経浸潤の有無等を考慮して,根治性を損なわない範囲で,排尿機能,性機能温存のため自律神経の温存に努める。
腹腔鏡下手術
- 腹腔鏡下手術の適応は,癌の部位や進行度などの腫瘍側要因および肥満,開腹歴などの患者側要因だけでなく,術者の経験,技量を考慮して決定する。(CQ 4)
コメント
〔切離腸管長〕①D1,D2,D3郭清では,『大腸癌取扱い規約』に定める腸管傍リンパ節が郭清されるよう,切離腸管長を決定する。
②結腸癌における腸管傍リンパ節の範囲は,腫瘍と支配動脈の位置関係によって定義される。腫瘍辺縁から10cm以上離れた腸管傍リンパ節の転移は稀である。
③直腸癌における腸管傍リンパ節の範囲は,口側は最下S状結腸動脈流入点,肛門側は腫瘍辺縁からの距離によって定義される。cStage 0~cStage IIIの症例では,RS癌およびRa癌で3cm以上,Rb癌で2cm以上の直腸壁内および間膜内の肛門側進展は稀であることから,切離腸管長および直腸間膜の切離長は,この範囲を含む遠位(肛門側)切離端を確保することを目安に決定する。
〔TME/TSME〕- 直腸間膜全切除(TME)とは肛門管直上までの直腸間膜をすべて切除する術式である。TSMEとは腫瘍の位置に応じた直腸間膜を部分的に切除する術式である。
- 括約筋間直腸切除術(ISR:intersphincteric resection)は,肛門に近い下部直腸癌に対し,内肛門括約筋を合併切除することにより肛門側切離端を確保し,永久人工肛門を回避する術式である。手技が高難度であること,根治性および術後排便機能などの患者QOLに与える影響についてのエビデンスが十分でないことから,癌の組織型や壁深達度などの腫瘍側要因,年齢や括約筋のトーヌスなどの患者側要因だけでなく,術者の経験,技量を考慮して慎重に適応を決定する。
①大腸癌研究会プロジェクト研究における直腸癌2,916例の分析では,腫瘍下縁が腹膜反転部より肛門側にあり,かつ,固有筋層を超えて浸潤している癌の側方リンパ節転移率は20.1%(側方郭清例のみ)であった(表2)。この適応のもと側方郭清を行うと,骨盤内再発リスクは50%減少し,5年生存率は8~9%改善すると予測される。
②腫瘍下縁が腹膜反転部より肛門側にある癌で直腸間膜内にリンパ節転移を認めた場合,側方リンパ節転移率は27%であった。
③側方郭清を行った場合は,自律神経系を全温存しても排尿機能や男性性機能が障害されることがある点に留意する。
〔直腸局所切除〕- 直腸局所切除のアプローチ法は経肛門的切除,経括約筋的切除,傍仙骨的切除に分類される。
- 経肛門的切除には,直視下に切除・縫合する方法と経肛門的内視鏡下切除術がある。直視下に切除・縫合する方法には,用手的に切除・縫合する従来法と,自動縫合器を用いる方法がある。
- 直腸局所切除の目的には診断と治療の両面がある。本法は摘除生検(excisional biopsy)であり,切除標本の組織学的検索によって,治療の根治性と追加治療(リンパ節郭清を伴う腸切除)の必要性を判定する。判定基準は,「CQ 1:内視鏡的摘除されたpT1(SM)大腸癌の追加治療の適応基準」に準ずる。
①表3,表4,表5に組織学的壁深達度別のリンパ節転移度,Stage別の治癒切除率,5年生存率を示した。
②pStage 0~pStage IIIの治癒切除例の5年生存率は,全症例では82.2%,結腸癌では83.8%,RS癌では81.7%,Ra・Rb癌では79.3%であった(2000~2004年症例)。
2 Stage IV大腸癌の治療方針
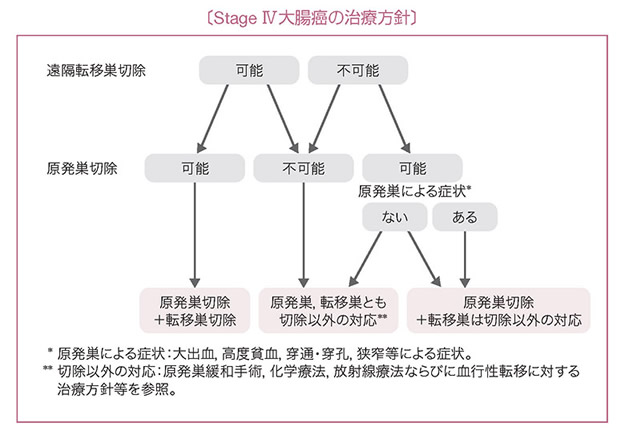
- Stage IV大腸癌では以下のいずれかの同時性遠隔転移を伴う。
肝転移,肺転移,腹膜播種,脳転移,遠隔リンパ節転移,その他の転移(骨,副腎,脾など)。 - 遠隔転移巣ならびに原発巣がともに切除可能な場合には,原発巣の根治切除を行うとともに遠隔転移巣の切除を考慮する。
- 遠隔転移巣が切除可能であるが原発巣の切除が不可能な場合は,原則として原発巣および遠隔転移巣の切除は行わず,他の治療法を選択する。
- 遠隔転移巣の切除は不可能であるが原発巣切除が可能な場合は,原発巣の臨床症状や原発巣が有する予後への影響を考慮して,原発巣切除の適応を決める。(CQ 5)
コメント
①遠隔転移の頻度を表に示す(表6)。
②肝転移を伴う場合
- 転移巣が切除可能であれば,原発巣切除の根治性を確認して,肝転移巣切除を行う。
- 切除のタイミングについては,原発巣と肝転移巣との同時切除も安全に行われるが,肝切除の難度や患者の全身状態等により,異時切除も行われる。しかし,同時切除と異時切除のどちらが長期予後に寄与するかは明らかではない。
③肺転移を伴う場合
- 転移巣が切除可能であれば,原発巣切除のうえ,肺転移巣切除を考慮する。
- 原発巣切除後に改めて肺転移巣を切除する異時切除が一般的である。
④腹膜播種を伴う場合(CQ 6)
- P1は完全切除が望ましい。
- P2で容易に切除可能なものは完全切除を考慮する。
- P3の切除効果は確立されていない。
⑤遠隔リンパ節転移を伴う場合
- 遠隔リンパ節転移の切除を考慮してよいが,明確な治療効果は示されていない。
⑥その他の遠隔転移(骨,脳,副腎,脾など)を伴う場合
- これらの転移巣については切除の報告はあるが,生命予後への明確な効果は示されていない。
⑦複数部位への遠隔転移を伴う場合
- 肝と肺への転移が代表的なものである。
- 原発巣と肝・肺転移巣の切除が安全かつ容易であれば,切除も考慮される。(CQ 7)
⑧遠隔転移巣切除後の補助療法
- 大腸癌遠隔転移巣切除後の補助化学療法の有効性と安全性は確立されておらず,生存期間の延長を検証したランダム化比較試験はない。(CQ 8) 適正に計画された臨床試験として実施するのが望ましい。
⑨遠隔転移巣への切除以外の治療法
- 全身化学療法,局所化学療法,熱凝固療法,放射線照射療法などが行われる。
3 再発大腸癌の治療方針
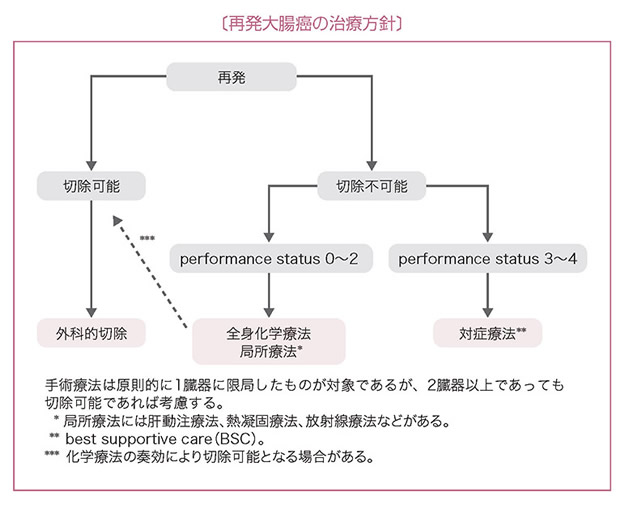
- 再発大腸癌の治療目的は,予後向上とQOLの改善である。
- 治療法には,手術療法,全身化学療法,動注化学療法,熱凝固療法,放射線療法などがある。
- 期待される予後,合併症,治療後のQOLなどのさまざまな因子を考慮し,患者への十分なインフォームド・コンセントのもとに治療法を選択する。
- 再発臓器が1臓器の場合,手術にて再発巣の完全切除が可能であれば積極的に切除を考慮する。
- 再発臓器が2臓器以上の場合,それぞれが切除可能であれば切除を考慮してもよいが,治療効果について統一見解は得られていない。(CQ 7)
- 肝あるいは肺転移に対して不顕性転移を除外するために一定の観察期間を置いてから切除を行うという見解がある。
- 切除不能と判断された肝転移に対して全身化学療法が奏効して根治切除が可能になる症例が存在する。(CQ 9)
- 血行性転移に対する治療法(血行性転移の治療方針参照)。
- 直腸癌局所再発には吻合部再発と骨盤内再発がある。
(1)切除可能であれば切除を考慮する。
(2)切除不能であれば放射線療法と全身化学療法の単独または併用を考慮する。
コメント
〔直腸癌局所再発〕①再発巣の進展範囲を画像診断にて評価し,再発形式や症状,身体的所見なども参考にして,完全切除が期待できる症例にのみ切除を考慮する。(CQ 10)
②直腸癌局所再発のうち,吻合部再発や前方再発では完全切除が期待できることが多い。後方再発では,完全切除のためには仙骨合併切除が必要になることがあり,耐術能も十分考慮したうえで適応を決定する。
③延命効果や症状緩和を目的とした姑息的切除の有効性については議論が多く,慎重に検討すべきである。
④完全切除が期待できない場合,放射線療法と全身化学療法の単独あるいは併用療法を考慮する。
4 血行性転移の治療方針
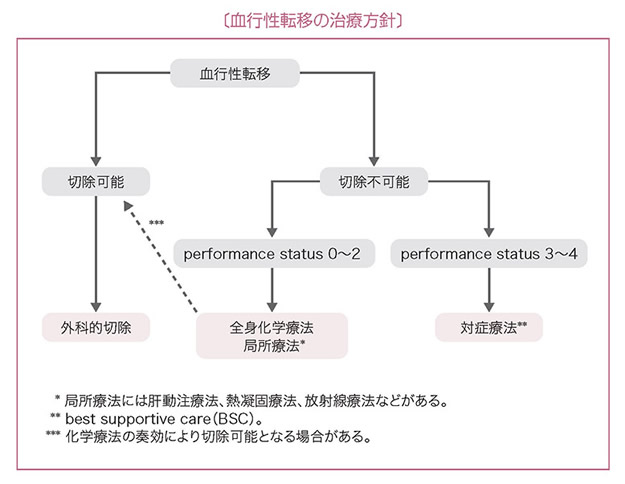
1)肝転移の治療方針
- 肝転移の治療は,肝切除,全身化学療法,肝動注療法および熱凝固療法がある。
- 根治切除可能な肝転移には肝切除が推奨される。
- 肝切除術には系統的切除と部分(非系統的)切除がある。
肝切除の適応基準
(1)耐術可能。(2)原発巣が制御されているか,制御可能。
(3)肝転移巣を遺残なく切除可能。
(4)肝外転移がないか,制御可能。
(5)十分な残肝機能。
- 切除不能な肝転移で全身状態が一定以上に保たれる場合(PS 0~PS 2)は,全身化学療法を考慮する。
- 熱凝固療法にはマイクロ波凝固療法(MCT:microwave coagulation therapy)とラジオ波焼灼療法(RFA:radiofrequency ablation)がある。
- 全身状態が不良(PS≧3)あるいは有効な薬剤がない場合は対症療法(BSC:best supportive care)を行う。
コメント
〔肝切除〕①肝切除は,コホート研究やランダム化比較試験から導き出された結論ではないが,選択された症例に対しては他の治療法では得られない良好な成績が示されている。
②肝切除後の5年生存率は35~58%である。本邦で行われた多施設集計では,肝切除585例の3年生存率は52.8%,5年生存率は39.2%であった。
③転移巣の数,大きさ,部位および予測残肝容量を総合的に評価し,転移巣の完全切除が可能か否かを判定する。
④10mm未満の病変に対する感度は,CTよりMRIが有意に高いことが報告されている。FDG-PETの肝転移診断と治療に対する有効性は確立されていない。
⑤切除断端に癌が露出しない切除が重要である。
- 切除断端距離は,1cm以上を推奨する報告と,癌の露出がなければよいとする報告がある。
⑥同時性肝転移では,原発巣の切除を先行し,原発巣の根治性を評価してから肝転移を切除してもよい。
- 同時性肝転移の切除時期については,明確な結論は得られていない。
⑦肝門部リンパ節転移例の予後は不良であることから,肝門部リンパ節転移は肝切除の適応の除外因子としている報告がある。
- 本邦の集計では,肝門部リンパ節転移例で郭清した場合の5年生存率は12.5%であった。
⑧制御可能な肝外転移(主に肺転移)を合併した肝転移例において,肝切除の有効性を示している報告がある。(CQ 7)
⑨残肝再発に対する再肝切除で21~48%の5年生存率が報告されている。残肝再発例に対しても前述の肝切除の適応基準に照らして切除を考慮する。
⑩肝切除後の全身化学療法・肝動注療法の有効性はいまだ確立されていない。(CQ 8)
⑪切除可能な肝転移に対する術前化学療法の有効性と安全性は確立されていない。(CQ 11)
〔切除以外の治療法〕①切除不能肝転移例には全身化学療法を行う。(CQ 9)
②切除不能肝転移例に対して肝動注療法あるいは熱凝固療法を行う場合は,原発巣が制御されていることが望ましい。(CQ 17,CQ 12)
③熱凝固療法は低侵襲性が利点であり,局所制御効果および長期生存例が報告されている。ただし,いまだ十分な症例集積によって長期予後を検討した報告はなく,有効性の評価は定まっていない。切除に比べて再発率が高く,長期生存も不良であるという報告もあるため,外科切除の代替治療としては推奨されない。(CQ 12)
④本邦においては,体幹部定位放射線治療や密封小線源治療の有効性を支持するデータは存在しない。
⑤全身状態が不良な場合は対症療法(BSC:best supportive care)を行う。
2)肺転移の治療方針
- 肺転移の治療には,肺切除と全身化学療法,放射線療法がある。
- 肺転移巣の切除が可能であれば肺切除を考慮する。
- 肺切除には系統的切除と部分(非系統的)切除がある。
肺切除の適応基準
(1)耐術可能。(2)原発巣が制御されているか,制御可能。
(3)肺転移巣を遺残なく切除可能。
(4)肺外転移がないか,制御可能。
(5)十分な残肺機能。
- 切除不能肺転移で全身状態が一定以上に保たれる場合は,全身化学療法を考慮する。
- 耐術不能な場合でも,原発巣と肺外転移が制御されているか,制御可能で,5cm以内の肺転移個数が3個以内であれば体幹部定位放射線治療も考慮する。
- 全身状態が不良な場合は適切なBSCを行う。
コメント
〔肺切除〕①コホート研究やランダム化比較試験から導き出された結論ではないが,適切に選択された症例に対する肺切除は他の治療法では得られない良好な成績が示されている。
②肺切除後の5年生存率は30~68%である。大腸癌研究会プロジェクト研究で行われた多施設集計では肺切除例の5年生存率は46.7%,累積5年無再発生存率は33.7%であり,非切除例の5年生存率は3.9%であった。
③同時性肺転移では,原発巣の切除を先行し,局所の根治性を評価することが望ましい。したがって,原則的に同時性肺転移は異時切除となる。
④転移巣の数,大きさ,部位および気管支内進展を評価し,切除断端距離を確保した転移巣の完全切除ができる術式を決定する。
⑤肺門・縦隔リンパ節郭清の意義は定まっていない。予後不良因子として,転移個数,両側肺転移,肺門・縦隔リンパ節転移,肺切除前血清CEA値,原発巣因子(T因子,N因子),無病期間(DFI:disease-free interval)などが報告されている。
⑥制御可能な肺外転移例(主に肝転移)では,肺切除の有効性を示唆する報告がある。
⑦残肺再発に対する再肺切除で20~48%の5年生存率が報告されている。肺切除後の残肺再発に対しても前述の肺切除の適応基準に準じて慎重に切除の適応を考慮する。
3)脳転移の治療方針
- 脳転移は全身疾患としての一分症として発見されることが少なくないが,治療効果が期待される病変に対しては,手術療法あるいは放射線療法を考慮する。
- 全身状態,他の転移巣の状況を考慮し,脳転移巣の大きさ,部位,脳転移個数を評価して最適な治療法を選択する。
- 切除不能例には放射線療法を考慮する。
〔手術療法〕
脳切除の適応基準
(1)数カ月以上の生命予後。
(2)切除により重大な神経症状をきたさない。
(3)他臓器の転移がないか,制御可能。
〔放射線療法〕
- 脳神経症状や頭蓋内圧亢進症状などの症状緩和と局所制御による延命を目的とする。
- 多発性脳転移例や外科切除の対象とならない孤立性脳転移例では全脳照射を考慮する。
- 脳転移個数がおよそ3~4個以内で3cm以下であれば,定位放射線照射を考慮する。
コメント
〔手術療法〕①脳転移の約90%の症例は他臓器に転移を伴い,切除術を施行しても予後は不良である。
②孤立性脳転移に対する切除後の平均生存期間は30~40週と報告されているが,十分な症例集積に基づく手術療法の有効性の評価は定まっていない。
③脳転移切除後に全脳照射を追加する意義に関しては議論の分かれるところである。
〔放射線療法〕①症状改善率は60~80%である。
②定位放射線照射では局所制御が80~90%に得られる。
③予後因子として,年齢,PS,脳転移個数,頭蓋外病変の制御の有無がある。
④現時点では,転移の個数にかかわらず全脳照射が行われることが多く,数年の予後が期待できる場合には定位放射線照射を加えることを考慮する。定位放射線照射を行う場合には,QOLの高さから単独治療も治療選択肢として考慮されるが,全脳照射に比し頭蓋内再発率が高いため,適切な間隔での画像検査が必要である。
4)その他の血行性転移の治療方針
- 副腎,皮膚,脾などの血行性転移に対しても,切除可能な場合は切除を考慮する。しかし,これらの転移は他の臓器の転移を伴うことが多く,化学療法あるいは放射線療法が適応されることが多い。
5 化学療法
- 化学療法には,術後再発抑制を目的とした補助化学療法と切除不能な進行再発大腸癌を対象とした全身化学療法がある。
- 日本の保険診療として,大腸癌に対する適応が認められている主な抗がん剤には以下のものがある。
- 経口薬:
- 5-FU,tegafur,UFT,doxifluridine(5'-DFUR),carmofur(HCFU),S-1(S),UFT+LV,capecitabine(Cape),regorafenibなど
- 注射薬:
- 5-FU,mitomycin C,irinotecan(IRI),5-FU+l-leucovorin(LV),oxaliplatin(OX),bevacizumab(Bmab),cetuximab(Cmab),panitumumab(Pmab)など
1)補助化学療法
- 術後補助化学療法は,R0切除が行われた症例に対して,再発を抑制し予後を改善する目的で,術後に実施される全身化学療法である。
適応の原則
(1)R0切除が行われたStage III大腸癌(結腸癌・直腸癌)。Stage IV切除例はCQ 8参照。
(2)主要臓器機能が保たれている。以下を目安とする。
- 骨髄:白血球>3,500/mm3,血小板>100,000/mm3
- 肝機能:総ビリルビン<2.0mg/dL,AST/ALT<100IU/L
- 腎機能:血清クレアチニン:施設基準値上限以下
(3)performance status(PS)が0~1である。
(4)術後合併症から回復している。
(5)適切なインフォームド・コンセントに基づき患者から文書による同意が得られている。
(6)重篤な合併症(特に,腸閉塞,下痢,発熱)がない。
推奨される療法(日本における保険適応収載順)
- 5-FU+LV 注
- UFT+LV
- Cape
- FOLFOX
- CapeOX
推奨される投与期間(CQ 15)
- 投与期間6カ月を原則とする。
コメント
①術後補助化学療法は,術後9週以降の開始では治療効果が減弱するとの報告があるため,4~8週頃までに開始することが望ましい。
②補助化学療法期間中は,切除不能な進行再発大腸癌に対する全身化学療法と同様の有害事象が起こり得る。少なくともコース毎に,自他覚症状の観察,臨床検査値の確認が必要である。
③術後補助化学療法における,経口抗がん剤(UFT+LV,Cape)と静注5-FU+LV療法の同等性が欧米のランダム化比較試験から報告されている。
④Stage III結腸癌に対する術後補助化学療法として,静注5-FU+LVにOXを併用した場合(FOLFOX,FLOXおよびCapeOX)の再発抑制および生存期間に対する上乗せ効果が欧米のランダム化比較試験で示されている。ただしFLOXはGrade 3/4の下痢が38%と高頻度にみられたことから実地診療での使用は推奨されない。日本の大腸癌の手術成績は概して海外よりも良好であり,大腸癌全国集計(2003~2004年度症例)ではpStage IIIa/IIIb結腸癌の5年生存割合はそれぞれ77.3%,68.1%,pStage IIIa/IIIb直腸癌の5年生存割合は76.0%,58.8%である。したがって海外臨床試験成績をもとに,各患者の術後補助化学療法を決定する際には,期待される生存期間の上乗せのみならず,OX併用による蓄積性末梢神経障害などの有害事象,および医療コストについての十分なインフォームド・コンセントのもとに判断する必要がある。
⑤術後補助化学療法として,静注5-FU+LV療法にIRIを併用した場合(IFL療法,FOLFIRI療法)の再発抑制および生存期間に対する上乗せ効果は示されていない。術後補助化学療法としての分子標的治療薬の上乗せ効果は,NSABP C-08試験(FOLFOX±Bmab),AVANT試験(FOLFOX±Bmab,CapeOX+Bmab)およびN0147試験(FOLFOX±Cmab),PETACC-8試験(FOLFOX±Cmab)において示されなかった。
⑥Stage III直腸癌に対する術後補助化学療法として,UFT投与群は手術単独群よりも有意に再発抑制効果および生存期間延長効果が高いことが国内のランダム化比較試験で示されている。これら国内RCTはいずれもLVが国内未承認時に行われた。LVが承認されている現状では,UFT+LVなど上記「推奨される療法」に記されたレジメンを使用することが望ましい。
注 補助化学療法における5-FU+LV療法
RPMI法(l-LV 250mg/m2,2時間点滴;5-FU 500mg/m2,l-LV開始1時間後に3分以内に緩徐に静注:毎週1回投与,6週連続2週休薬,8週毎に3サイクル繰り返す)
2)切除不能進行再発大腸癌に対する化学療法
- 化学療法を実施しない場合,切除不能と判断された進行再発大腸癌の生存期間中央値(MST:median survival time)は約8カ月と報告されている。最近の化学療法の進歩によってMSTは約2年まで延長してきたが,現状では治癒を望むことは難しい。
- 化学療法の目標は腫瘍増大を遅延させて延命と症状コントロールを行うことである。
- PS 0~PS 2の症例を対象としたランダム化比較試験において,化学療法群は抗がん剤を用いない対症療法(BSC:best supportive care)群よりも有意に生存期間が延長することが示されている。
- 切除不能進行再発大腸癌に対する化学療法が奏効して切除可能となることがある。
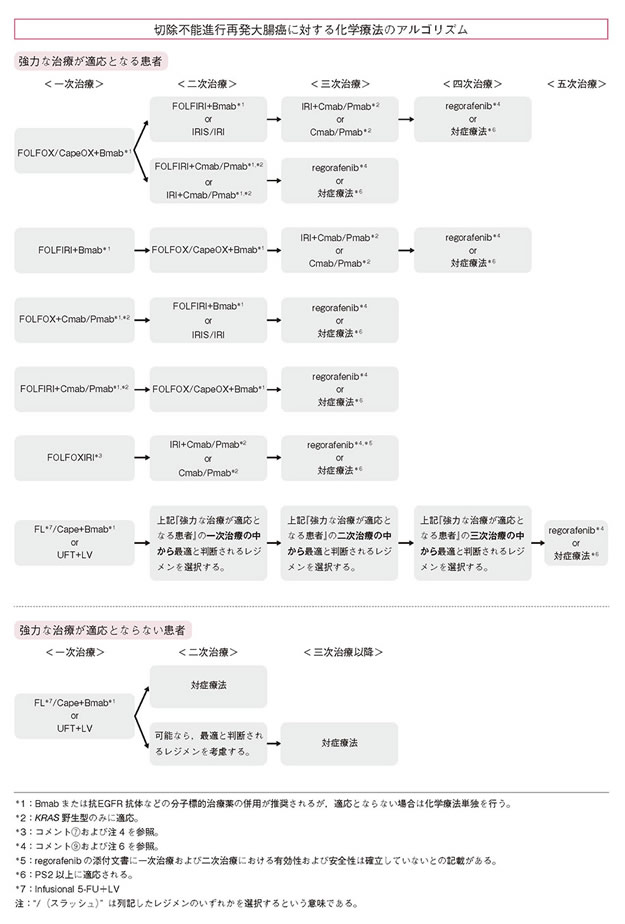
- 強力な治療が適応となる患者と強力な治療が適応とならない患者に分けて治療方針を選択するのが望ましい〔アルゴリズム,コメント⑤およびコメント⑥参照〕。
- 強力な治療が適応とならない患者とは,患者因子と腫瘍の状態との両面から定義される。すなわち,患者因子として,重篤な有害事象の発生を好まない,または重篤な併存疾患があり一次治療のOX,IRIや分子標的薬の併用療法に耐容性がないと判断される,腫瘍の状態としては,現在切除不能な多臓器(または多発)転移があり将来的にも切除可能となる見込みが乏しい,無症状かつ緩徐な腫瘍進行と判断される(急速な悪化の危険性が少ない)患者などである〔アルゴリズム,コメント⑥参照〕。
- Cmab,PmabはKRAS野生型のみに適応される。
- 特に一次・二次治療においてBmabや抗EGFR抗体などの分子標的治療薬が適応となる症例には化学療法との併用が推奨される。一方,分子標的治療薬の適応とならない場合は,化学療法単独を推奨する。
適応の原則
(1)臨床診断または病理組織診断が確認されている。
(2)転移・再発巣が画像にて確認可能である。
(3)performance status(PS)が0~2である。
(4)主要臓器機能が保たれている(下記の1~3は投与の目安)。
1.骨髄:白血球>3,500/mm3,血小板>100,000/mm3
2.肝機能:総ビリルビン<2.0mg/dL,AST/ALT<100IU/L
3.腎機能:血清クレアチニン:施設基準値上限以下
(5)適切なインフォームド・コンセントに基づき患者から文書による同意が得られている。
(6)重篤な合併症(腸閉塞,下痢,発熱など)を有さない。
一次治療
- 臨床試験において有用性が示されており,かつ保険診療として国内で使用可能な一次治療としてのレジメンは以下の通りである。
(1)強力な治療が適応となる患者
・FOLFOX 注1+Bmab
・CapeOX 注2 +Bmab
・FOLFIRI 注3+Bmab
・FOLFOX+Cmab/Pmab
・FOLFIRI+Cmab/Pmab
・FOLFOXIRI 注4
・Infusional 5-FU+LV+Bmab
・Cape+Bmab
・UFT+LV
(2)強力な治療が適応とならない患者
・Infusional 5-FU+LV+Bmab
・Cape+Bmab
・UFT+LV
二次治療
- 二次治療として以下のレジメンを考慮する。(CQ 16)
(1)強力な治療が適応となる患者
(a)OXを含むレジメンに不応・不耐となった場合
・FOLFIRI+Bmab
・IRIS 注5
・IRI
・FOLFIRI(またはIRI)+Cmab/Pmab
(b)IRIを含むレジメンに不応・不耐となった場合
・FOLFOX+Bmab
・CapeOX 注2+Bmab
(c)5-FU,OX,IRIを含むレジメンに不応・不耐となった場合
・IRI+Cmab/Pmab
・Cmab/Pmab
(2)強力な治療が適応とならない患者
・BSC
・可能なら,最適と判断されるレジメンを考慮
三次治療以降
- 三次治療以降の化学療法として次のレジメンを考慮する。
- IRI +Cmab /Pmab
- Cmab /Pmab
- regorafenib 注6
注1 FOLFOX
Infusional 5-FU+LV+OX。
注2 CapeOX
Cape+OX。
注3 FOLFIRI
Infusional 5-FU+LV+IRI。
注4 FOLFOXIRI
Infusional 5-FU+LV+IRI+OX。IRI 165*mg/m2;OX 85mg/m2;OXと同時にl-LV 200mg/m2;5-FU 3,200**mg/m2を点滴静注:2週毎に繰り返す。なお,国内で承認されているl型ロイコボリンの投与量は欧米で使用されているdl型ロイコボリンの半量で等量となる。(*IRIの添付文書の用法・用量では,150mg/m2とあるが,年齢,症状により適宜増減するとある。**5-FU注の添付文書の用法・用量では3,000mg/m2までとある。)
注5 IRIS
S-1+IRI。IRI 125mg/m2 2週毎に繰り返す;S-1 体表面積に応じて40~60mg/回 1日2回内服 2週内服2週休薬 4週毎に繰り返す。
注6 regorafenib
160mg/body 1日1回内服 3週内服1週休薬 4週毎に繰り返す。
コメント
①全身化学療法の適応となる転移部位は肝,肺,リンパ節,腹膜,局所などがある。骨転移に対しては緩和的放射線療法を考慮し,脳転移に対しては手術療法あるいは放射線療法を考慮する。
②治療実施上の注意点
- PS 3~PS 4注7,あるいは高度の臓器障害を有する患者は原則的には化学療法の適応外である。あえて化学療法を行う場合は,予測されるリスクとベネフィットについて十分なインフォームド・コンセントを行う必要がある。
- 治療前にはPS,バイタルサイン,体重,発熱の有無,自覚症状,血液検査結果,尿検査所見,身体所見等を確認し,投与不可と判断される異常を認めた場合は治療の延期を考慮する。
- 治療継続時には,前項のほか,前回投与時後の治療関連有害事象や腫瘍関連症状等を検討して抗がん剤投与の継続の可否を判断し,また,適宜減量などを考慮する。
- 治療コースを繰り返す場合には,蓄積性の有害事象(神経障害,食欲不振,倦怠感,下痢,皮膚障害,味覚障害など)に注意する。必要であれば全治療,あるいは原因となる薬剤を中断して回復を待つ。
- 有害事象の評価には有害事象共通用語規準(CTCAE)を用いることが望ましい。
- 治療効果は,CT,MRIなどの適切な画像診断を用いて判定する。奏効度の判定には,RECIST(Response Evaluation Criteria In Solid Tumors)ガイドラインを用いることが望ましい。PETによる治療効果判定の評価は定まっていない。
- 前治療コースで重篤な有害事象が発現した場合でも,一定の基準に回復した後に評価を行い,有効性が期待できれば投与量の減量・投与間隔の延長などの対策を講じて治療を継続することは可能である。
- 明らかな病状の進行,重篤な有害事象の発生,患者の拒否のない限り,治療スケジュールを遵守して治療を継続することが望ましい。
- 一次治療と二次治療において,5-FU系薬剤,IRI,OXの3剤を使うことにより20カ月以上のMSTが得られると報告されている。
③OXを使用する際には蓄積性の神経毒性に留意が必要である。Grade 3の神経毒性に至る前までに投与を控えるのが望ましいが,治療効果が持続している場合には,OPTIMOX-1試験でも示されたように,Infusional 5-FU+LVに切り替えるなどの対応を考慮する。病状が増悪し,神経毒性がGrade 1以下に改善すればOXの再導入を考慮する。
④IRIを使用する際には,Gilbert症候群などの体質性黄疸や血清ビリルビン高値の患者には十分な注意が必要である。本剤の代謝酵素の遺伝子多型と毒性との関係が示唆されている(サイドメモ参照)。
⑤強力な治療が適応となる患者であっても,緩徐な腫瘍進行と判断される症例または重篤な有害事象の発生を好まない患者などに対しては,Infusional 5-FU+LV,Cape,UFT+LV,Infusional 5-FU+LV+Bmab,Cape+Bmabなども選択肢となり得る。
⑥強力な治療が適応とならない患者には,Infusional 5-FU+LV,Cape,UFT+LV,Infusional 5-FU+LV+Bmab,Cape+Bmabなどを考慮する。強力な治療が適応とならない患者への二次治療以降の治療は,可能なら,最適と判断されるレジメンを考慮する。
⑦一次治療におけるFOLFOXIRIの国内での使用経験は少なく,安全性に十分配慮する必要がある。
⑧一次・二次・三次治療におけるBmab,CmabおよびPmabの使い分けの明確なコンセンサスは得られていない。また,分子標的治療薬の同時併用(BmabとCmabまたはBmabとPmab)は,一次治療例を対象とした2つのランダム化比較試験から毒性増強と効果減弱が示されており,同時併用は行うべきでない。
⑨regorafenibの有効性と安全性は,CORRECT試験*に基づいて評価されたもので,添付文書にも記載されているように,一次治療および二次治療における有効性と安全性は確立していない。また,PS 0またはPS 1のみで確認され,PS 2からPS 4の患者に対する有効性と安全性は評価されていないことに留意する必要がある。
*CORRECT試験は,切除不能進行再発大腸癌を対象として標準的な化学療法後〔フッ化ピリミジン剤,OX,IRI,Bmab,Cmab/Pmab(KRAS遺伝子野生型のみ)〕の病勢進行に対するregorafenib単剤投与の有効性と安全性をBSCと比較検討した国際共同第III相臨床試験である。
⑩肝転移に対する肝動注療法の腫瘍縮小率は高いが,生存期間において全身投与を上回る有効性は示されていない。(CQ 17)
注7 PS
ECOGのperformance status(PS)の日本語訳。

6 放射線療法
- 放射線療法には,直腸癌の術後の再発抑制や術前の腫瘍量減量,肛門温存を目的とした補助放射線療法と切除不能進行再発大腸癌の症状緩和や延命を目的とした緩和的放射線療法がある。
1)補助放射線療法
- 補助放射線療法には,術前照射,術中照射,術後照射がある。
- 補助放射線療法の目的は直腸癌の局所制御率の向上である。術前照射では,さらに肛門括約筋温存率と切除率の向上が得られることが示唆されている。しかし,生存率の改善に関しては,現時点で補助放射線療法の目的とするだけのエビデンスは存在しない。
- 術前照射は「深達度cT3(SS/A)以深またはcN陽性」,術後照射は「深達度pT3(SS/A)以深またはpN陽性,外科剝離面陽性(RM1)または外科剝離面への癌浸潤の有無が不明(RMX)」,術中照射は「外科剝離面陽性(RM1)または外科剝離面への癌浸潤の有無が不明(RMX)」を対象とする。
- 照射方法により外部照射と術中照射に分けられる。
コメント
①術前照射(CQ 18)
- (1)術前照射の利点は,手術時の播種の予防,腫瘍への血流が保たれていて腫瘍細胞に放射線感受性細胞の割合が多いこと,小腸が骨盤腔内に固定していないため消化管への障害が少ないこと,腫瘍縮小によるR0切除率の向上,肛門括約筋温存が期待できることである。
- (2)術前照射の欠点は,早期症例への過剰治療の危険性があること,術後合併症の増加の危険性があることである。
- (3)術前照射(化学療法なし)に関する12件のランダム化比較試験が報告され,このうち5件では術前照射が手術単独に比べ局所制御率が有意に良好であった。ただし,生存率の向上を認めたのは1件のみであった。
- (4)術前照射に関する2つのメタアナリシスでは,手術単独に比し,術前照射併用にて局所制御率の向上を認め,30Gy以上の群では生存率の改善を認めた。しかし,生存率の改善に関しては議論がある。
- (5)1回線量5Gyによる短期照射の試験が欧州を中心に行われている。放射線の晩期障害は1回線量の大きさに影響を受けることから,肛門機能,腸管障害などを含めた晩期障害を長期的に経過観察していく必要がある。
- (6)TMEに短期照射を加える意義について,術前照射(25Gy/5回)+TMEとTME単独を比較したDutch CKVO 95-04試験では,5年および10年局所制御率は併用群で有意に良好であったが,5年および10年生存率は両群で差はなかった。また,手術単独群に比し,術前照射併用群では,性機能低下,腸管障害の頻度が高かった。
- (7)術前照射の原発巣に対する縮小効果により括約筋温存が可能になることがある。術前照射の目的が括約筋温存である場合,腫瘍縮小のための適切な期間(放射線治療終了後6~8週)をおいて手術を行うことが望ましい。
- (8)術前照射に化学療法併用が有用かどうかを比較するランダム化比較試験が欧州などで4つ施行され,術前化学放射線療法は,術前放射線療法単独に比し,急性期有害事象の頻度が有意に高いものの,pCR割合が有意に高い結果であった。局所再発率は短期照射の試験を除いた2つの試験において術前化学放射線療法群で有意に低い結果であり,括約筋温存,生存率に関しては両群に差を認めなかった。
- (9)術前化学放射線療法と術後化学放射線療法を比較するランダム化比較試験では,5年生存率に差はなかったが,術前照射群で局所再発率が有意に低く,Grade 3以上の有害事象の頻度は有意に低かった。登録時に(腹会陰式)直腸切断術が必要と判断された症例のうち,括約筋温存が可能であった割合は術前照射群で有意に高かった。
- (10)併用化学療法としての5-FUとCapeのランダム化比較試験で,両者の有効性と安全性は同等であることが示された。NCCNガイドラインでは併用化学療法の標準として5-FUまたはCapeを採用している。ただし,直腸癌補助療法に関してCapeの適応症,用法については国内の保険適応はない。用量については適応内であり,倫理審査委員会での承認下に適切な症例選択のもと試みることは可能と考える〔コメント④ 照射法 a.外部照射法 〔併用療法〕の項を参照〕。
- (11)併用化学療法に関して,フッ化ピリミジンに対するOXの上乗せ効果を検討したランダム化比較試験のうち3つの試験ではOXは有害事象を増加させるがpCR割合,局所制御率,生存率に対する効果は示されず,1つの試験では有害事象に差はなく,primary endpointの無病生存率は未解析であるが,pCR割合が有意に高かった。
②術後照射
- (1)術後照射の利点は,深達度pT3(SS/A)以深またはpN陽性などの局所再発の高リスク群を選択して照射することができることである。
- (2)術後照射の欠点は,術中の腫瘍細胞の散布を防止できないこと,骨盤底に癒着した小腸に照射され消化管の有害事象の頻度が高くなることである。また,術後は局所の血流は少なくなり,放射線感受性は低くなることである。
- (3)術後照射は術後6~8週までに開始することが望ましい。
- (4)術後照射により局所再発は低下するが,生存率の改善をもたらさない。
- (5)化学療法との併用では,急性期有害事象が増加し,GITSGおよびMayo/NCCTG79-47-51試験では,Grade 3以上の有害事象が25~50%に発生した。欧米のランダム化比較試験の結果,術後化学放射線療法は術前化学放射線療法に比べ局所再発率が高く,かつ有害事象が多いことが示されており,NCCNガイドラインをはじめとする欧米のガイドラインでは術前化学放射線療法を推奨している。
- (6)補助放射線療法または化学放射線療法による腸管障害の症状として,頻便,便意切迫,排便困難感,便失禁,肛門の感覚異常などがある。
③術中照射
局所再発の原因である外科剝離面(RM)不足,側方リンパ節などに対して腸管などの周囲正常組織を避けて重点的に腫瘍床に高線量を照射できる。
- a.外部照射法
適応の原則は骨盤内に放射線治療歴がないことである。
〔治療計画〕- 標的体積には原発巣と転移リンパ節(術後は腫瘍床)に所属リンパ節領域を含めることが一般的である。所属リンパ節領域として,直腸間膜(直腸傍リンパ節含む),内腸骨リンパ節領域,閉鎖リンパ節領域,仙骨前リンパ節領域とし,腹側の臓器(膀胱,前立線,子宮,膣)に浸潤する場合には外腸骨リンパ節領域も含める。
- 腹臥位での治療体位やベリーボードの使用を考慮するなどして,小腸を可及的に照射体積から避けるように努める。
- 小腸・膀胱の有害事象の発生を回避する観点から3門照射(後方および両側方)または4門照射(前後および両側方)が推奨される。
- 少なくとも6MV以上のX線発生装置で治療することが望ましい。また,側方からの照射は10MV以上での治療が推奨される。
- 術前化学放射線療法における強度変調放射線治療の有用性は認められていない。
- 1回1.8~2.0Gy,週5回の通常分割照射法が一般的である。
- 総線量は,術前照射の場合40~50.4Gy/20~28回,術後照射の場合50~50.4Gy/25~28回が一般的である。
- 切除不能な肉眼的病変が残存し,小腸などが照射体積内に含まれない場合には55~60Gy程度まで線量を増加することを考慮する。
- 術前照射,術後照射とも,化学療法との同時併用が標準的であり,併用化学療法は5-FU注1 またはCape注2 が標準である。
- b.術中照射法
外科的剝離断端が陽性または断端近接で局所制御の向上を目的とする。
〔治療方法〕- 照射範囲は断端陽性,近接部位に対して設定する。
- 電子線照射を施行することが多いが,高線量率小線源を用いることもある。
- 使用する電子線のエネルギーは腫瘍の深さに応じておおむね9~15MeVなどを選択する。
- 外科的剝離断端が近接または顕微鏡的に陽性の場合は10~15Gy,肉眼的に陽性の場合は15~20Gy照射する。
注1 5-FU
225mg/m2/日 持続静注 週5日または7日(放射線治療期間中)
注2 Cape
825mg/m2/回 1日2回内服 週5日または7日(放射線治療期間中)
2)緩和的放射線療法
a.骨盤内病変(CQ 19)- 骨盤内腫瘍による疼痛,出血,便通障害などの症状緩和を目的とする。
- 標的体積には症状の原因となっている腫瘍を含める。
- 1回1.8~2.0Gy,総線量45~50Gy照射する。
- 全身状態,症状の程度によっては1回線量を多くして短期間で照射を終了することもある。
(1)骨転移
- 疼痛の軽減,病的骨折の予防,脊髄麻痺の予防と治療を目的とする。
- 標的体積には症状の原因となっている腫瘍を含める。
- 局所照射では30Gy/10回,20Gy/5回などの分割照射が広く行われている。
- 血行性転移の項を参照。
- 全脳照射では30Gy/10回が標準的であり,長期予後が期待される場合には37.5Gy/15回ないしは40Gy/20回などを検討する。
- 定位手術的照射では辺縁線量16~25Gyを1回で照射する。
コメント
①骨盤内病変
- 疼痛,出血などの自覚症状,QOLの改善を目的とした放射線治療は有効である。
- 45Gy以上照射された群での症状緩和率は疼痛89~93%,出血79~100%,神経性症状52%,腫瘍の圧排による症状71~88%,滲出液50%,泌尿器科的症状22%,その他の症状42%であった。
- 症状緩和持続期間は3~10カ月である。
②骨盤外病変
(1)骨転移
- 骨転移に対する推奨治療は,抗炎症薬やオピオイド鎮痛薬,癌性疼痛および骨折などの骨関連合併症を軽減するbisphosphonateやdenosumab(抗RANKLE抗体)などの骨代謝修飾薬,放射線療法(放射線医薬品療法含む),インターベンション療法など,病態に応じた組み合わせである。
- 局所照射の疼痛緩和率は70~90%である。
- 疼痛緩和を目的とした場合,線量と効果の明らかな関係は示されておらず,30Gy/10回,20Gy/5回,8Gy/1回などで疼痛緩和効果は同等である。
- 病的骨折や骨折のリスクがある場合,脊髄圧迫症状や神経因性疼痛がある場合,長期予後が期待できる場合などでは,1回照射よりも分割照射が推奨される。
- 多発性骨転移で多数の疼痛部位がある場合には,疼痛緩和を目的としてストロンチウム89による放射線同位元素内用療法が考慮される。疼痛緩和率は60~90%,効果持続期間は3~6カ月である。ただし,血小板減少,白血球減少および貧血などの有害事象があるので,骨髄抑制をもたらす化学療法を施行または予定している場合は慎重な患者選択が必要である。
(2)脳転移
- 血行性転移の項を参照。
(3)肺転移
- 血行性転移の項を参照。
(4)その他の部位
- 頸部リンパ節,傍大動脈リンパ節,鼠径リンパ節,縦隔・肺門リンパ節などのリンパ節転移に対する症状緩和を目的とした放射線治療が考慮されることがある。
7 緩和医療・ケア
- 緩和医療・ケアとは,患者のQOLの維持,向上を目的としたケアの総称である。
- 緩和医療・ケアは,がんの診断がついた時点から終末期までを包括する医療であり,病期や症状により,実施すべき内容が異なる。
- がん治療は症状緩和が図られた状態で行うことが原則であり,外科治療や化学療法の当初から緩和医療を導入するのが望ましい。
- 大腸癌終末期におけるQOL向上のための緩和医療には以下のものが含まれる。
(1)疼痛緩和
(2)外科治療
(3)化学療法
(4)放射線療法
(5)精神症状に対するカウンセリング
コメント
①疼痛緩和のための薬物療法は,WHOのステップラダー(3段階除痛ラダー)および日本緩和医療学会の『がん疼痛の薬物療法に関するガイドライン』に基づいて行うことが望ましい。
②骨盤内再発における臀部痛等には神経ブロックが有効なことがある。
③骨盤内再発や骨転移などによる疼痛には放射線照射が有効なことがある(参照)。
④疼痛の原因となる責任病巣(原発巣や皮下転移,リンパ節転移など)に対する姑息的切除,責任病巣のバイパス手術・人工肛門造設などの外科治療が有効なことがある。
⑤腸管閉塞による経口摂取不能状態の改善や出血のコントロールを目的として,姑息的切除術,バイパス手術,人工肛門造設術を考慮する。外科治療が不可能な腸管閉塞に対しては経肛門的なステント留置が,随伴する嘔気・嘔吐などの消化器症状の緩和には酢酸オクトレオチド投与が有効なことがある。
⑥尿管閉塞に対して,尿管ステント留置や腎瘻造設術などを考慮する。
⑦疾病や予後に対する不安に対してはカウンセリングが有用である。精神症状には,適切な薬物療法による症状緩和を行う。
⑧大腸癌における緩和医療の生命予後への寄与度は明らかでないが,緩和ケアの早期導入により肺癌患者のQOLが向上し,生存期間が有意に延長したとの報告がある。
⑨緩和医療のアウトカム計測のためのQOL評価法の確立が課題である。大腸癌術後のQOL評価法にはEORTC-QLQ-CR38があり,疼痛緩和における代表的なQOL評価法にはBrief Pain Inventory(BPI)がある。当面は,これらの評価法を利用しながらQOLを評価し,データを集積していくことが望ましい。
8 大腸癌手術後のサーベイランス
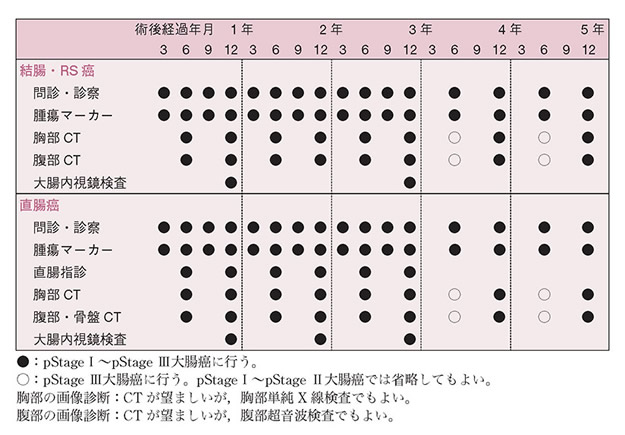
1)大腸癌根治度A切除後の再発に関するサーベイランス
(1)pStage 0(pTis(M)癌)は,切除断端や吻合部の再発を対象とした定期的な内視鏡検査を考慮する。他臓器の再発を対象としたサーベイランスは不要である。
(2)pStage I~pStage IIIは,肝,肺,局所,吻合部,リンパ節,腹膜などの再発をサーベイランスする。以下の点に留意する。
- サーベイランス期間は術後5年間を目安とし,術後3年以内はサーベイランス間隔を短めに設定する。
- 直腸癌では肺転移再発と局所再発の頻度が高いことに留意する。
- 吻合部再発のサーベイランスは術後3年までを目安とする。
- 再発の好発部位,発生頻度,治療効果や,本邦での臨床実状を総合的に判断して導き出された,pStage I~pStage III大腸癌の治癒切除後に推奨されるサーベイランススケジュールの一例を示す。
2)大腸癌根治度B切除後および再発巣切除後のサーベイランス
(1)pStage IV症例のR0切除後(根治度B)と再発巣切除症例のサーベイランスは,Stage IIIの内容に準ずるが,転移・再発の切除臓器に再発・再々発が多いことに留意する。
(2)R1切除のために根治度Bとなった症例は,遺残が疑われる臓器を標的とした綿密なサーベイランスを計画する。
3)異時性多重がんのサーベイランス
- 異時性多発癌のサーベイランスを目的として大腸内視鏡検査を行う。
コメント
①サーベイランスの目的
- 再発を早期に発見し治療することで予後を改善することを目的とする。欧米で行われたランダム化比較試験のメタアナリシスから,大腸癌治癒切除術後のサーベイランスが,再発巣の切除率向上と予後の改善に寄与することが示されている。(CQ 20-1)
②再発率,再発臓器,再発時期
- 再発は術後3年以内に約80%以上,術後5年以内に95%以上が出現した。
- 術後5年を超えての再発は全症例の1%以下であった。
- 肺再発のうち5%は術後5年を超えて出現した。
- 吻合部再発の95%以上は術後3年以内に出現した。
- 局所再発と肺再発は直腸癌に多かった。
- 欧米では,治癒切除後の再発の約50%が術後1年以内,約70%が術後2年以内に出現し,ほとんどの症例は5年以内に再発したことを示す報告がある。
1.pStage I
- pT1(SM)癌の再発率は結腸癌,直腸癌とも約1%であった。
- pT2(MP)癌の再発率は6.4%で,結腸癌では5.0%,直腸癌では8.3%であった。
- 術後3年以内に再発の2/3が出現し,5年を超えての再発は全症例の0.2%以下であった。
2.pStage II, pStage IIIa, pStage IIIb
- Stageが進むに従って再発率が増加した。
- 術後3年以内に再発の78~90%が出現し,5年を超えての再発は全症例の1%以下であった。
③再発巣検索法
(1)問診・診察
- 患者の訴えを聴取し,身体所見をとる(腹部所見,直腸指診など)。
- 直腸指診は,低位前方切除術後の吻合部再発や直腸子宮窩,直腸膀胱窩の再発の診断に有用である。
(2)腫瘍マーカー
- 血清CEAと血清CA19-9を測定する。
(3)胸部CT,胸部単純X線検査
- 胸部CTにて肺転移を検索する。
- 胸部CTを省略して胸部単純X線検査を行う方法もあるが,単純X線検査は空間分解能が低く,切除可能な肺転移を見逃す危険性があることに留意する。
(4)腹部CT,腹部超音波検査
- 腹部CTにて肝転移等の腹部再発巣を検索する。疑診例には腹部MRI(magnetic resonance imaging)を行う。
- 腹部CTを省略して腹部超音波検査を行う方法もあるが,超音波検査の診断精度は検者の技量や検査臓器周囲の腸管の存在に影響されることより,リンパ節転移の検索も同時に行うことができるCTが推奨される。
(5)骨盤CT
- 直腸癌の局所(骨盤内)再発を検索する。
- 再発巣と術後の瘢痕との鑑別は困難である。そのため,基準となる骨盤CTを術後早期に行う方法もある。
- 骨盤内再発疑診例には骨盤MRI,endoluminal ultrasonography,PET(positron emission tomography)/CTを考慮する。
(6)MRI
- 肝転移巣や骨盤内再発巣の確認にMRIを考慮する。
(7)PET/CT
- 再発部位の検索と確定にPET/CTは有用である。
(8)大腸内視鏡検査
- 吻合部再発を検索する。
- 異時性多発癌病巣の発見にも有効である。
- 狭窄などのために,術前に全大腸を十分に検索できなかった場合は,術後6カ月以内に残存大腸の検査を行うことが望ましい。
④サーベイランスの有効性の検証
- サーベイランススケジュールは,Stageごとの再発頻度,再発の好発部位や発生時期に加え,本邦におけるサーベイランスの現況等を考慮して作成した。
- 再発後の治療効果に関して,Stageによる差はないことが示されている。したがって進行度の低い癌に対してもサーベイランスによるsurvival benefitは期待できるが,早期発見に関わる費用対効果はより進行度の高い癌に劣る。現在のところ予後への寄与度が高く,医療経済学的に効率的なことが科学的に検証されたサーベイランスプロトコールは存在しない。(CQ 20-1)
⑤大腸癌根治度B切除後と再発巣切除後のサーベイランス
- 肝切除後の残肝,肺切除後の残肺など,切除した転移巣や再発巣と同一部位に再発,再々発することが多い。
- 術後2年間は転移・再発巣の切除臓器のサーベイランスをよりintensive(3~6カ月毎)に行う方法もある。
- 推奨すべきサーベイランス期間に関する知見はない。
⑥異時性多重がんのサーベイランス
- Stageにかかわらず大腸癌の罹患歴は,異時性大腸癌発生のリスク要因である。
- 推奨される大腸内視鏡検査間隔は,報告によって1~5年の開きがある。
- 多重がんを標的としたサーベイランスの要否に関しては,遺伝性大腸癌を鑑別することが重要である。散発性大腸癌の手術後に他臓器がん(重複がん)の精査を定期的に行う根拠は乏しい。(CQ 20-2)