
Clinical Questions
CQ2:最大径2cm 以上の cM 癌・cSM 癌の内視鏡的摘除
CQ3:大腸癌に対する腹腔鏡下手術
CQ4:切除不能な遠隔転移例における原発巣切除
CQ5:腹膜播種(癌性腹膜炎)の切除
CQ6:直腸癌局所再発に対する外科治療
CQ7:肝・肺転移を有する症例に対する切除
CQ8:肝転移根治切除後の補助化学療法
CQ9:切除可能肝転移に対する術前化学療法
CQ10:切除不能肝転移に対する化学療法
CQ11:術後補助化学療法と年齢
CQ12:Stage II大腸癌に対する術後補助化学療法
CQ13:術後補助化学療法の治療期間
CQ14:術後補助化学療法における oxaliplatin(L−OHP)
CQ15:二次治療における分子標的治療薬
CQ16:KRAS 遺伝子変異と cetuximab
CQ17:直腸癌に対する術前化学放射線療法の意義
CQ18:切除不能な局所進行・局所再発直腸癌に対する化学放射線療法
CQ19:大腸癌術後サーベイランスの意義
19A 再発診断
19B 重複がん
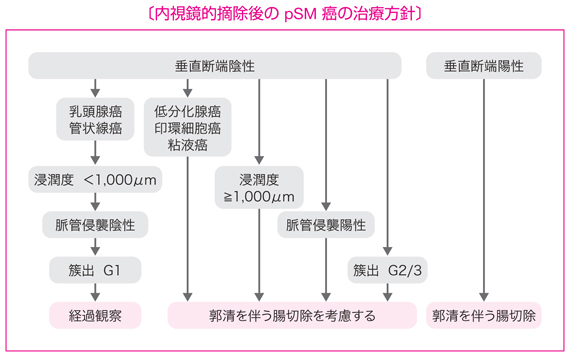
CQ 1:内視鏡的摘除後の追加治療の適応基準
推奨カテゴリー B
- 垂直断端陽性の場合は外科的切除が望ましい。
- 摘除標本の組織学的検索で以下の一因子でも認めれば,追加治療としてリンパ節郭清を伴う腸切除を考慮する。 (1)SM 浸潤度 1,000μm 以上
- 垂直断端陽性とは,癌が粘膜下層断端に露出しているものである。
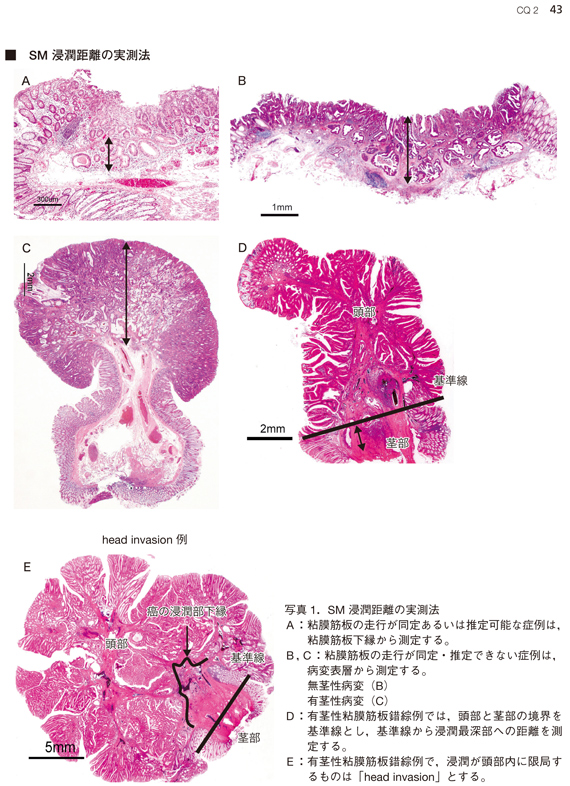
- SM 浸潤度は,42 ページのサイドメモに示す方法に基づいて測定する。
- 脈管侵襲とは,リンパ管侵襲と静脈侵襲をいう(42 ページ参照)。
- 簇出の評価法を 42 ページに示す。
(2)脈管侵襲陽性
(3)低分化腺癌,印環細胞癌,粘液癌
(4)浸潤先進部の簇出(budding)Grade 2/3
注)
浸潤癌である pSM 癌の治療の原則はリンパ節郭清を伴う腸切除である。しかし,転移リスクが極めて低い pSM 癌が存在することも事実であり,そのような症例に対して結果的には過剰治療となる追加切除を可及的に減じることが本基準の作成目的である。現在のところ,リンパ節転移(pN)を確実に予知できる診断法は存在しないが,転移リスクの高低を追加治療実施の判断材料として利用することが可能である。
pSM 癌の所属リンパ節転移リスク因子として,粘膜下層の浸潤距離(SM 浸潤度),低分化腺癌・印環細胞癌・粘液癌などの組織型206),浸潤先進部の低分化領域・粘液結節の存在,簇出,脈管侵襲などが報告されている。
上記の追加治療の適応基準は,『大腸癌取扱い規約』(第 2 版,1980 年)210)に記載されてきた pSM 癌の追加腸切除の 3 項目(①明らかな脈管内癌浸潤,②低分化腺癌あるいは未分化癌,③断端近傍までの massive な癌浸潤)をもとに作成されたものであり,「massive な癌浸潤」は『大腸癌取扱い規約』の第 5 版(1994 年)において「たとえば約 200〜300μm を超えた程度の"きわめて浅い浸潤"より深い浸潤」と具体的記述に改訂された。
その後の本邦における症例集積研究から,この基準線は 1,000μm まで拡大することが可能であることが示された212)。大腸癌研究会のプロジェクト研究によれば SM 浸潤度 1,000μm 以上のリンパ節転移率は 12.5%であった(61 ページ,表 11)。しかしながら,SM 浸潤度 1,000μm 以上であっても 9 割程度はリンパ節転移がないわけであり,SM 浸潤度以外のリンパ節転移危険因子,個々の症例の身体的・社会的背景,患者自身の意志等を十分に考慮したうえで追加治療の適応を決定することが重要である。大腸癌研究会のプロジェクト研究からリンパ節転移危険因子としての簇出(budding)の重要性が示されたため,本改訂において追加腸切除を考慮すべき因子に追加した。なお,海外には,追加治療の適応基準として浸潤距離および簇出が採用されているガイドラインはない。
CQ 2:最大径 2 cm 以上の cM 癌・cSM 癌の内視鏡的摘除
推奨カテゴリー B
正確な術前内視鏡診断が必須であり,術者の内視鏡的摘除の技量を考慮して,EMR,分割 EMR,ESD による摘除の適応を決定する。病変の大きさにかかわらず,cSM 高度浸潤癌は内視鏡的治療の適応外である。cM および cSM 軽度浸潤癌は内視鏡的摘除が適応であるが,摘除標本の正確な病理診断のために癌病変の一括切除が要件である。一般にスネアのサイズから EMR で完全一括摘除が可能な病変は最大径 2 cm 程度である。しかし,腺腫成分を伴う病変(腺腫内癌)では腺腫部分での分断による計画的分割 EMR(癌部分は一括切除する)の根治性が証明されており,最大径 2 cm 以上のいわゆる LST(laterally spreading tumor)が分割 EMR のよい適応である。ただし,分割 EMR には確実なスネアリング技術が必要であることに留意すべきである。なお,腺腫成分と癌部の判別には,インジゴカルミン散布による色素内視鏡観察や拡大観察による pit pattern 診断が有用である。ESD を用いれば 2 cm 以上の病変も一括摘除が可能であるが,手技の難度が高く,穿孔などの偶発症発症率も高いことを十分に考慮して実施すべきである。
CQ 3:大腸癌に対する腹腔鏡下手術
推奨カテゴリー B
腹腔鏡下手術には,開腹手術とは異なる手術技術の習得と局所解剖の理解が不可欠であり,手術チームの習熟度に応じた適応基準を個々に決定すべきである。腹腔鏡下手術は,結腸癌および RS 癌に対する D2 以下の腸切除に適しており,cStage 0〜cStage Iがよい適応である。D3 を伴う腹腔鏡下結腸切除術は難度が高いので,cStage II〜cStage IIIに対しては習熟度を十分に考慮して適応を決定すべきである。また,横行結腸癌,高度肥満例,高度癒着例も高難度である。直腸癌に対する腹腔鏡下手術の有効性と安全性は十分に確立されていない。
海外の大規模 RCT や Cochrane review において,結腸癌および RS 癌に対する腹腔鏡下手術の有用性が開腹手術との比較で検討され,腸管運動回復や入院期間など短期成績の優越性,合併症発生率および再発率・生存率の同等性が多く報告されている。しかし,例えば Stage IIIの開腹手術群の 5 年生存率が 50%と低率であることなど,本邦の治療成績とは乖離した報告もあり,外的妥当性の吟味が必要である。
横行結腸癌は多くの RCT で除外条件とされているが,横行結腸癌に対する腹腔鏡下手術は開腹手術よりも長い手術時間を要するという報告もあり,解剖学的特性による難度を考慮して適応を決定する必要がある。その他,肥満例は開腹手術への移行率が高く,手術時間が長く,合併症率も高いこと,開腹既往歴を有する例は癒着のために難度が高く,開腹手術への移行率が高いことを考慮すべきである。わが国の治療経験に基づく適応の詳細を決するには,前向き試験による多数の集積例による検討が必要である。直腸癌も多くの RCT で対象外であり,Cochrane review を通覧しても直腸癌を対象とした RCT は少ない。直腸癌も検討した MRC CLASICC 試験では,局所再発率には有意差を認めないものの,circumferential margin 陽性率は高率である。直腸癌に対する腹腔鏡下手術は,経験の集積が限定されていることに加えて,概して腸管切離・吻合操作の難度が高いこと,Rb 進行癌に適応される側方郭清の腹腔鏡下という条件での手技が確立されていないこともあり,現時点では適正に計画された臨床試験として実施し,有効性と安全性を確認する必要がある。
CQ 4:切除不能な遠隔転移例における原発巣切除
推奨カテゴリー B
原発巣切除の適否は,原発巣による症状,遠隔転移の状態,全身状態等,個々の状況に応じて決定すべきである。他の療法では制御困難な原発巣による症状があり,耐術能に問題がなく,過大侵襲とならない切除であれば,原発巣切除が望ましい場合が多い。切除不能な遠隔転移を有する大腸癌の原発巣切除の適応は議論の多い課題である。閉塞や出血など,保存的療法では制御困難な症状を緩和する目的で行われる原発巣切除あるいは人工肛門造設などによる腸管空置術については異論が少ないが,無症状ないし症状が軽微な症例に対する適応にはさまざまな考えがある。無症状例に対して,予測される症状の出現に先んじて原発巣切除を行うことの有用性が問題となるが,限られた生命予後のなかで原発巣の症状緩和がどれほど QOL の改善に寄与するかを予測することは容易ではない。しかも,本病態は高度の進行坦癌状態であり,手術合併症や手術死亡のリスクが高いことも負の要因である。
近年著しく進歩した全身化学療法によって切除不能な転移巣が切除可能となる症例を経験することが少なくなくなり,症状緩和とは別に,根治も視野に入れた原発巣切除の意義が見直されるようになってきている。しかし,現状では実際に根治が得られることは例外的であり,身体機能や免疫能の低下をもたらす手術を回避し,有効な全身化学療法を可及的に早く開始することが原発巣のコントロールにも有効であるという考えもある。たとえば,腸管閉塞に対しては,ステント留置の有用性も報告されており,切除以外の手段による症状コントロールが可能な症例があることにも留意すべきである。
以上より,原発巣切除の適応は,原発巣の症状,転移の状態,全身状態のほか,生命予後,手術のリスク,切除による症状緩和の効果予測を症例ごとに評価して決定すべきである。
CQ 5:腹膜播種(癌性腹膜炎)の切除
推奨カテゴリー C
限局性播種(P1,P2)で,他に切除不能な遠隔転移がなく,過大侵襲とならない切除であれば,原発巣切除と同時に腹膜播種巣を切除することが望ましい。腹膜播種巣切除の有効性を証明する大規模臨床試験はないが,予後の改善や長期生存例が報告されており,過大な侵襲を伴わずに切除可能な限局性播種(P1,P2)は切除することが望ましい。
海外からは,広範な播種(P3)に対する全腹膜切除(total peritonectomy)の有効性が報告されている。腹腔内温熱化学療法との併用が標準的とされるが,実際に本療法を実施しているのは海外でも限られた医療機関のみである。本療法を施行した 506 例の MST は 19.2 カ月で,5 年以上の長期生存もあること,5−FU/LV 全身化学療法を対照群とした RCT で本療法群の MST が有意に長いことなどの報告がある。しかしながら,本邦においてはほとんど治療実績を有しない療法であり,一般の医療機関で実施できるものではない。適正に計画された臨床試験として本療法の有効性と安全性を確認していく必要がある。
CQ 6:直腸癌局所再発に対する外科治療
推奨カテゴリー B
R0 切除が可能と判断される直腸癌局所再発に対しては切除を考慮すべきである。直腸癌局所再発に対し,外科治療と放射線療法を比較した RCT はないが,外科治療例の 5 年生存率は 20〜40%であり,これに相応する放射線療法の治療成績はない。切除可能な局所再発に対しては切除を考慮すべきである。ただし,R0 を目指した切除でも,癌が遺残した場合の予後は極めて不良であること,手術合併症の発生率が高いこと,骨盤内臓器や仙骨合併切除は QOL に多大な影響を及ぼす術式であることについて十分なインフォームド・コンセントを得ることが不可欠である。吻合部再発と前方再発は R0 切除可能例が多いが,後方再発でも仙尾骨合併切除により R0 切除が可能となるものがある。ただし,第 2 仙骨下縁より高位の切断が必要な再発は手術の適応外とするのが一般的である。遠隔転移を有する症例は切除の適応外とするのが原則であるが,遠隔転移の合併切除で根治性が得られるものもある。仙骨神経叢浸潤による疼痛や下肢の浮腫,術前 CEA 高値などは予後不良因子であり,再発に起因する水腎症は手術適応の除外因子と考えられる。初回手術で側方郭清が行われている症例の側方再発では完全切除が行える可能性は低いとされる。
手術補助療法として放射線療法の有効性が認められており,特に放射線治療歴のない症例では切除率,括約筋温存率の向上に寄与することが報告されている。欧米では初発癌の手術補助療法として放射線療法を用いることが多いので,局所再発に対する追加照射の安全性が危惧されるが,照射法を工夫することで放射線治療歴がある局所再発にも比較的安全に実施可能とされる。
以上から,直腸癌局所再発に対しては外科治療が第一選択である。側方郭清という独自の治療方針をもち,放射線治療歴のない局所再発が多い本邦において,どのように放射線療法を活用するかが焦眉の検討課題である。
CQ 7:肝・肺転移を有する症例に対する切除
推奨カテゴリー C
同時期に肝・肺転移を有する症例に対する切除の有効性が示されており,切除可能な肝・肺転移に対しては切除を考慮すべきである。しかし,手術適応基準を決するに足るデータはない。治癒率は高くないこと,切除の予後予測因子(predictive factor)は不明であることなどに関する十分なインフォームド・コンセントを得る必要がある。
同時期に肝・肺転移をともに有する症例でも切除により長期生存あるいは治癒が得られることがある。しかしながら肝・肺転移をともに有する症例では原発巣や転移巣の進展が高度であることや,肝・肺以外にも転移を認めることが多く,完全切除が施行される症例は極めて少ない。本邦における Kobayashi らの集計によれば,351 例の肺転移切除例のうち 47 例に肝転移切除が行われたが,同時期に肝・肺転移が切除されたのは 7 例(2%)のみであった。このような希少性から,肝・肺切除が有効となる予後予測因子は十分解明されていないが,同時性転移よりも異時性転移のほうが予後良好であること,同時期に肝・肺転移を有する症例で切除が有効なのは孤立性肺転移例のみであること,同時・異時切除にかかわらず術前 CEA と CA19−9 が予後因子であること,無再発期間,肝転移個数,年齢が予後因子として重要であることなどの報告がある。
肝・肺転移をともに有する症例に対する外科治療に関して,報告されているのはすべて後ろ向き研究であるが,肝・肺転移の切除が予後改善に寄与する症例が一定の割合で存在することは確かであり,予後予測因子を中心とした手術適応基準を確立することが急務である。
CQ 8:肝転移根治切除後の補助化学療法
推奨カテゴリー B
肝切除後の補助化学療法の有効性は確立されていない。臨床試験として検証していくことが望ましい。大腸癌肝転移根治切除後の補助化学療法としての肝動注療法と全身化学療法の有効性と安全性が臨床試験で検討されてきた。肝動注療法による生存期間の延長と残肝再発防止への明確な治療効果は認められておらず,全身化学療法による生存期間の延長を証明した報告もない。近年の大規模 RCT からは,5−FU/LV 動注群の生存率と残肝無再発率は手術単独群と差がないとする報告がある一方,FUDR 肝動注+5−FU 静注併用による治療群の生存期間は手術単独群と差がないものの,残肝無再発率は有意に低率であったことが報告されている。全身化学療法に関しては,全身化学療法(5−FU/LV)群の 5 年全生存率は無治療群と差はなかったが,5 年無病生存率は良好であったこと(FFCD09002 試験),5−FU/LV(LV5FU)療法と LV5FU+CPT−11 の比較では,無病生存期間に差はなく CPT−11 の上乗せ効果は認められなかったことなどが報告されている。
以上のように,肝転移根治切除例に対する補助化学療法の有効性を明確に示すエビデンスは認められていない。しかし,Stage IIIに対する補助化学療法の有効性が確立している現在,Stage IIIよりも再発リスクが明らかに高い Stage IVに対する補助化学療法を実地臨床の場で実施することは容認されるべきものと考えられる。しかしながら,肝切除後という病態に対する補助化学療法の安全性という側面も十分に考慮すべきことから,その有効性と安全性は臨床試験として検証していくことが合理的である。
CQ 9:切除可能肝転移に対する術前化学療法
推奨カテゴリー B
切除可能肝転移に対する術前化学療法の安全性は確立されていない。適正に計画された臨床試験として実施すべきである。術前化学療法の主たる目的は,down staging,腫瘍縮小に伴う肝切除量の減少,微小転移巣の早期治療,化学療法の奏効性判定であるが,非奏効例が切除不能となるリスク,抗がん剤による肝障害や周術期合併症などの問題もある。
従来,術前化学療法の奏効例の予後が良好であることが後ろ向き研究から知られていたが,2008 年に EORTC による大規模 RCT の結果が報告され,術前後の FOLFOX4 療法群(FOLFOX 群)の 3 年 PFS*(36.2%)は手術単独群(28.1%)よりも有意に高く,化学療法が生存期間の延長に寄与する可能性が示唆されている。しかしながら,FOLFOX4 療法の完遂率は 71.3%で,重篤な副作用は認められず,手術施行率,切除率は両群とも同等であったが,FOLFOX 群は手術合併症が高いことから,安全性に関しては課題が残されている。また,手術単独群の PFS 曲線は,術後 2 カ月付近に大きな落ち込みがあり,これが PFS の差をもたらしているとの批判もあり,さらなる症例集積による検証が必要である。
近年,術前化学療法,特に CPT−11,L−OHP による肝障害の実態が明らかになってきた。FOLFIRI 等の CPT−11 ベースのレジメンでは脂肪性肝炎(脂肪肝),FOLFOX 等の L−OHP ベースのレジメンでは血管変性(類洞の拡張等)の発生が特徴的である。脂肪性肝炎は肝切除術後の早期死亡率と相関するとされる一方,血管変性は周術期合併症の増加が示唆されるものの,手術死亡率には影響しないとされており,後者の安全性が高いと考えられている。奏効率の高い新規抗がん剤を用いた術前化学療法の臨床研究は緒についたところで,至適な化学療法レジメン,手術のタイミング等は,適正に計画された臨床試験でさらに検討すべき課題である。(*PFS progression free survival,無増悪生存率)
CQ 10:切除不能肝転移に対する化学療法
推奨カテゴリー B
化学療法が奏効して切除可能となった肝転移には肝切除を考慮すべきである。切除不能肝転移に対する肝動注療法と全身化学療法の生存期間の延長効果には明らかな差は認められていない。
切除不能と判断される肝単独転移例に対する化学療法の有効性と安全性に関しては,いまだ十分なエビデンスの集積はなされてはいないのが現状であるが,近年,全身化学療法後に根治切除が可能になる症例が報告されるようになってきた。化学療法が奏効して切除可能となった症例の予後は,当初から切除可能な肝転移例と同程度であるとする報告が多く,このような肝転移に対しては切除を考慮すべきである。ただし,全身化学療法後に切除を行っても当初から切除可能な肝転移例ほどの予後は期待できないとの報告があることにも留意すべきである。
切除不能肝転移に対する肝動注療法は,肝転移巣に対する奏効率は高いが,生存期間への効果は明らかでない。CALGB−9481 試験は,大規模 RCT として肝動注療法が奏効率,生存期間ともに全身化学療法(5−FU/LV 静注療法)を凌駕する成績を示したが,その後に報告されたメタアナリシスでは,肝動注療法は全身化学療法よりも肝転移巣に対する奏効率は高いが,生存期間への効果は認められなかった。ただし,解析対象の大部分が FUDR ベースであったこと,全身化学療法との併用が考慮されていなかったことなどから,解析自体に対する反論も少なくない。Phase I試験ではあるが,FUDR の肝動注療法と L−OHP を含む全身化学療法の併用で,奏効率 88%,MST 22 カ月以上とする報告もあり,全身化学療法と肝動注療法の優劣を決するにはさらなる検討が必要である。
CQ 11:術後補助化学療法と年齢
推奨カテゴリー A
70 歳以上の高齢者でも,PS が良好で主要臓器機能が保たれており,化学療法に対してリスクとなるような合併症がなければ,術後補助化学療法を行うことが可能である。欧米で行われた RCT の pooled analysis などの解析から,70 歳以上の患者においても,60 歳以下の患者と同等の再発抑制効果と生存期間延長が示されている。副作用については,高齢者では好中球減少が強く出る傾向にあるが,他の有害事象についてはほぼ同等である。ただし,Mayo 法では粘膜障害などがより強く出る傾向があるため,高齢者には Mayo 法は行うべきではない。多くの高齢者では種々の合併症をもつことが多いため,適応の判断には主要臓器機能や全身状態を加味して慎重に判断する必要がある。
CQ 12:Stage II大腸癌に対する術後補助化学療法
推奨カテゴリー A
Stage II大腸癌に対する術後補助化学療法の有用性は確立しておらず,すべての Stage II大腸癌に対して一律に補助化学療法を適応することは妥当ではない。Stage II大腸癌に対する術後補助化学療法による全生存率への上乗せ効果は 3〜5%程度と報告されている。3,238 名の結腸癌と直腸癌(Stage IIは 91%)を対象とした 5−FU/LV(+/−)levamisole 群と手術単独群を比較した QUASAR 試験では,化学療法群の再発率および生存率が良好で,5 年生存率で 3〜4%の上乗せ効果がみられたが,Stage IIのみでは有意差は得られなかった。また,T3N0 を対象とした 5−FU/LV 群と手術単独群の RCT の pooled analysis(IMPACT B2)では再発率・生存率ともに有意差はなく,メタアナリシスや SEER database reviewでも化学療法群の生存期間が良好な傾向があるものの有意差は得られなかった。
こうしたなかで,海外のガイドラインには Stage II結腸癌のなかに再発高リスク群を設定し,期待される効果と予想される副作用を十分説明したうえで,術後補助化学療法を行うという方針を示すものもあり,この場合,Stage III結腸癌と同じ治療法と投与期間が用いられている。再発高リスク要因としては,高レベルのエビデンスに基づくものではないものの,ASCO2004 ガイドラインでは,郭清リンパ節個数 12 個未満,T4 症例,穿孔例,低分化腺癌・印環細胞癌・粘液癌症例,ESMO ガイドラインでは,T4,低分化腺癌または未分化癌,脈管侵襲,リンパ管侵襲,傍神経浸潤,初発症状が腸閉塞または腸穿孔,郭清リンパ節個数が 12 個未満,高 CEA レベルと規定している。再発高リスク群に対する補助化学療法の有効性は確認されていないが,Stage IIのなかでも予後不良なサブグループに的を絞って補助療法を行うという戦略は,現時点では妥当な選択と考えられる。Stage II直腸癌における再発高リスク因子は確立していないが,当面は上述の結腸癌のリスク因子を参考として術後補助化学療法の適応を決定し,前向き研究として検討していくことが望まれる。
以上から,Stage II大腸癌に対する術後補助化学療法の有用性は確立されておらず,現時点では Stage II大腸癌に一律に術後補助化学療法を適応することは推奨されない。Stage IIの手術単独療法の治療成績,補助化学療法による負の効果,すなわち抗がん剤の副作用,医療コストなどを斟酌し,個々の症例の再発リスクに応じて補助化学療法の適応を決定することが望ましい。現在,国内で Stage IIを対象に手術単独群を対照においた大規模 RCT が進行中であり,その結果が待たれるところである。
CQ 13:術後補助化学療法の治療期間
推奨カテゴリー A
術後補助化学療法の治療期間については確定的な結論は得られていないが,現在のところ 5−FU ベースの補助化学療法は,6 カ月投与が標準的である。欧米の RCT において,5−FU/LV(+LEV)の 6〜8 カ月間投与に対する 12 カ月投与の優越性は示されていない。Intergroup プロトコール−0089 では,5−FU+LEV(12 カ月)を対照群として,5−FU/LV(Mayo 法を 27 週,または RPMI 法を 32 週)および 5−FU/LV+LEV(6 カ月投与)の比較検討がなされた。3.8 年後の無再発生存期間および生存期間には 4 群間の差が認められなかった。毒性,コスト,患者の利便性の観点から,5−FU+LEV の 12 カ月よりも 5−FU/LV の 6〜8 カ月投与の方が好ましいと結論された。一方,NCCTG と NCIC は,再発高リスク結腸癌の術後補助療法として投与期間を評価する臨床試験を報告した(NCCTG 89−46−51)。2×2 要因デザインで 5−FU+LEV もしくは 5−FU/LV+LEV の 6 カ月と 12 カ月投与を比較した結果,いずれのレジメンおよび投与期間も無再発率,全体生存割合に有意な影響を及ぼさないことが示された。しかし,投与期間—レジメンの有意な相関が認められたため,各投与群について別々に解析が行われた結果,5−FU/LV+LEV の 6 カ月投与の生存割合が最も高かったが,各レジメンの 12 カ月投与より有意に優れていることは示されていない。
一方,Mayo 法の 24 週投与と 5−FU 持続静注(300 mg/m2)の 12 週投与を比較した試験では,無再発生存期間と生存期間に有意差はなく,持続静注は下痢や好中球減少などの有害事象が少なかったと報告されている。
以上から,間接的であるが 5−FU/LV の 6 カ月投与(週 1 回投与)は,5−FU+LEV や5−FU/LV の 1 年間投与と同等以上の有効性があることが示唆され,現在,標準的な治療と考えられている。経口抗がん剤の内服期間は,5−FU/LV との同等性を検討した NSABP C−06と XACT 試験では静注法と同じ 6 カ月投与が採用されたが,NSAS−CC の治療群の UFT は 12 カ月投与である。現在,国内では経口抗がん剤,海外では FOLFOX4 の至適投与期間を検討する比較試験が行われているところであり,本課題の確証的な結論を得るまでにはさらなる検討が必要である。
CQ 14:術後補助化学療法における oxaliplatin(L−OHP)
推奨カテゴリー A
L-OHP は 2009 年 8 月,術後補助化学療法の適応が承認された。対象の選択にあたっては,期待される生存期間の上乗せ効果のみならず,有害事象および医療コストについての十分なインフォームド・コンセントのもとに適応を判断する必要がある。欧米における RCT から,Stage III結腸癌術後補助化学療法としての 5-FU+LV+L-OHP(FOLFOX4 療法,FLOX 療法)の有用性が報告されている。Stage III結腸癌の術後補助化学療法として静注 5-FU+LV との比較を行った 2 つの RCT(MOSAIC 試験,NSABP C−07)で L-OHP の上乗せ効果の有効性が示されている。現在,欧米ではこれらの RCT を踏まえて,5-FU+LV+L-OHP が Stage III 結腸癌術後補助化学療法の標準に位置づけられている。MOSAIC 試験の 6 年追跡データでは,FOLFOX4 療法と LV5FU2 療法の 6 年生存率は,それぞれ 73.0%および 68.6%であった。
一方,FOLFOX4 療法では発熱性好中球減少や Grade 3/4 の下痢の発生頻度が高く,Grade 3 の末梢神経障害が 12.4%に出現し,末梢神経障害の未回復例が治療終了 3 年後にも 15%に認められている。同様に NSABP C−07 においても,FLOX 療法の有効性が示されたが,38%に Grade 3/4 の下痢が発生している。
ひるがえって,日本の結腸癌の手術治療成績は概して海外よりも良好であり,例えば大腸癌全国集計によれば Stage IIIa,Stage IIIb 結腸癌の 5 年全生存率はそれぞれ 76.1%,62.1%である(59 ページ, 表 5 参照)。L-OHP の使用にあたっては,それぞれの施設の手術治療成績,有害事象(特に末梢神経障害と下痢),および医療コストを含めて適応を吟味する必要がある。
なお,経口抗がん剤と L-OHP との併用療法は,欧米での有用性の報告はあるものの,国内では 2010 年 7 月現在,術後補助化学療法として未承認である。
CQ 15:二次治療における分子標的治療薬
推奨カテゴリー B
一次治療に bevacizumab 投与がされていない場合の二次治療においては,投与可能な症例に対しては bevacizumab の適正使用に準拠した投与を行うことが望ましい。 この場合の至適投与量(5 mg/kg または 10 mg/kg)についての明確なエビデンスはない。一次治療に bevacizumab が投与され,一次治療の効果が持続しているが,抗がん剤の有害事象により投与継続が困難になった場合は,bevacizumabを継続投与することが望ましい。一方,bevacizumab を含む一次治療の効果が増悪(PD)であった場合の二次治療における bevacizumabの継続投与については,有用性を示す報告があるものの,前向き臨床試験によるエビデンスは確立されていない。なお,5−FU,CPT−11,L−OHP を含むレジメンに抵抗性となった三次治療以降でのbevacizumab 投与は推奨されない。
二次治療としての cetuximab の投与(FOLFIRI 療法(または CPT-11 単独)+cetuximab)は,無増悪生存期間(PFS:progression free survival)の延長に寄与することが示されたが,全生存期間(OS:overall survival)では CPT-11 単独療法と差が確認されておらず, 同様に,KRAS 野生型に限定した二次治療としての panitumumab の投与(FOLFIRI 療法(または CPT-11 単独)+panitumumab)も PFS の延長に寄与することが示されたが,OS では FOLFIRI 療法と差が確認されていない。
分子標的治療薬は,このような海外のエビデンスに基づいて適応を決定することが重要である。また高額でありかつ特有の副作用を有するため,治療の利益と不利益を十分に考慮して適正に使用すべきである。
CQ 16:KRAS 遺伝子変異と cetuximab
推奨カテゴリー A
抗 EGFR 抗体薬は KRAS 遺伝子に変異がない大腸癌において有用性が報告されている。癌組織の KRAS 遺伝子変異と抗 EGFR 抗体薬の有効性との間に密接な相関があることが報告され,KRAS 遺伝子変異例には,抗 EGFR 抗体薬の投与は推奨されない。
CQ 17:直腸癌に対する術前化学放射線療法の意義
推奨カテゴリー C
欧米では直腸癌に対する術前化学放射線療法が標準的治療に位置づけられているが,本邦では有効性と安全性を示すエビデンスが乏しい。適正に計画された臨床試験として実施することが望ましい。本邦の大腸癌専門施設においては,下部直腸進行癌に対しては TME あるいは TSME+側方郭清が標準的に行われており,生存率が良好で,局所再発率も低いこともあり,欧米で標準である術前化学放射線療法は積極的には行われていないのが現状である。術前化学放射線療法の目的として,局所制御率の向上,生存率の向上,切除率の向上,括約筋温存の企図などがあるが,本邦では,それらの有用性を示す RCT はない。術前照射と側方リンパ節郭清の有無を比較した本邦における第III相試験では,両群の無再発率,全生存率に差はなく,側方郭清を施行しない群で有意に排尿障害,性機能障害が少ないことが報告されているが,45 例と少数例の検討であることから,この報告の意義は限定的である。一方,術前放射線療法には腸管障害,性機能障害などの有害事象があり,術前化学放射線療法が予防的側方郭清の代替になるか否かは,有害事象も考慮した適切に計画された臨床試験での評価が必要である。
現在,新規抗がん剤を併用することで術前化学放射線療法の有効性が高まることが示唆されており306−311),本邦においても検討の余地がある。また,新しい照射方法として,三次元原体照射の進化形であり,逆方向治療計画(インバースプラン)に基づき空間的,時間的に不均一な放射線強度をもつ照射ビームを多方向から照射することにより病巣部に最適な線量分布を得ることが可能な強度変調放射線治療(intensity modulated radiotherapy:IMRT)がある。骨盤照射において,腸管や膀胱,骨盤骨への線量を低減させて,消化器毒性,骨髄毒性の軽減を図ることができるが,その有用性については欧米において臨床試験で検討中である。
CQ 18:切除不能な局所進行・局所再発直腸癌に対する化学放射線療法
推奨カテゴリー C
切除不能と判断される局所進行・局所再発直腸癌に対しても,R0 切除による治癒を指向した化学放射線療法の適応を検討する。切除不能な局所進行・局所再発直腸癌に対しても,R0 切除を目指した化学放射線療法が行われている(CQ−6 参照)。切除不能直腸癌だけを対象とした RCT は行われていないが,切除断端と pCR が重要な予後因子であるとされ,さまざまな抗がん剤との併用療法が検討されている。NCCN のガイドラインは,5-FU ベースの化学療法の併用,骨盤部への 45〜50 Gy/25〜28 分割の線量投与,腫瘍局所への 5.4 Gy/3 分割の追加照射を行い,手術で切除断端陰性が得られれば,術後に 5-FU ベースの化学療法を追加,切除断端に癌が近接しているか断端陽性であれば,術中または術後照射を追加することを推奨している。
術中照射は,実施可能な施設が限られるものの,術前化学放射線療法後に 10〜20 Gy の術中照射を行い,予後が改善したという報告があり,特に他臓器浸潤例または再発例で切除断端が陽性もしくは近接している場合には局所制御率の向上のために考慮してもよい療法である。
近年,三次元原体照射や強度変調放射線治療などが利用できるようになり,有害事象が危惧される小腸などの隣接臓器への線量を低下させながら,病変部への線量を増加することが可能となってきた。また,炭素線,陽子線などの重イオン線を用いた治療により卓越した線量分布が可能となり,特に炭素線は高い生物学的効果が期待されている。今後はこれらの放射線療法を用いて,標的体積の設定法,線量増加,併用薬剤等による有効性と安全性の向上について,適正に計画された臨床試験を実施していく必要がある。
CQ 19:大腸癌術後サーベイランスの意義
19 A 再発診断
推奨カテゴリー A
再発の早期発見が予後向上に寄与することが示されており,定期的な術後サーベイランスを実施すべきである。ただし,医療経済学的観点も含めた至適なサーベイランスプロトコールは十分に確立されていない。
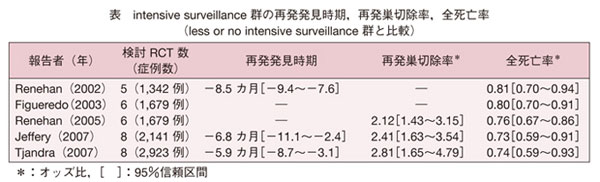
定期的にサーベイランスを行う背景には,「再発の早期発見が予後の改善に結びつく」という前提が存在する。本邦には大腸癌術後のサーベイランスの意義を系統的に検証した臨床試験は存在しないが,欧米ではサーベイランスの疎密と予後の関連が複数の RCT で検討されている。これらのなかには intensive なサーベイランスが良好な予後に寄与するという報告がある一方,その有効性を否定する報告もある。
メタアナリシスによる研究のうち RCT を解析した 5 つの報告を示す(表)。サーベイランスプロトコール自体が相違する試験の解析ではあるが,いずれも intensive なサーベイランス群の再発切除率と予後が対照群を有意に上回り,定期的なサーベイランスによる再発の早期発見は予後向上に寄与することが示されている。ただし,これらの臨床試験で intensive に位置づけられているサーベイランスには,検査間隔が長く,腫瘍マーカーの測定や画像診断を省略しているものがあるなど,本邦で一般的に行われているサーベイランスよりも low intensity なものが少なくないことに留意する必要がある。
本邦における現状のサーベイランスの妥当性,新しい診断モダリティの導入,さらに intensive なスケジュールを組むことの臨床的意義に関する解答は,過去の臨床試験からは得られず,最良なサーベイランスの方法の確立は今後の課題である。
19 B 重複がん
推奨カテゴリー B
遺伝性大腸癌以外の大腸癌の罹患歴は他臓器癌発生のリスク要因として確認されておらず,大腸癌術後に重複がんを対象とした特別なサーベイランスを組み込むことは不要である。大腸癌には,大腸多発癌,重複がんの高い発生リスクを有する遺伝性大腸癌がある。日常診療においては,遺伝性大腸癌を鑑別することが極めて重要であり,遺伝性大腸癌に対しては適切なカウンセリングのもとに多重がんのサーベイランスを実施することが不可欠である。しかしこのようなサーベイランスを遺伝性大腸癌以外の sporadic な大腸癌に行うことは妥当ではない。sporadic な大腸癌についていえば,本邦における異時性重複がんの発生頻度は 1〜5%とされる。同時性重複がんと同様に胃が最も多く,大腸癌術後の胃癌発生頻度は 1%前後とされる。ほかにも,肺癌,肝癌の頻度が高いとされるが,いずれも一般人口の罹患率を上回るものではない。一方,前立腺癌,子宮体癌,卵巣癌,乳癌,小腸癌,女性の甲状腺癌などの発生頻度が高いとする報告があるが,多くは欧米からの報告であり,遺伝性大腸癌との関連も明確ではなく,本邦においては重複がんのサーベイランスの有効性を支持するデータは存在しない。
以上から,重複がんのサーベイランスに関しては,医療経済的側面も考慮した検討が必要であり,重複がん発生リスクの評価基準の確立が急務であるが,現状では大腸癌術後に重複がんを標的とするサーベイランスを実施する根拠は乏しく,がん検診の必要性を啓発し,定期的な検診を勧めるのが妥当である。









