
Clinical Questions
CQ 2:早期大腸癌の内視鏡切除後にサーベイランスは推奨されるか?
CQ 3:大腸癌に対するロボット支援手術は推奨されるか?
CQ 4:閉塞性大腸癌にステント治療は推奨されるか?
CQ 5:切除不能な遠隔転移を有するStage Ⅳ大腸癌に対する原発巣切除は推奨されるか?
CQ 6:Stage Ⅲ大腸癌に術後補助化学療法は推奨されるか?
CQ 7:Stage Ⅱ大腸癌に術後補助化学療法は推奨されるか?
CQ 8:80歳以上の高齢者に術後補助化学療法は推奨されるか?
CQ 9:周術期薬物療法の前にバイオマーカー検査は推奨されるか?
CQ 10:直腸癌に対して側方郭清は推奨されるか?
CQ 11:切除可能な直腸癌に対して術前治療は推奨されるか?
CQ 12:直腸癌に対するTotal Neoadjuvant Therapy(TNT)は推奨されるか?
CQ 13:直腸癌術前治療後cCR症例に対するNon-Operative Management(NOM)は推奨されるか?
CQ 14:直腸癌局所再発の切除は推奨されるか?
CQ 15:遠隔転移のない切除不能直腸癌局所再発に対する放射線治療は推奨されるか?
CQ 16:薬物療法が奏効して画像上消失した肝転移巣の切除は推奨されるか?
CQ 17:大腸癌肝転移に対する低侵襲手術は推奨されるか?
CQ 18:肝転移巣に対する熱凝固療法は推奨されるか?
CQ 19:切除可能な肝転移に対する術前化学療法は推奨されるか?
CQ 20:肝転移巣切除後の術後補助化学療法は推奨されるか?
CQ 21:肝転移以外の遠隔転移巣切除後の術後補助化学療法は推奨されるか?
CQ 22:大腸癌の卵巣転移に対して卵巣切除は推奨されるか?
CQ 23:切除不能大腸癌に対する免疫チェックポイント阻害薬は推奨されるか?
CQ 24:切除不能大腸癌に対する後方治療は推奨されるか?
CQ 25:切除不能大腸癌に対する導入薬物療法後の維持療法は推奨されるか?
CQ 26:切除不能大腸癌に対する包括的がんゲノムプロファイリング検査は推奨されるか?
CQ 27:大腸癌治癒切除後に多重がん(多発癌および重複がん)のサーベイランスは推奨されるか?
CQ 28:肛門管扁平上皮癌に対して化学放射線療法は推奨されるか?
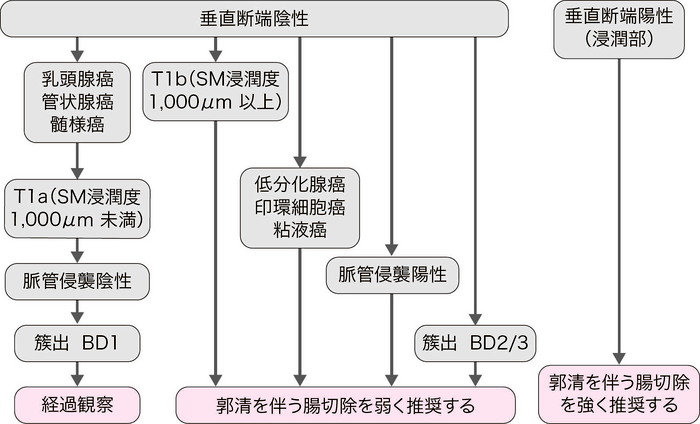
CQ 1:内視鏡切除されたpT1大腸癌の追加治療の適応基準は何か?
- 垂直断端陽性(浸潤部)の場合は外科切除を追加することを強く推奨する。(推奨度1・エビデンスレベルC,合意率:96%)
-
切除標本の組織学的検索で以下の一因子でも認めれば,追加治療としてリンパ節郭清を伴う腸切除を弱く推奨する。(推奨度2・エビデンスレベルB,合意率:96%)
- (1)
- T1b(SM浸潤度1,000μm以上)
- (2)
- 脈管侵襲陽性
- (3)
- 低分化腺癌,印環細胞癌,粘液癌
- (4)
- 浸潤先進部の簇出(budding)BD2/3
- 垂直断端陽性とは,浸潤部で癌が粘膜下層断端に露出しているものである。
- 脈管侵襲とは,リンパ管侵襲と静脈侵襲をいう。
垂直断端陽性(浸潤部)の場合は断端陰性と比べて,癌の局所遺残や,切除標本による浸潤先進部の正確な病理組織診断ができない,などの問題から,経過観察した場合の再発リスクが高いと考えられる。エビデンスレベルはCであるが,害と益のバランスを考慮し「強い推奨」とした。
浸潤癌であるpT1癌の治療の原則はリンパ節郭清を伴う腸切除である。しかし,転移リスクが極めて低いpT1癌が存在することも事実であり,そのような症例に対して結果的には過剰治療となる追加切除を可及的に減じることが本基準の作成目的である。現在のところ,リンパ節転移(pN)を確実に予知できる診断法は存在しないが,転移リスクの高低を追加治療実施の判断材料として利用することが可能である。
pT1癌の所属リンパ節転移リスク因子として,粘膜下層の浸潤距離(SM浸潤度)1),低分化腺癌・印環細胞癌・粘液癌などの組織型2),浸潤先進部の低分化領域・粘液結節の存在,簇出,脈管侵襲などが報告されている2,3)。上記の追加治療の適応基準は,『大腸癌取扱い規約』(第2版,1980年)4)に記載されてきたpT1癌の追加腸切除の3項目(①明らかな脈管内癌浸潤,②低分化腺癌あるいは未分化癌,③断端近傍までのmassiveな癌浸潤)をもとに作成されたものであり,「massiveな癌浸潤」は『大腸癌取扱い規約』の第5版(1994年)において「たとえば約200~300μmを超えた程度の“きわめて浅い浸潤”より深い浸潤」と具体的記述に改訂された5)。その後の本邦における症例集積研究から,追加腸切除を考慮する条件としてSM浸潤度1,000μmが基準とされ,『大腸癌治療ガイドライン医師用2005年版』よりリンパ節転移危険因子として記載された6)。ただし,SM浸潤度1,000μm以上であっても9割程度はリンパ節転移がないわけであり1,6,7),SM浸潤度以外のリンパ節転移危険因子,病変の局在,個々の症例の身体的・社会的背景,患者自身の意思等を十分に考慮し,内科・外科・病理医における多職種で十分な議論の上で,追加治療の適応を決定することが重要である。以上を踏まえて,pT1癌のリンパ節転移リスク因子を1つでも認める場合には追加腸切除を「弱い推奨」とした。
なお,SM浸潤度1,000μm以上のみのリスク因子であれば,リンパ節転移率が比較的低いことが報告されている8,9)。大腸癌研究会プロジェクト研究において,癌の組織型を主組織型ではなく最も低い分化度成分で評価した場合,SM浸潤度以外のリンパ節転移リスク因子がすべて陰性のSM浸潤度1,000μm以上のリンパ節転移率は1.3%(95%信頼区間0-2.4%)であった9)。メタ解析においても,SM浸潤度1,000μm以上あるいはSM2-3はリンパ節転移リスクの独立した予測因子(オッズ比2.14%,95%信頼区間0.96-3.12%)でないことが報告されている10)。ただし,最近の大腸癌研究会プロジェクト研究の結果によると,SM浸潤度2,000μm以上のリンパ節転移率は11.0%であり,ノモグラムによるリンパ節転移リスク予測モデルの結果からSM浸潤度2,000μm以上の場合にはリンパ節転移のリスクがより高いことが示されている11)。今後さらなるエビデンスの集積が必要ではあるが,SM浸潤度2,000μm以上の場合には他のリンパ節転移リスク因子が陰性であっても追加腸切除をより考慮すべきであろう。
2009年版で追加治療を考慮すべき因子として簇出(budding)を追加したが12),さらに他の病理組織学的因子に関するプロジェクト研究も進行中である。また,転移再発した場合はサルベージ手術が適応できない場合が多く,癌死の可能性もあり13),そのリスクを外科医も含めて議論する必要がある。多施設共同研究からは追加治療の適応基準の妥当性の検討結果が報告されている14-17)。なお,海外における追加治療の適応基準として,米国のNational Comprehensive Cancer Network(NCCN)のガイドラインでは,脈管侵襲陽性,組織分化型Grade 3/4の病理学的因子18),欧州のEuropean Society for Medical Oncology(ESMO)のガイドラインでは,脈管侵襲陽性,grade 3 differentiation,簇出(budding)grade>119)が推奨されている。
〔内視鏡切除後のpT1癌の治療方針〕
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ1-① | 96%(22/23) | 4%(1/23) | 0% | 0% | 0% |
| CQ1-② | 4%(1/23) | 96%(22/23) | 0% | 0% | 0% |
文献
- Kitajima K, Fujimori T, Fujii S, et al.: Correlations between lymph node metastasis and depth of submucosal invasion in submucosal invasive colorectal carcinoma: a Japanese collaborative study. J Gastroenterol 2004; 39: 534-543
- Ueno H, Mochizuki H, Hashiguchi Y, et al.: Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology 2004; 127: 385-394
- Tanaka S, Haruma K, Oh-E H, et al.: Conditions of curability after endoscopic resection for colorectal carcinoma with submucosally massive invasion. Oncol Rep 2000; 7: 783-788
- 大腸癌研究会編: 大腸癌取扱い規約,第2版,金原出版,東京,1980
- 大腸癌研究会編: 大腸癌取扱い規約,第5版,金原出版,東京,1994
- 大腸癌研究会編: 大腸癌治療ガイドライン医師用2005年版,金原出版,東京,2005
- 武田 純,長廻 紘,奥山 隆,他: 5.大腸sm癌の取り扱い.b.内視鏡治療後の追加手術が必要な条件.大腸疾患NOW 2004,日本メディカルセンター,東京,2004: 60-69
- Nakadoi K, Tanaka S, Kanao H, et al.: Management of T1 colorectal carcinoma with special reference to criteria for curative endoscopic resection. J Gastroenterol Hepatol 2012; 27: 1057-1062.
- 味岡洋一,大倉康男,池上雅博,他: 早期大腸癌の内視鏡治療の適応拡大(1)T1b癌(1,000μm以深SM癌)リンパ節転移リスク層別化の検討.大腸疾患NOW 2016大腸癌の診断と治療update,日本メディカルセンター,東京,2016: 63-77
- Zwager LW, Bastiaansen BAJ, Montazeri NSM, et al.: Deep Submucosal Invasion Is Not an Independent Risk Factor for Lymph Node Metastasis in T1 Colorectal Cancer: A Meta-Analysis. Gastroenterology 2022; 163: 174-189
- Kajiwara Y, Oka S, Tanaka S, et al.: Nomogram as a novel predictive tool for lymph node metastasis in T1 colorectal cancer treated with endoscopic resection: a nationwide, multicenter study. Gastrointest Endosc 2023; 97: 1119-1128.e5
- 大腸癌研究会編: 大腸癌治療ガイドライン医師用2009年版,金原出版,東京,2009
- 斉藤裕輔,岡 志郎,田中信治,他: 内視鏡摘除後大腸T1(SM)癌の転移・再発に関する多施設共同研究 大腸癌研究会プロジェクト研究の結果から.胃と腸2015: 50: 448-456
- Oka S, Tanaka S, Kanao H, et al.: Mid-term prognosis after endoscopic resection for submucosal colorectal carcinoma: summary of a multicenter questionnaire survey conducted by the colorectal endoscopic resection standardization implementation working group in Japanese Society for Cancer of the Colon and Rectum. Dig Endosc. 2011; 23: 190-194
- Ikematsu H, Yoda Y, Matsuda T, et al.: Long-term outcomes after resection for submucosal invasive colorectal cancers. Gastroenterology 2013; 144: 551-559
- Tamaru Y, Oka S, Tanaka S, et al.: Long-term outcomes after treatment for T1 colorectal carcinoma: a multicenter retrospective cohort study of Hiroshima GI Endoscopy Research Group. J Gastroenterol 2017; 52: 1169-1179
- Oka S, Tanaka S, Kajiwara Y, et al.: Treatment Decision for Locally Resected T1 Colorectal Carcinoma-Verification of the Japanese Guideline Criteria for Additional Surgery Based on Long-Term Clinical Outcomes. Am J Gastroenterol 2024 Epub ahead of print
- NCCN Clinical Practice Guidelines in Oncology: Colon Cancer ver. 1.2024 https://www.nccn.org/professionals/physician_gls/pdf/colon.pdf(2024/5/14 accessed)
- Argilés G, Tabernero J, Labianca R, et al.: Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncology 2020; 31: 1291-1305
CQ 2:早期大腸癌の内視鏡切除後にサーベイランスは推奨されるか?
- 内視鏡切除の結果が一括切除かつ断端陰性の場合には異時性大腸腫瘍の検索を目的として1年後の内視鏡検査によるサーベイランスを行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:96%)
- 内視鏡切除の結果が分割切除,水平断端陽性の場合には局所再発のリスクが上昇するために,6カ月前後での内視鏡検査によるサーベイランスを行うことを強く推奨する。(推奨度1・エビデンスレベルB,合意率:100%)
- pT1癌で追加腸切除を行わなかった場合には,リンパ節転移や遠隔転移による再発の検索を目的として,内視鏡検査に加えてCT検査などの画像診断や腫瘍マーカーなどを用いたサーベイランスを行うことを強く推奨する。(推奨度1・エビデンスレベルB,合意率:100%)
早期大腸癌を内視鏡切除した後の異時性大腸腫瘍発生を評価した報告はほとんどなく,多くの報告はhigh grade dysplasia(HGD)(本邦のpTis癌に相当)を含むadvanced neoplasia(AN)の切除後の検討である。初回検査でHGDを有する場合の経過観察中の異時性ANの発生リスク比は大腸腫瘍がなかった群の6.9倍であり,10 mm以上の腺腫,絨毛腺腫と同等である1)。サーベイランスの是非については,米国のNational polyp studyの長期コホート研究の結果から,HGDを含む大腸腫瘍に対する内視鏡切除後にサーベイランス検査が定期的に実施されれば,15.8年の経過観察において大腸癌死亡率が53%抑制されると報告された2)。一方,AN切除後,サーベイランスを行わない場合,サーベイランス群と比較し,異時性大腸癌のリスクが4.26倍に増加するという報告がある3)。以上より早期大腸癌の内視鏡切除後のサーベイランスは必須と考えられる。米国および欧州のガイドラインではHGD切除後の推奨サーベイランス間隔は3年と設定されている4,5)。ポーランドのNational screening programを基にした研究から,HGDおよび20 mm以上の腫瘍の内視鏡切除後の大腸癌罹患および死亡のリスクがそれ以外のANの2倍以上となることが報告された6)。また,本邦で実施された大腸ESD症例を対象とした長期コホート研究(CREATE-J)の結果より,20 mm以上(約50%がpTisまたはpT1癌)の1,437症例の長期経過観察中(観察期間中央値46.0カ月)に15例(1.0%)の異時性大腸浸潤癌が発生した。異時癌発見までの期間の中央値は26.8カ月であり,ESD後2回目のサーベイランスで発見された症例が多く,15例中13例が外科的治療を実施されていた7)。以上より,3年後では頻度は低いが異時性大腸癌が発見された場合には,内視鏡切除が困難な進行度である可能性が高いために,初回に早期大腸癌の内視鏡切除を行った後のサーベイランス間隔は1年が妥当である。2020年に発刊された本邦の「大腸内視鏡スクリーニングとサーベイランスガイドライン」においてもpTisまたはpT1症例の内視鏡サーベイランスは1年後が推奨されている8,9)。
早期大腸癌の内視鏡切除の結果が分割切除または水平断端陽性であった場合には,内視鏡切除の方法に関わらず局所再発のリスクが上昇する。特に分割切除後の局所再発は9.1~27.5%で2年以内に発生することが多い10-14)。分割切除後の最適なサーベイランス期間を検証する目的に,本邦および台湾で多施設無作為化比較試験が実施された。その結果,3カ月後と6カ月後のサーベイランスで発見された局所再発病変はいずれも内視鏡的にサルベージ可能であり,24カ月後の再発率も同等であったために6カ月後が最適と結論した15)。欧州のガイドラインおよび本邦の「大腸EMR/ESDガイドライン(第2版)」では,分割切除後の内視鏡サーベイランスを6カ月前後に実施することが推奨されている5,16)。また,初回の内視鏡検査における前処置不良や検査精度の低下は,Post colonoscopy colorectal cancerの原因と考えられており1年以内の短い間隔でのサーベイランスが望ましい5,17,18)。
本邦の多施設後ろ向きコホート研究(787名,60.5カ月)の結果,追加治療考慮因子を有するpT1(SM)癌の内視鏡切除単独群は,5年無再発生存率が89%で,累積再発割合が6.6%であった19)。特に直腸癌では結腸癌と比較し再発率が著明に高く(1.4% vs. 16.2%),追加切除が施行できない場合には,手術後に準じた画像診断,腫瘍マーカーを含む慎重な経過観察が必須である20)。また,本研究においては追加治療考慮因子を有さない直腸pT1(SM)癌においても6.3%の再発を認めた20)。以上より,pT1癌で追加腸切除を行わなかった症例においては,CTなどの画像診断や腫瘍マーカーなどを用いたサーベイランスが推奨される。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ2-① | 4%(1/23) | 96%(22/23) | 0% | 0% | 0% |
| CQ2-② | 100%(23/23) | 0% | 0% | 0% | 0% |
| CQ2-③ | 100%(23/23) | 0% | 0% | 0% | 0% |
文献
- Lieberman DA, Weiss DG, Harford WV, et al.: Five-year colon surveillance after screening colonoscopy. Gastroenterology 2007; 133: 1077-1085
- Zauber AG, Winawer SJ, O’Brien MJ, et al.: Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012; 366: 687-696
- Cottet V, Jooste V, Fournel I, et al.: Long-term risk of colorectal cancer after adenoma removal: a population-based cohort study. Gut 2012; 61: 1180-1186
- Gupta S, Lieberman D, Anderson JC, et al.: Recommendations for Follow-Up After Colonoscopy and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2020; 115: 415-434
- Hassan C, Antonelli G, Dumonceau JM, et al.: Post-polypectomy colonoscopy surveillance: European Society of Gastrointestinal Endoscopy(ESGE)Guideline - Update 2020. Endoscopy 2020; 52: 687-700
- Wieszczy P, Kaminski MF, Franczyk R, et al.: Colorectal Cancer Incidence and Mortality After Removal of Adenomas During Screening Colonoscopies. Gastroenterology 2020; 158: 875-883 e5
- Ohata K, Kobayashi N, Sakai E, et al.: Long-term Outcomes After Endoscopic Submucosal Dissection for Large Colorectal Epithelial Neoplasms: A Prospective, Multicenter, Cohort Trial From Japan. Gastroenterology 2022; 163: 1423-1434 e2
- 斎藤 豊,岡 志郎,河村卓二,他: 大腸内視鏡スクリーニングとサーベイランスガイドライン.Gastroenterol Endosc 2020; 62: 1521-1560
- Saito Y, Oka S, Kawamura T, et al.: Colonoscopy screening and surveillance guidelines. Dig Endosc 2021; 33: 486-519
- Hotta K, Fujii T, Saito Y, et al.: Local recurrence after endoscopic resection of colorectal tumors. Int J Colorectal Dis 2009; 24: 225-230
- Moss A, Williams SJ, Hourigan LF, et al.: Long-term adenoma recurrence following wide-field endoscopic mucosal resection(WF-EMR)for advanced colonic mucosal neoplasia is infrequent: results and risk factors in 1000 cases from the Australian Colonic EMR(ACE)study. Gut 2015; 64: 57-65
- Oka S, Tanaka S, Saito Y, et al.: Local recurrence after endoscopic resection for large colorectal neoplasia: a multicenter prospective study in Japan. Am J Gastroenterol 2015; 110: 697-707
- Niimi K, Fujishiro M, Kodashima S, et al.: Long-term outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms. Endoscopy 2010; 42: 723-729
- Shigita K, Oka S, Tanaka S, et al.: Long-term outcomes after endoscopic submucosal dissection for superficial colorectal tumors. Gastrointest Endosc 2017; 85: 546-553
- Nakajima T, Sakamoto T, Hori S, et al.: Optimal surveillance interval after piecemeal endoscopic mucosal resection for large colorectal neoplasia: a multicenter randomized controlled trial. Surg Endosc 2022; 36: 515-525.
- 田中信冶,樫田博史,斎藤 豊,他: 大腸ESD/EMRガイドライン(第2版).Gastroenterol Endosc 2019; 61: 1323-1344
- le Clercq CM, Bouwens MW, Rondagh EJ, et al.: Postcolonoscopy colorectal cancers are preventable: a population-based study. Gut 2014; 63: 957-963
- Kim JS, Kang SH, Moon HS, et al.: Impact of Bowel Preparation Quality on Adenoma Identification During Colonoscopy and Optimal Timing of Surveillance. Dig Dis Sci 2015; 60: 3092-3099
- Yoda Y, Ikematsu H, Matsuda T, et al.: A large-scale multicenter study of long-term outcomes after endoscopic resection for submucosal invasive colorectal cancer. Endoscopy 2013; 45: 718-724
- Ikematsu H, Yoda Y, Matsuda T, et al.: Long-term outcomes after resection for submucosal invasive colorectal cancers. Gastroenterology 2013; 144: 551-559; quiz e14
CQ 3:大腸癌に対するロボット支援手術は推奨されるか?
- ロボット支援手術は,直腸癌手術の選択肢の1つとして行うことを強く推奨する。(推奨度1・エビデンスレベルB,合意率:74%)
- また,結腸癌手術の選択肢の1つとして行うことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:96%)
<ロボット支援手術について>
海外の大規模ランダム化比較試験やコクランレビューにおいて1-12),腹腔鏡下手術では開腹手術と比較して,手術時間が長い一方,出血量の減少,術後疼痛軽減,術後腸管蠕動の早期回復や入院期間が短いなどの短期成績が優れていることが報告されている1,4-8)。また,合併症発生率,および長期成績は同等であることが示されている3,5,9-12)。これらから,腹腔鏡下手術は大腸癌手術の選択肢の1つとして受け入れられている。一方,直線的な鉗子による可動域制限や,術者または助手の手ぶれによる不安定性など,腹腔鏡下手術の技術的課題も指摘されている。ロボット支援手術は,従来型腹腔鏡下手術にはない,多関節で可動域の広い鉗子,手ブレ防止機構,モーションスケールによる精密な操作,安定した高解像度3次元画像下での操作などの特徴を有し,腹腔鏡下手術の技術的課題を克服することが期待されている。ロボット支援手術は,2018年4月から直腸癌に対して,また,2022年4月からは結腸癌に対して保険適用となっている。
<直腸癌に対するロボット支援手術>
多くのコホート研究やメタアナリシスから,直腸癌に対するロボット支援手術は,腹腔鏡下手術に比べて,開腹移行率と泌尿生殖機能障害の減少が示されている13-23)。Circumferential resection margin(CRM)陽性率,合併症発生率,在院期間に関しては,ロボット支援手術が優れるまたは同等と報告されている13,15,17-19,24)。一方,手術時間が長く,コストが高いことが指摘されている25)。また,再発率・生存率は腹腔鏡下手術と同等と報告されている13,19,26,27)。
National Clinical Databaseを用いた国内からの大規模コホート研究では,20,220例の低位前方切除術において,ロボット支援手術は腹腔鏡下手術に比べ,開腹移行率が有意に低いことが示された(0.7% vs. 2.0%;p<0.001)。また出血量,在院死亡率,術後在院期間に関してはロボット支援手術が良好で,手術時間,退院後30日以内の再入院率に関しては腹腔鏡手術が良好であることが示された28)。
ロボット支援手術に関する最初の大規模ランダム化比較試験であるROLARR試験(ロボット支援群237例/腹腔鏡下群234例)では,主要評価項目である開腹移行率は,腹腔鏡下手術12.2%に対してロボット支援手術8.1%であるものの,その優越性は統計学的には証明されなかった25)。
腫瘍学的長期成績を主要評価項目としたランダム化比較試験であるREAL試験(ロボット支援群586例/腹腔鏡下群585例)において,副次評価項目の報告として,ロボット支援手術は,腹腔鏡下手術よりもCRM陽性率が低く(4.0% vs. 7.2%;p=0.023),術後合併症が少ない(16.2% vs. 23.1%;p=0.023)ことが示された29)。
<結腸癌に対するロボット支援手術>
海外の大規模データベースを用いたコホート研究やメタアナリシスからは,結腸癌に対するロボット支援手術は,腹腔鏡下手術に比べて,開腹移行率と合併症発生率が低い,在院期間が短い,郭清リンパ節個数が多いなど,短期成績で優れていることが示されている30-36)。一方,手術時間が長くコストが高いことが指摘されている32)。再発率・生存率に関する報告は限定的であるものの,腹腔鏡下手術と同等と報告されている36-39)。
右側結腸癌に対するロボット支援手術に関するランダム化比較試験では,腹腔鏡下手術と比べて,短期および長期成績に差はないと報告されているが,片群35例の小規模試験の結果である38)。
<導入に関する注意喚起>
大腸癌に対するロボット支援手術の導入において,日本内視鏡外科学会の「ロボット支援内視鏡手術導入に関する指針(全領域共通)」および「消化器外科領域ロボット支援内視鏡手術導入に関する指針」の術者条件・施設条件を遵守する必要がある。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ3-① | 74%(17/23) | 26%(6/23) | 0% | 0% | 0% |
| CQ3-② | 0% | 96%(22/23) | 0% | 0% | 4%(1/23) |
文献
- Lacy AM, García-Valdecasas JC, Delgado S, et al.: Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 2002; 359: 2224-2229
- Weeks, J. C, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. Jama 2002; 287: 321-328.
- Clinical Outcomes of Surgical Therapy Study Group; Nelson H, Sargent DJ, Wieand HS, et al.: A comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med 2004; 350: 2050-2059.
- Veldkamp, R Kuhry E, Hop WC, et al.: Laparoscopic surgery versus open surgery for colon cancer: short-term outcomes of a randomised trial. Lancet Oncol 2005; 6: 477-484.
- Leung KL, Kwok SP, Lam SC, et al.: Laparoscopic resection of rectosigmoid carcinoma: prospective randomised trial. Lancet 2004; 363: 1187-1192.
- Schwenk W, Haase O, Neudecker J, et al.: Short term benefits for laparoscopic colorectal resection. Cochrane Database Syst Rev 2005; 2005: CD003145
- Guillou PJ, Quirke P, Thorpe H, et al.; MRC CLASICC trial group: Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer(MRC CLASICC trial): multicentre, randomised controlled trial. Lancet 2005; 365: 1718-1726
- Yamamoto S, Inomata M, Katayama H, et al.; Japan Clinical Oncology Group Colorectal Cancer Study Group: Short-term surgical outcomes from a randomized controlled trial to evaluate laparoscopic and open D3 dissection for stage Ⅱ/Ⅲ colon cancer: Japan Clinical Oncology Group Study JCOG 0404. Ann Surg 2014; 260: 23-30
- Jayne DG, Guillou PJ, Thorpe H, et al.; UK MRC CLASICC Trial Group: Randomized trial of laparoscopic-assisted resection of colorectal carcinoma: 3-year results of the UK MRC CLASICC Trial Group. J Clin Oncol. 2007 Jul 20; 25(21): 3061-8
- Kuhry E, Schwenk WF, Gaupset R, et al.: Long-term results of laparoscopic colorectal cancer resection. Cochrane Database Syst Rev 2008; 2008: CD003432
- Colon Cancer Laparoscopic or Open Resection Study Group; Buunen M, Veldkamp R, Hop WC, et al.: Survival after laparoscopic surgery versus open surgery for colon cancer: long-term outcome of a randomised clinical trial. Lancet Oncol 2009; 10: 44-52
- Green BL, Marshall HC, Collinson F, et al.: Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer. Br J Surg 2013; 100: 75-82
- Xiong B, Ma L, Huang W, et al.: Robotic versus laparoscopic total mesorectal excision for rectal cancer: a meta-analysis of eight studies. J Gastrointest Surg 2015; 19: 516-526
- Broholm M, Pommergaard HC, Gögenür I: Possible benefits of robot-assisted rectal cancer surgery regarding urological and sexual dysfunction: a systematic review and meta-analysis. Colorectal Dis 2015; 17: 375-381
- Zhang X, Wei Z, Bie M, et al.: Robot-assisted versus laparoscopic-assisted surgery for colorectal cancer: a meta-analysis. Surg Endosc 2016; 30: 5601-5614
- Sun Y, Xu H, Li Z, Han J, et al.: Robotic versus laparoscopic low anterior resection for rectal cancer: a meta-analysis. World J Surg Oncol 2016; 14: 61
- Prete FP, Pezzolla A, Prete F, et al.: Robotic Versus Laparoscopic Minimally Invasive Surgery for Rectal Cancer: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Ann Surg 2018; 267: 1034-1046
- Ng KT, Tsia AKV, Chong VYL: Robotic Versus Conventional Laparoscopic Surgery for Colorectal Cancer: A Systematic Review and Meta-Analysis with Trial Sequential Analysis. World J Surg 2019; 43: 1146-1161
- Han C, Yan P, Jing W, et al.: Clinical, pathological, and oncologic outcomes of robotic-assisted versus laparoscopic proctectomy for rectal cancer: A meta-analysis of randomized controlled studies. Asian J Surg 2020; 43: 880-890
- Wee IJY, Kuo LJ, Ngu JC: Urological and sexual function after robotic and laparoscopic surgery for rectal cancer: A systematic review, meta-analysis and meta-regression. Int J Med Robot 2021; 17: 1-8
- Fleming CA, Cullinane C, Lynch N, et al.: Urogenital function following robotic and laparoscopic rectal cancer surgery: meta-analysis. Br J Surg 2021; 108: 128-137
- Flynn J, Larach JT, Kong JCH, et al.: Patient-Related Functional Outcomes After Robotic-Assisted Rectal Surgery Compared With a Laparoscopic Approach: A Systematic Review and Meta-analysis. Dis Colon Rectum 2022; 65: 1191-1204
- Tang B, Gao G, Ye S, et al.: Male urogenital function after robot-assisted and laparoscopic total mesorectal excision for rectal cancer: a prospective cohort study. BMC Surg 2022; 22: 185
- Wang X, Cao G, Mao W, et al.: Robot-assisted versus laparoscopic surgery for rectal cancer: A systematic review and meta-analysis. J Cancer Res Ther 2020; 16: 979-989
- Jayne D, Pigazzi A, Marshall H, et al. Effect of Robotic-Assisted vs Conventional Laparoscopic Surgery on Risk of Conversion to Open Laparotomy Among Patients Undergoing Resection for Rectal Cancer: The ROLARR Randomized Clinical Trial. JAMA 2017; 318: 1569-1580
- Collinson FJ, Jayne DG, Pigazzi A, et al.: An international, multicentre, prospective, randomised, controlled, unblinded, parallel-group trial of robotic-assisted versus standard laparoscopic surgery for the curative treatment of rectal cancer. Int J Colorectal Dis 2012; 27: 233-241
- Park EJ, Cho MS, Baek SJ, et al. Long-term oncologic outcomes of robotic low anterior resection for rectal cancer: a comparative study with laparoscopic surgery. Ann Surg 2015; 261: 129-137
- Matsuyama T, Endo H, Yamamoto H, et al.: Outcomes of robot-assisted versus conventional laparoscopic low anterior resection in patients with rectal cancer: propensity-matched analysis of the National Clinical Database in Japan. BJS Open 2021; 5: zrab083
- Feng Q, Yuan W, Li T, et al; REAL Study Group: Robotic versus laparoscopic surgery for middle and low rectal cancer(REAL): short-term outcomes of a multicentre randomised controlled trial. Lancet Gastroenterol Hepatol 2022; 7: 991-1004
- Schootman M, Hendren S, Loux T, et al.: Differences in Effectiveness and Use of Robotic Surgery in Patients Undergoing Minimally Invasive Colectomy. J Gastrointest Surg 2017; 21: 1296-1303
- Huang YJ, Kang YN, Huang YM, et al.: Effects of laparoscopic vs robotic-assisted mesorectal excision for rectal cancer: An update systematic review and meta-analysis of randomized controlled trials. Asian J Surg 2019; 42: 657-666
- Ma S, Chen Y, Chen Y, et al.: Short-term outcomes of robotic-assisted right colectomy compared with laparoscopic surgery: A systematic review and meta-analysis. Asian J Surg 2019; 42: 589-598
- Dohrn N, Klein MF, Gögenur I: Robotic versus laparoscopic right colectomy for colon cancer: a nationwide cohort study. Int J Colorectal Dis 2021; 36: 2147-2158
- Clarke EM, Rahme J, Larach T, et al.: Robotic versus laparoscopic right hemicolectomy: a retrospective cohort study of the Binational Colorectal Cancer Database. J Robot Surg 2022; 16: 927-933
- Cuk P, Kjær MD, Mogensen CB, et al.: Short-term outcomes in robot-assisted compared to laparoscopic colon cancer resections: a systematic review and meta-analysis. Surg Endosc 2022; 36: 32-46
- Tschann P, Szeverinski P, Weigl MP, et al.: Short- and Long-Term Outcome of Laparoscopic- versus Robotic-Assisted Right Colectomy: A Systematic Review and Meta-Analysis. J Clin Med 2022; 11: 2387
- Spinoglio G, Bianchi PP, Marano A, et al. Robotic Versus Laparoscopic Right Colectomy with Complete Mesocolic Excision for the Treatment of Colon Cancer: Perioperative Outcomes and 5-Year Survival in a Consecutive Series of 202 Patients. Ann Surg Oncol 2018; 25: 3580-3586
- Park JS, Kang H, Park SY, et al. Long-term oncologic after robotic versus laparoscopic right colectomy: a prospective randomized study. Surg Endosc 2019; 33: 2975-2981
- Mirkin KA, Kulaylat AS, Hollenbeak CS, et al.: Robotic versus laparoscopic colectomy for stage Ⅰ-Ⅲ colon cancer: oncologic and long-term survival outcomes. Surg Endosc 2018; 32: 2894-2901
CQ 4:閉塞性大腸癌にステント治療は推奨されるか?
- 薬物療法の適応とならない患者における,症状緩和を目的としたステント治療は,患者の身体的・心理的負担が少なく,治療の選択肢として行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:96%)
-
薬物療法の適応となる患者におけるステント治療は,行わないことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:87%)
ステント留置を行う前に,薬物療法担当医を含む後方治療の担当医と十分に適応について検討する必要がある。 -
根治的外科的切除を前提とした術前の閉塞解除処置(bridge to surgery:BTS)としてのステント治療は,行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:87%)
ステント留置を行う前に,手術を行う外科医と十分に適応について検討する必要がある。
<① 薬物療法の適応とならない患者における,症状緩和を目的としたステント治療>
原発巣による閉塞症状を伴う切除不能進行再発大腸癌や,切除可能であるが耐術不能な症例に対する姑息的治療としてのステント治療は,人工肛門造設を含む外科手術に比べ,患者の身体的・心理的負担の少ない有益な治療であり,欧州消化器内視鏡学会(ESGE)のガイドラインで推奨されている1)。姑息的ステント治療と外科手術を比較した海外のメタアナリシスでは,ステント治療群で人工肛門造設率や術後早期の合併症発生率,死亡率が低かった2-5)。ただし,腹膜播種を有する患者では技術的成功率が低下し,有害事象が増加することが報告されており6,7),慎重に適応を判断する必要がある。
<② 薬物療法の適応となる患者におけるステント治療>
薬物療法や放射線療法を予定している患者に対するステント留置は,治療による腫瘍の縮小や組織壊死による穿孔・穿通の可能性があるため,ステント留置の適応は慎重に判断すべきである。ステントを留置した場合,穿孔のリスクが高まるとの報告8)があるbevacizumabの使用については,近年の海外の後ろ向き研究において,ステント留置をした患者としていない患者で穿孔のリスクは変わらなかったとの報告があった8)。しかしながら,当該報告は実際の治療において考慮されるもう一方の治療選択肢である人工肛門造設と比較した研究ではないこと,切除不能進行再発大腸癌の生存期間中央値が30カ月超である現状において長期留置した場合の安全性や開存率が不明であること,穿孔が生じた場合の侵襲や薬物療法の遅延が予後に与える悪影響等を鑑みると,現時点では,bevacizumabを使用する予定の患者に対するステント留置は避けるべきと考える(regorafenib,ramucirumab,afliberceptについてもこれに準ずる)。ステント留置を行う前に,薬物療法担当医を含む後方治療の担当医と十分に適応について検討する必要がある。また,放射線療法または薬物療法の既往がある患者でも,ステント留置による穿孔の報告があり,注意が必要である9)。
<③ BTSとしてのステント治療>
根治的外科的切除を前提としたBTSとしてのステント治療では,早急な口側腸管の減圧により緊急手術を回避し,適切な検査・準備を経て待機手術を行うことで,術後合併症を減らすことができる。BTSとしてのステント治療と緊急手術を比較した海外のメタアナリシスでは,ステント治療群で人工肛門造設率が低く,一期的吻合率が高く,術後合併症が少ないことが示されている10-18)。また,経肛門イレウス管による減圧に比べ,洗浄が不要,経口摂取ができ一時退院が可能,口側大腸の観察が可能などの利点がある。
左側の閉塞性大腸癌に対するBTSステント治療と緊急手術を比較した,海外の2つのランダム化比較試験の長期成績が公表され,3年全生存率,再発割合等に有意差はなかったと報告された19,20)。一方で,過去のランダム化比較試験等より,ステント留置の際の穿孔が局所再発や腹膜転移を惹起し,予後を悪化させる可能性が指摘されている。2020年版のESGEガイドライン1)では,左側の閉塞性大腸癌に対するBTSとしてのステント治療は,治療チームの技術,穿孔のリスク,長期予後等を含む様々な因子について担当医と患者の間で適応について十分に相談することを推奨している。なお,直腸癌に対するBTSとしてのステント治療では,のちに行う根治的手術の術式に影響を及ぼす(特に,肛門温存が不可能になる場合がある)ため,手術を行う外科医と十分に適応について検討する必要がある。
いずれにしても,ステント治療は穿孔などの重大な偶発症のリスクを伴うことに留意し,手技に精通した医師が,偶発症に対する十分な対策(緊急手術など)がとれる環境で行うべきである。本邦の多施設共同前向き観察研究では,技術的・臨床的成功率は90%以上である一方,偶発症の発生率は姑息的ステント留置では穿孔2~5%,閉塞10.3%,逸脱1~10%,BTS目的のステント留置では穿孔1.9%,逸脱1.2%と報告されている21)。
臨床的に閉塞症状がない症例や,細径内視鏡が通過可能な程度の狭窄に対する予防的なステント留置は,不必要な偶発症の発生を惹起するだけでなく,ステント逸脱の可能性も高くなるため,施行すべきではない1)。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ4-① | 4%(1/23) | 96%(22/23) | 0% | 0% | 0% |
| CQ4-② | 0% | 4%(1/23) | 87%(20/23) | 4%(1/23) | 4%(1/23) |
| CQ4-③ | 4%(1/23) | 87%(20/23) | 0% | 0% | 9%(2/23) |
文献
- van Hooft JE, Veld JV, Arnold D, et al.: Self-expandable met al. stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy(ESGE)Guideline-Update 2020. Endoscopy 2020; 52: 389-407
- Zhao XD, Cai BB, Cao RS, et al.: Palliative treatment for incurable malignant colorectal obstructions: a meta-analysis. World J Gastroenterol 2013; 19: 5565-5574
- Liang TW, Sun Y, Wei TC, et al.: Palliative treatment of malignant colorectal obstruction caused by advanced malignancy: a self-expanding met al.lic stent or surgery? A system review and meta-analysis. Surg Today 2014; 44: 22-33
- Ribeiro IB, Bernardo WM, Martins BDC, et al.: Colonic stent versus emergency surgery as treatment of malignant colonic obstruction in the palliative setting: a systematic review and meta-analysis. Endosc Int Open 2018; 6: e558-e567
- Takahashi H, Okabayashi K, Tsuruta M, et al.: Self-expanding met al.lic stents versus surgical intervention as palliative therapy for obstructive colorectal cancer: a meta-analysis. World J Surg 2015; 39: 2037-2044
- Park YE, Park Y, Park SJ, et al.: Outcomes of stent insertion and mortality in obstructive stage Ⅳ colorectal cancer patients through 10 year duration. Surg Endosc 2019; 33: 1225-1234
- Park JJ, Rhee K, Yoon JY, et al.: Impact of peritoneal carcinomatosis on clinical outcomes of patients receiving self-expandable metal stents for malignant colorectal obstruction. Endoscopy 2018; 50: 1163-1174
- Imbulgoda A, MacLean A, Heine J, et al.: Colonic perforation with intraluminal stents and bevacizumab in advanced colorectal cancer: retrospective case series and literature review. Can J Surg 2015; 58: 167-171
- 厚生労働省医薬食品局: 消化管用ステントに係る使用上の注意の改訂について.薬食安発1107第1号,薬食機発1107第1号,平成24年11月7日 http://www.pmda.go.jp/files/000148167.pdf
- Yang P, Lin XF, Lin K, et al.: The role of stents as bridge to surgery for acute left-sided obstructive colorectal cancer: meta-analysis of randomized controlled trials. Rev Invest Clin 2018; 70: 269-278
- Foo CC, Poon SHT, Chiu RHY, et al.: Is bridge to surgery stenting a safe alternative to emergency surgery in malignant colonic obstruction: a meta-analysis of randomized control trials. Surg Endosc 2019; 33: 293-302
- Wang X, He J, Chen X, et al.: Stenting as a bridge to resection versus emergency surgery for left-sided colorectal cancer with malignant obstruction: A systematic review and meta-analysis. Int J Surg 2017; 48: 64-68
- Arezzo A, Passera R, Lo Secco G, et al.: Stent as bridge to surgery for left-sided malignant colonic obstruction reduces adverse events and stoma rate compared with emergency surgery: results of a systematic review and meta-analysis of randomized controlled trials. Gastrointest Endosc 2017; 86: 416-426
- Amelung FJ, Burghgraef TA, Tanis PJ, et al.: Critical appraisal of oncological safety of stent as bridge to surgery in left-sided obstructing colon cancer; a systematic review and meta-analysis. Crit Rev Oncol Hematol 2018; 131: 66-75
- Zhang J, Zhu H, Yang W, et al.: Endoscopic stent versus diverting stoma as a bridge to surgery for obstructive colorectal cancer: a systematic review and meta-analysis. Langenbecks Arch Surg 2022; 407: 3275-3285
- Cirocchi R, Arezzo A, Sapienza P, et al.: Current Status of the Self-Expandable Met al. Stent as a Bridge to Surgery Versus Emergency Surgery in Colorectal Cancer: Results from an Updated Systematic Review and Meta-Analysis of the Literature. Medicina(Kaunas)2021; 57: 268
- Hu Y, Fan J, Xv Y, et al.: Comparison of safety between self-expanding met al. stents as a bridge to surgery and emergency surgery based on pathology: a meta-analysis. BMC Surg 2020; 20: 255
- Cao Y, Gu J, Deng S, et al.: Long-term tumour outcomes of self-expanding met al. stents as‘bridge to surgery’for the treatment of colorectal cancer with malignant obstruction: a systematic review and meta-analysis. Int J Colorectal Dis 2019; 34: 1827-1838
- CReST Collaborative Group: Colorectal Endoscopic Stenting Trial(CReST)for obstructing left-sided colorectal cancer: randomized clinical trial. Br J Surg 2022; 109: 1073-1080
- Arezzo A, Forcignan ó E, Bonino MA, et al.: Long-term Oncologic Results After Stenting as a Bridge to Surgery Versus Emergency Surgery for Malignant Left-sided Colonic Obstruction: A Multicenter Randomized Controlled Trial(ESCO Trial). Ann Surg 2020; 272: 703-708
- 大腸ステント安全手技研究会: 大腸ステント安全留置のためのミニガイドライン.大腸ステント安全留置のポイントVer.2.https://colon-stent.com/?318_page.html (2024/5/14 accessed)
CQ 5:切除不能な遠隔転移を有するStage Ⅳ大腸癌に対する原発巣切除は推奨されるか?
- 他の治療では制御困難な原発巣による症状があり,過大侵襲とならない切除であれば,原発巣を切除して全身薬物療法を行うことを強く推奨する。(推奨度1・エビデンスレベルC,合意率:96%)
- 原発巣による症状がない場合は,原発巣を切除せず全身薬物療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:78%)
切除不能な遠隔転移を有する大腸癌の原発巣切除の適応は議論の多い問題である。閉塞や出血など,保存的療法では制御困難な症状を緩和する目的で行われる原発巣切除については異論が少ない。過大侵襲とならない切除であれば,原発巣を切除して早期に全身薬物療法を行うことが強く推奨される。
一方,無症状ないし症状が軽微な症例に対する適応には様々な考え方があり,予測される症状の出現に先んじて原発巣切除を行うことの有用性が問題となる。限られた生命予後のなかで原発巣の切除が症状緩和などのQOLの改善にどれほど寄与するかを予測することは容易ではない1,2)。本病態は高度の進行担癌状態であり,手術合併症や手術死亡のリスクが高いことから,原発巣を切除せず全身薬物療法を行う治療方針を考慮する必要がある3,4)。
このような症例に対し,原発巣切除を先行したほうが薬物療法を先行した症例より生存期間が延長し,症状に対する緊急的な対応が回避できたとの後方視的研究のメタアナリシスの報告が複数ある5,6)。
一方,近年本邦から,切除不能な転移を伴う無症状の大腸癌(下部直腸癌を除く)における原発巣切除に関する無作為化比較試験(JCOG1007)の結果が発表され,主要評価項目である全生存期間(OS)は原発巣切除を行って薬物療法(mFOLFOX6またはCapeOX+bevacizumab)を行った患者群と薬物療法単独の患者群との間に差がない(生存期間中央値 25.9カ月vs. 26.4カ月)ことが報告された7)。副次評価項目である有害事象,薬物療法の転移巣に対する奏効の結果R0切除が行われた症例の頻度にも両群間で差はなかった。しかしながら,本試験では,全周性の病変やスコープ通過不能病変など,現時点では無症候であるが癌の進行や薬物療法の効果によっては原発巣による症状が早期に出現する可能性がある症例における原発巣切除の意義については,サブグループ解析の結果等からも示されていない。また,患者のQOLに関しても検証されていない。原発巣切除を行わずに薬物療法を行った場合の懸念の1つは原発巣による症状の出現であるが,本試験の薬物療法単独群において,原発巣による症状が出現して手術を要した患者の割合は13%であった。既報においては原発巣を切除せず分子標的治療薬併用の薬物療法を行った場合に,閉塞や穿孔などの原発巣合併症の2年累積発生率は16%と報告されており3,8),同様の頻度であった。
現在海外においても複数の無作為化比較試験が進行中であり9-11),それらの結果が待たれる。CAIRO4試験はオランダ・デンマークにて行われた試験であり,主要評価項目であるOSについてはまだ論文化されていないが,60日死亡率は原発巣切除群で11%,薬物療法単独群で3%と有意差を認めた(P=0.03)12)。
以上より,近年の無作為化比較試験の結果からは,切除不能な遠隔転移を有する無症状の原発巣に対する切除の意義は乏しいと考えられる。ただし,原発巣による症状が無いもしくは軽微な症例にも様々な病態が含まれており,原発巣の症状,転移の状態,全身状態のほか,生命予後,手術のリスク,切除による症状緩和の効果予測などの臨床的な状況を総合的に判断する必要がある。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ5-① | 96%(22/23) | 4%(1/23) | 0% | 0% | 0% |
| CQ5-② | 22%(5/23) | 78%(18/23) | 0% | 0% | 0% |
文献
- Cummins ER, Vick KD, Poole GV: Incurable colorectal carcinoma: the role of surgical palliation. Am Surg 2004; 70: 433-437
- Seo GJ, Park JW, Yoo SB, et al.: Intestinal complications after palliative treatment for asymptomatic patients with unresectable stage Ⅳ colorectal cancer. J Surg Oncol 2010; 102: 94-99
- McCahill LE, Yothers G, Sharif S, et al.: Primary mFOLFOX6 plus bevacizumab without resection of the primary tumor for patients presenting with surgically unresectable metastatic colon cancer and an intact asymptomatic colon cancer: definitive analysis of NSABP trial C-10. J Clin Oncol 2012; 30: 3223-3228
- Aslam MI, Kelkar A, Sharpe D, et al.: Ten years experience of managing the primary tumours in patients with stage Ⅳ colorectal cancers. Int J Surg 2010; 8: 305-313
- Stillwell AP, Buettner PG, Ho YH: Meta-analysis of survival of patients with stage Ⅳ colorectal cancer managed with surgical resection versus chemotherapy alone. World J Surg 2010; 34: 797-807
- Sterpetti AV, Costi U, D’Ermo G. National statistics about resection of the primary tumor in asymptomatic patients with Stage Ⅳ colorectal cancer and unresectable metastases. Need for improvement in data collection. A systematic review with meta-analysis. Surg Oncol 2020; 33: 11-18
- Kanemitsu Y, Shitara K, Mizusawa J, et al.: Primary Tumor Resection Plus Chemotherapy Versus Chemotherapy Alone for Colorectal Cancer Patients With Asymptomatic, Synchronous Unresectable Metastases(JCOG1007; iPACS): A Randomized Clinical Trial. J Clin Oncol 2021; 39: 1098-1107
- Tanabe T, Shida D, Boku N, et al.: Primary Tumor-Related Complications Among Patients With Unresectable Stage Ⅳ Colorectal Cancer in the Era of Targeted Therapy: A Competing Risk Regression Analysis. Dis Colon Rectum 2021; 64: 1074-1082
- Biondo S, Frago R, Kreisler E, et al.: Impact of resection versus no resection of the primary tumor on survival in patients with colorectal cancer and synchronous unresectable metastases: protocol for a randomized multicenter study(CR4). Int J Colorectal Dis 2017; 32: 1085-1090
- ‘t Lam-Boer J, Mol L, Verhoef C, et al.: The CAIRO4 study: the role of surgery of the primary tumour with few or absent symptoms in patients with synchronous unresectable metastases of colorectal cancer--a randomized phase Ⅲ study of the Dutch Colorectal Cancer Group(DCCG). BMC Cancer 2014; 14: 741
- Rahbari NN, Lordick F, Fink C, et al.; SYNCHRONOUS trial group: Resection of the primary tumour versus no resection prior to systemic therapy in patients with colon cancer and synchronous unresectable metastases(UICC stage Ⅳ): SYNCHRONOUS--a randomised controlled multicentre trial(ISRCTN30964555). BMC Cancer 2012; 12: 142
- van der Kruijssen DEW, Elias SG, Vink GR, et al.: Sixty-day mortality of patients with metastatic colorectal cancer randomized to systemic treatment vs primary tumor resection followed by systemic treatment: the CAIRO4 phase 3 randomized clinical trial. JAMA Surg 2021; 156: 1093-1101
CQ 6:Stage Ⅲ大腸癌に術後補助化学療法は推奨されるか?
- Stage Ⅲ大腸癌に対してoxaliplatin併用療法を行うことを強く推奨する。(推奨度1・エビデンスレベルA,合意率:91%)
- Stage Ⅲ大腸癌に対してフッ化ピリミジン単独療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルA,合意率:91%)
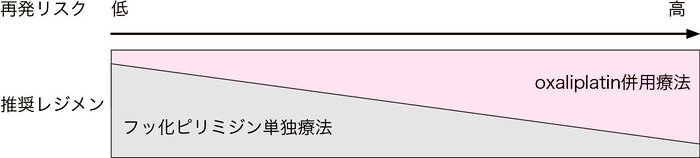
図1 再発リスクに応じた治療戦略
<Stage Ⅲ結腸癌に対するoxaliplatin併用療法のエビデンス>
Dukes’ BおよびDukes’Cを対象とした欧米での3つのランダム化比較試験の統合解析において,5-FU+l-LVは手術単独と比較して無再発生存期間および全生存期間の延長を示した1)。その後,Stage Ⅲ結腸癌を対象とした術後補助化学療法において,6カ月のoxaliplatin(OX)併用療法(CAPOX療法およびFOLFOX療法)は,6カ月の5-FU+l-LVに比べて再発・死亡の相対リスクを約20%減少させることが確認された2-6)。本邦でハイリスクStage Ⅲに対して行われたACTS-CC 02試験7)では,UFT/LVに対するSOX療法が優越性を示せなかったが,予定症例数に未到達であった試験であり,過小評価は行えない。CAPOX療法およびFOLFOX療法は,欧米での結果を外挿し,本邦においても有効な治療選択肢として強く推奨される。
<Stage Ⅲ結腸癌に対するフッ化ピリミジン単独療法のエビデンス>
Stage Ⅲ結腸癌を対象とした術後補助化学療法においてフッ化ピリミジン単独療法も推奨される:(1)5-FU+l-LVに対する(2)Cape(X-ACT試験8))および(3)UFT+LV(NSABP C-06試験9),JCOG0205試験10))の非劣性,UFT+LVに対する(4)S-1の非劣性(ACTS-CC試験11))が示された一方,Capeに対するS-1の非劣性は証明されていない(JCOG0910試験12))。なおMSI-H大腸がんは予後良好であり,5つのランダム化比較試験の統合解析において,Stage Ⅲに対するフッ化ピリミジン単独療法による術後補助化学療法の,手術単独に対するベネフィットは示されていない13)。
<治療期間に関する検討>
OX併用療法は5-FU+l-LVに比べて有意にGrade 3~4の治療関連有害事象の発生が高いことが報告されている2-6)。特に末梢神経障害は,治療期間中だけでなく長期に残存することが問題となるが,現時点で強く推奨される有効な予防・治療法はない。このような有害事象と期待される効果のバランスをとるべく,治療期間に関する検討も行われた。Stage Ⅲ結腸癌を対象としたOX併用療法(FOLFOX,CAPOX)による術後補助化学療法の検討で,国内のランダム化比較試験(JFMC47-1202:ACHIEVE試験14))を含む6つのランダム化比較試験(TOSCA試験,SCOT試験,IDEA France試験,C80702試験,HORG試験,ACHIEVE試験)の統合解析が行われた(IDEA試験15,16))。3カ月投与群(試験群)の6カ月投与群(対照群)に対する非劣性は,主評価項目の無病生存率においても,副評価項目である全生存率においても統計学的には証明されなかった(3年無病生存率(N=12,834)15):74.6% vs. 75.5%,ハザード比1.07,95%信頼区間1.00-1.15,5年生存率(N=12,835)16):82.4% vs. 82.8%,ハザード比1.02,95%信頼区間0.95-1.11)。一方,有害事象発生割合は3カ月投与群で低く,特にGrade 2以上の感覚性末梢神経障害の発現頻度も大幅に低いことが示された(6カ月群FOLFOX/CAPOX:48%/45%,3カ月群FOLFOX/CAPOX:17%/14%)。また,治療効果と治療レジメン(FOLFOX群とCAPOX群)との間に交互作用が認められ,FOLFOX群では6カ月投与群の3カ月群に対する優越性が示される一方で,CAPOX群では3カ月群の6カ月群に対する非劣性が示された。また,事前に計画されたサブグループ解析ではないが,再発低リスク症例(T1-3かつN1)ではCAPOX 3カ月投与群の非劣性が確認された。本邦で実施されたACHIEVE試験でも同様の傾向が確認された14,17)。その後,予定症例数に未到達ではあったが,韓国から報告されたハイリスクStage ⅡとStage Ⅲ結腸癌を対象としたOX併用療法(FOLFOX,CAPOX)による術後補助化学療法の検討でも,治療効果と治療レジメン(FOLFOX群とCAPOX群)との間に交互作用が認められた18)。
<総合的判断による治療レジメン決定>
Stage Ⅲ結腸癌に対してOX併用療法による術後補助化学療法を行うことが推奨されるが,特に再発低リスク例においてはCAPOX 3カ月間投与やフッ化ピリミジン単独療法(6カ月)も治療選択肢となり得る。考慮すべき再発リスク因子としては,病理学的ステージ・T因子・N因子が挙げられる。Stage Ⅲ結腸癌3,051例の臨床試験登録患者における個人レベルでの統合解析にて,IDEA試験で使用されたリスク分類(低リスク:T1-3N1,高リスク:T3 or N2)を用いて,またさらに高リスク群をT1-3N2とT4N1-2に分類し,OX併用療法(6カ月)の意義が検討された19)。低リスク群,高リスク群のいずれにおいても,OX併用療法(FOLFOX,FLOX)による術後補助化学療法は,フッ化ピリミジン単独療法に対して有意に良好な全生存率を示したが(低リスク群:ハザード比0.79,95%信頼区間0.66-0.95,高リスク群:ハザード比 0.84,95%信頼区間 0.71-0.99),CAPOX療法では,低リスク群のみで統計学的有意性が示された。一方,高リスク群の中でもT4N1-2においては,OX併用療法の統計学的有意性は示されなかった(ハザード比 0.95,95%信頼区間0.71-1.27)。
コストについては,MOSAIC試験(Stage Ⅲ結腸癌を対象にOX併用療法とフッ化ピリミジン単独療法を比較)2)の患者レベルデータをもとに本邦で実施された費用対効果解析の報告20)を含め,OX併用療法は費用対効果に優れた治療であると報告されている。
以上より,実地臨床では,上述した海外データや,CQ 9で記載のあるRAS,BRAF,ミスマッチ修復機能欠損検査などのバイオマーカーを参考に,再発リスクと期待される効果(図1),有害事象,治療コスト,通院回数などの充分な情報提供のもとに,患者の全身状態や治療意欲等も含め,総合的な判断のもとに治療レジメンと治療期間を選択することが望ましい。
<直腸癌におけるエビデンス>
Stage Ⅲ直腸癌におけるUFT単独(1年間)の手術単独に対する無再発生存における優越性(ハザード比0.52,95%信頼区間0.33-0.81,P=0.0014)(NSAS-CC試験)21-23),Stage Ⅱ/Ⅲ直腸癌におけるS-1(1年間)のUFT単独(1年間)に対する優越性(ハザード比0.77,95%信頼区間0.63-0.96,P=0.0165)が示されている(ACTS-RC試験)24)。一方,upfront surgery後の術後補助化学療法としてのOXの有用性については検証されておらず,結腸癌での有効性を外挿して推奨するものとする。
海外では直腸癌に対しては術前治療が実施されることが多く,本邦でも増加傾向にある(CQ 11)。術前放射線療法後の術後補助療法についてはEORTC22921試験において検証され,化学放射線療法後および短期化学放射線療法後いずれにおいても,フッ化ピリミジンベースの術後補助化学療法は全生存率や無再発生存率に影響を与えないことが示された25)。術前化学放射線療法後のypStage Ⅱ/Ⅲ直腸癌治癒切除症例で術後補助化学療法が施行可能な患者に対する,術後FOLFOXと5-FU+l-LVのランダム化比較試験において,OX併用による有意に優れた再発抑制効果が示されている(ハザード比0.657,95%信頼区間0.434-0.944)26)。一方,pCR例やypStage Ⅰに対する効果については明らかでない。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ6-① | 91%(21/23) | 9%(2/23) | 0% | 0% | 0% |
| CQ6-② | 9%(2/23) | 91%(21/23) | 0% | 0% | 0% |
文献
- Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. International Multicentre Pooled Analysis of Colon Cancer Trials(IMPACT)investigators. Lancet 1995; 345: 939-944
- André T, Boni C, Mounedji-Boudiaf L, et al.; Multicenter International Study of Oxaliplatin/5-Fluorouracil/Leucovorin in the Adjuvant Treatment of Colon Cancer(MOSAIC)Investigators: Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med 2004; 350: 2343-2351
- Haller DG, Tabernero J, Maroun J, et al.: Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage Ⅲ colon cancer. J Clin Oncol 2011; 29: 1465-1471
- Kuebler JP, Wieand HS, O’Connell MJ, et al.: Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage Ⅱ and Ⅲ colon cancer: results from NSABP C-07. J Clin Oncol 2007; 25: 2198-2204
- André T, Boni C, Navarro M, et al.: Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage Ⅱ or Ⅲ colon cancer in the MOSAIC trial. J Clin Oncol 2009; 27: 3109-3116
- Yothers G, O’Connell MJ, Allegra CJ, et al.: Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol 2011; 29: 3768-3774
- Sunami E, Kusumoto T, Ota M, et al.: S-1 and Oxaliplatin Versus Tegafur-uracil and Leucovorin as Postoperative Adjuvant Chemotherapy in Patients With High-risk Stage Ⅲ Colon Cancer(ACTS-CC 02): A Randomized, Open-label, Multicenter, Phase Ⅲ Superiority Trial. Clin Colorectal Cancer 2020; 19: 22-31
- Twelves C, Wong A, Nowacki MP, et al.: Capecitabine as adjuvant treatment for stage Ⅲ colon cancer. N Engl J Med 2005; 352: 2696-2704
- Lembersky BC, Wieand HS, Petrelli NJ, et al.: Oral uracil and tegafur plus leucovorin compared with intravenous fluorouracil and leucovorin in stage Ⅱ and Ⅲ carcinoma of the colon: results from National Surgical Adjuvant Breast and Bowel Project Protocol C-06. J Clin Oncol 2006; 24: 2059-2064
- Shimada Y, Hamaguchi T, Mizusawa J, et al.: Randomised phase Ⅲ trial of adjuvant chemotherapy with oral uracil and tegafur plus leucovorin versus intravenous fluorouracil and levofolinate in patients with stage Ⅲ colorectal cancer who have undergone Japanese D2/D3 lymph node dissection: final results of JCOG0205. Eur J Cancer 2014; 50: 2231-2240
- Yoshida M, Ishiguro M, Ikejiri K, et al.: S-1 as adjuvant chemotherapy for stage Ⅲ colon cancer: a randomized phase Ⅲ study(ACTS-CC trial). Ann Oncol 2014; 25: 1743-1749
- Hamaguchi T, Shimada Y, Mizusawa J, et al.: Capecitabine versus S-1 as adjuvant chemotherapy for patients with stage Ⅲ colorectal cancer(JCOG0910): an open-label, non-inferiority, randomised, phase 3, multicentre trial. Lancet Gastroenterol Hepatol 2018; 3: 47-56
- Sargent DJ, Marsoni S, Monges G, et al.: Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010; 28: 3219-3226
- Yoshino T, Yamanaka T, Oki E, et al.: Efficacy and Long-term Peripheral Sensory Neuropathy of 3 vs 6 Months of Oxaliplatin-Based Adjuvant Chemotherapy for Colon Cancer The ACHIEVE Phase 3 Randomized Clinical Trial. JAMA Oncol 2019; 5: 1574-1581
- Grothey A, Sobrero AF, Shields AF, et al.: Duration of adjuvant chemotherapy for stage Ⅲ colon cancer. N Engl J Med 2018; 378: 1177-1188
- André T, Meyerhardt J, Iveson T, et al.: Effect of duration of adjuvant chemotherapy for patients with stage Ⅲ colon cancer(IDEA collaboration): final results from a prospective, pooled analysis of six randomized, phase 3 trials. Lancet Oncol 2020; 21: 1620-1629
- Kotaka M, Yamanaka T, Yoshino T, et al.: Safety data from the phase Ⅲ Japanese ACHIEVE trial: part of an international, prospective, planned pooled analysis of six phase Ⅲ trials comparing 3 versus 6 months of oxaliplatin- based adjuvant chemotherapy for stage Ⅲ colon cancer. ESMO Open 2018; 3: e000354
- Kim ST, Kim SY, Lee J, et al.: Oxaliplatin(3 months v 6 months)With 6 Months of Fluoropyrimidine as Adjuvant Therapy in Patients With Stage Ⅱ/Ⅲ Colon Cancer: KCSG CO09-07. J Clin Oncol 2022; 40: 3868-3877
- Margalit O, Boursi B, Rakez M, et al.: Benet of Oxaliplatin in Stage Ⅲ Colon Cancer According to IDEA Risk Groups: Findings from the ACCENT Database of 4934 Patients. Clinical Colorectal Cancer 2021; 20: 130-136
- Shiroiwa T, Takeuchi T, Fukuda T, et al.: Cost-effectiveness of adjuvant FOLFOX therapy for stage Ⅲ colon cancer in Japan based on the MOSAIC trial. Value Health 2012; 15: 255-260
- Sakamoto J, Hamada C, Yoshida S, et al.: An individual patient data meta-analysis of adjuvant therapy with uraciltegafur(UFT)in patients with curatively resected rectal cancer. Br J Cancer 2007; 96: 1170-1177
- Kato T, Ohashi Y, Nakazato H, et al.: Efficacy of oral UFT as adjuvant chemotherapy to curative resection of colorectal cancer: multicenter prospective randomized trial. Langenbecks Arch Surg 2002; 386: 575-581
- Akasu T, Moriya Y, Ohashi Y, et al.; National Surgical Adjuvant Study of Colorectal Cancer: Adjuvant chemotherapy with uracil-tegafur for pathological stage Ⅲ rectal cancer after mesorectal excision with selective lateral pelvic lymphadenectomy: a multicenter randomized controlled trial. Jpn J Clin Oncol 2006; 36: 237-244
- Oki E, Murata A, Yoshida K, et al.: A randomized phase Ⅲ trial comparing S-1 versus UFT as adjuvant chemotherapy for stage Ⅱ/Ⅲ rectal cancer(JFMC35-C1: ACTS-RC). Ann Oncol 2016; 27: 1266-1272
- Bosset JF, Calais G, Mineur L, et al; EORTC Radiation Oncology Group: Fluorouracil-based adjuvant chemotherapy after preoperative chemoradiotherapy in rectal cancer: long-term results of the EORTC 22921 randomised study. Lancet Oncol 2014; 15: 184-190
- Hong YS, Nam BH, Kim KP, et al.: Oxaliplatin, fluorouracil, and leucovorin versus fluorouracil and leucovorin as adjuvant chemotherapy for locally advanced rectal cancer after preoperative chemoradiotherapy(ADORE): an open-label, multicentre, phase 2, randomised controlled trial. Lancet Oncol 2014; 15: 1245-1253
CQ 7:Stage Ⅱ大腸癌に術後補助化学療法は推奨されるか?
- 行わないことを弱く推奨する。(推奨度2・エビデンスレベルA,合意率:90%)
- 再発高リスクの場合には補助化学療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:100%)
3,238名の結腸・直腸癌(Stage Ⅱ:91%,結腸癌:71%)を対象とした5-FU+LV±levamisoleと手術単独を比較したQUASAR試験では,化学療法群の再発率および生存率は有意に良好で,5年生存率で3~4%の上乗せ効果がみられたが,Stage Ⅱの2,146名のみでは有意差は認められなかった1)。国内のランダム化比較試験においても,Stage Ⅱ結腸癌に対する1年間のUFT投与は,手術単独に対し5年生存率はそれぞれ94.5%,94.3%(ハザード比0.93,95%信頼区間0.66-1.31)と有意な再発抑制効果は証明されなかった(SACURA試験2))。メタアナリシス3,4)やSEER database review5)でも,化学療法群の生存期間が良好な傾向があるものの有意差は示されていない。また,フッ化ピリミジンベース治療と比較してoxaliplatinベース治療の優位性を検証したMOSAIC試験6)及びNSABP C-07試験7)では,それぞれ40%,29%のStage Ⅱの患者が含まれたが,Stage Ⅱ結腸癌のサブグループ解析において再発,生存ともに上乗せ効果は証明されていない。以上より,Stage Ⅱ大腸癌では,再発リスクを考慮せず一律に術後補助化学療法を行うことは推奨されない。海外のガイドラインでは,Stage Ⅱ結腸癌のなかに再発高リスク群を設定し,期待される効果と予想される副作用を十分説明したうえで術後補助化学療法を行うか決定することが推奨されている(表1)。現在Stage Ⅱ結腸癌の再発高リスク因子は,臨床病理学的因子で定義されているが,高レベルのエビデンスに基づくものではない。エビデンスは不足するものの,これら予後不良なサブグループに絞って補助化学療法を行うという戦略は妥当と考えられる。R0手術が行われた再発危険因子を持つStage Ⅱ大腸癌における手術単独群に対するUFT/LV療法の臨床的有用性を比較検討する前向き観察研究(JFMC46-1201)が国内で施行され,T4病変,穿孔・穿通,低分化腺癌・粘液癌,郭清リンパ節個数12個未満のうち,少なくとも1つの条件を満たす高リスクのStage Ⅱ結腸癌患者に対して,UFT/LVによる術後化学療法は,手術単独よりも生存率が高いことが示された8)。現時点では再発高リスク群において患者とエビデンスを共有して,患者の価値観を踏まえて一緒に治療方針を決定することが推奨される(shared decision makingアプローチ)。なお,臨床病理学的因子を元に個々の再発リスクを予測するいくつかのWebツールが利用可能であるが,患者と治療の検討するため,大腸癌研究会のホームページにも日本人データを用いた結腸癌術後予後予測ノモグラムが用意されている(http://nomogram.jsccr.jp/nomograms)9)。再発高リスクとは逆にミスマッチ修復機能欠損を有するStage Ⅱ結腸癌は,頻度は低いものの(5~8%程度)極めて予後は良好である。国内外の臨床試験結果からフッ化ピリミジン単独療法は再発リスクが高まる可能性があり行わないことが推奨されるため,治療前のMSI/MMR-IHC検査(保険収載)が必要である10)。
再発高リスクStage Ⅱ大腸癌に対する治療レジメンと治療期間については,議論が続いている。原則的にはStage Ⅲ結腸癌に準じた治療法と投与期間が妥当と考えられる。フッ化ピリミジンベース治療であれば6カ月である。Oxaliplatinベース治療の投与期間についてはCQ 6にあるように,IDEA collaborationの結果からStage Ⅲ結腸癌T1~3かつN1症例においてはCAPOX 3カ月も推奨されている11)。一方,再発高リスクStage Ⅱ大腸癌の至適投与期間の検討をしたIDEA collaborationの統合解析の結果は,6カ月投与に対する3カ月投与の非劣性は示されなかったが,Stage Ⅲ同様,CAPOXであれば3カ月と6カ月投与の有効性は臨床的に同程度であった12)。CAPOXの3カ月投与は末梢神経障害をはじめ毒性が抑えられることから,再発高リスクStage Ⅱ大腸癌においても治療選択肢の一つである。統合解析に含まれる本邦の試験13)においても,oxaliplatinベースの補助化学療法の治療期間の短縮はGrade 2以上の末梢神経障害を有意に減少させ,有効性も,3年DFSは3カ月投与と6カ月投与は同等で3カ月投与が選択肢として肯定される結果であった。T4における3カ月投与は6カ月投与に比較しやや治療成績が不良な傾向が見られるが,治療選択にあたっては長期投与の毒性とのバランスを考慮することが望まれる。

投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ7-① | 0% | 0% | 90%(19/21) | 10%(2/21) | 0% |
| CQ7-② | 0% | 100%(21/21) | 0% | 0% | 0% |
文献
- Quasar Collaborative Group; Gray R, Barnwell J, et al.: Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet 2007; 370: 2020-2029
- Kajiwara Y, Ishiguro M, Teramukai S, et al.: A randomized phase Ⅲ trial of 1-year adjuvant chemotherapy with oral tegafur-uracil(UFT)vs. surgery alone in stage Ⅱ colon cancer: SACURA trial. J Clin Oncol 2016; 34(15 suppl): 3617
- Gill S, Loprinzi CL, Sargent DJ, et al.: Pooled analysis of fluorouracil-based adjuvant therapy for stage Ⅱ and Ⅲ colon cancer: who benefits and by how much? J Clin Oncol 2004; 22: 1797-1806
- Figueredo A, Charette ML, Maroun J, et al.: Adjuvant therapy for stage Ⅱ colon cancer: a systematic review from the Cancer Care Ontario Program in evidence-based care’s gastrointestinal cancer disease site group. J Clin Oncol 2004; 22: 3395-3407
- Schrag D, Rifas-Shiman S, Saltz L, et al.: Adjuvant chemotherapy use for Medicare beneficiaries with stage Ⅱ colon cancer. J Clin Oncol 2002; 20: 3999-4005
- André T, Boni C, Navarro M, et al.: Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage Ⅱ or Ⅲ colon cancer in the MOSAIC trial. J Clin Oncol 2009; 27: 3109
- Kuebler JP, Wieand HS, O’Connell MJ, et al.: Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage Ⅱ and Ⅲ colon cancer: results from NSABP C-07. J Clin Oncol 2007; 25: 2198-2204
- Sadahiro S, Sakamoto K, Tsuchiya T, et al.: Prospective observational study of the efficacy of oral uracil and tegafur plus leucovorin for stage Ⅱ colon cancer with risk factors for recurrence using propensity score matching(JFMC46-1201). BMC Cancer 2022; 22: 170
- Kanemitsu Y, Shida D, Tsukamoto S, et al.; Study Group for Nomogram of the Japanese Society for Cancer of the Colon and Rectum: Nomograms predicting survival and recurrence in colonic cancer in the era of complete mesocolic excision. BJS Open 2019; 3: 539-548
- Sargent DJ, Marsoni S, Monges G, et al.: Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010; 28: 3219-3226
- Grothey A, Sobrero AF, Shields AF, et al.: Duration of adjuvant chemotherapy for stage Ⅲ colon cancer. N Engl J Med 2018; 378: 1177-1188
- Iveson TJ, Sobrero AF, Yoshino T, et al.: Duration of Adjuvant Doublet Chemotherapy(3 or 6 months)in Patients With High-Risk Stage Ⅱ Colorectal Cancer. J Clin Oncol 2021; 39: 631-641
- Yamazaki K, Yamanaka T, Shiozawa M, et al.: Oxaliplatin-based adjuvant chemotherapy duration(3 versus 6 months)for high-risk stage Ⅱ colon cancer: the randomized phase Ⅲ ACHIEVE-2 trial. Ann Oncol 2021; 32: 77-84
- Baxter NN, Kennedy EB, Bergsland E, et al.: Adjuvant Therapy for Stage Ⅱ Colon Cancer: ASCO Guideline Update. J Clin Oncol 2022; 40: 892-910.
- Argilés G, Tabernero J, Labianca R, et al.: Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020; 31: 1291-1305
- National Comprehensive Cancer Network: NCCN clinical practice guidelines in oncology. https://www.nccn.org/professionals/physician_gls(Accessed on May 06, 2021)
CQ 8:80歳以上の高齢者に術後補助化学療法は推奨されるか?
- PSが良好で化学療法に関してリスクとなる基礎疾患,併存症がなく主要臓器機能が保たれていれば,80歳以上の高齢者でも術後補助化学療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:65%)
- Oxaliplatin併用療法の実施に関しては,フッ化ピリミジンに対するoxaliplatinの上乗せ効果は明確ではないため,行わないことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:83%)
これまでに80歳以上の高齢者のみを対象とした術後補助化学療法の前向き試験は存在しないが,欧米で実施された5-FUベースの術後補助化学療法に関するランダム化比較試験のpooled analysis等では,80歳以上の高齢者も対象として含まれていた1-6)。また米国のNational Cancer Database(2006~2011年)を用いた80歳台8,141名を対象とした後方視的研究では,42.8%が補助化学療法を受けており,補助化学療法を受けた症例の予後が良好であった7)。
oxaliplatin(OX)併用療法が高齢者において選択される割合は,約20~40%程度と若年者と比較し有意に低率ではあるものの,80歳以上の高齢者においても,一定頻度でOX併用療法が選択されていることが米国より報告されている6-8)。
有効性に関しては,欧州5カ国における80歳以上の高齢者を対象とした検討では,術後補助化学療法による生存期間延長効果は認められなかった9)。一方で,米国からの報告では,80歳以上の高齢者におけるフッ化ピリミジンによる生存期間延長効果は,若年者と同程度であった10)。
有害事象については,80歳以上の高齢者のみの検討はこれまでになされていない。70歳以上の高齢者に対するフッ化ピリミジンを用いた術後補助化学療法に関する検討では,白血球減少が強くでる傾向にはあったが,その他の項目に関しては70歳未満の症例と差はなかったことが報告されている5)。
よって,80歳以上の高齢者に対する術後補助化学療法に関しては,再発リスクも考慮したうえで,Performance Statusや主要臓器機能,化学療法に関してリスクとなるような基礎疾患や併存症がなければ,術後補助化学療法を行うことを推奨する。
フッ化ピリミジン単独療法にOXを上乗せする有用性については,80歳以上の高齢者のみを対象とした検討は,これまでに実施されていない。70歳以上の高齢者に対するOX併用の有用性に関する検討は複数存在するが,無再発生存期間や全生存期間の改善に至る有効性については一貫した結果は得られていない1,11-13)。さらに,75歳以上を対象とした米国からの報告でも,OX併用療法による生存期間延長効果について有意差はなかった8)(SEER-Medicine;ハザード比0.84,95%信頼区間0.69-1.04,NYSCR-Medicine;ハザード比0.82,95%信頼区間0.51-1.33)。
以上より,80歳以上の高齢者に対するOX併用療法に関しては,個々の症例ごとに,リスクベネフィットを検討したうえで,その適用について慎重に判断する必要がある。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ8-① | 9%(2/23) | 65%(15/23) | 9%(2/23) | 0% | 17%(4/23) |
| CQ8-② | 0% | 0% | 83%(19/23) | 4%(1/23) | 13%(3/23) |
文献
- Haller DG, O’Connell MJ, Cartwright TH, et al.: Impact of age and medical comorbidity on adjuvant treatment outcomes for stage Ⅲ colon cancer: a pooled analysis of individual patient data from four randomized, controlled trials. Ann Oncol 2015; 26: 715-724
- Folprecht G, Cunningham D, Ross P, et al.: Efficacy of 5-fluorouracil-based chemotherapy in elderly patients with metastatic colorectal cancer: a pooled analysis of clinical trials. Ann Oncol 2004; 15: 1330-1338
- Goldberg RM, Tabah-Fisch I, Bleiberg H, et al.: Pooled analysis of safety and efficacy of oxaliplatin plus fluorouracil/leucovorin administered bimonthly in elderly patients with colorectal cancer. J Clin Oncol 2006; 24: 4085-4091
- Alberts SR, Sargent DJ, Nair S, et al.: Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival among patients with resected stage Ⅲ colon cancer: a randomized trial. JAMA 2012; 307: 1383-1393
- Sargent DJ, Goldberg RM, Jacobson SD, et al.: A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. N Engl J Med 2001 11; 345: 1091-1097
- Abrams TA, Brightly R, Mao J, et al.: Patterns of adjuvant chemotherapy use in a population-based cohort of patients with resected stage Ⅱ or Ⅲ colon cancer. J Clin Oncol 2011; 29: 3255-3262
- Bergquist JR, Thiels CA, Spindler BA, et al.: Benefit of Postresection Adjuvant Chemotherapy for Stage Ⅲ Colon Cancer in Octogenarians: Analysis of the National Cancer Database. Dis Colon Rectum 2016; 59: 1142-1149
- Sanoff HK, Carpenter WR, Stürmer T, et al.: Effect of adjuvant chemotherapy on survival of patients with stage Ⅲ colon cancer diagnosed after age 75 years. J Clin Oncol 2012; 30: 2624-2634
- Vermeer NCA, Claassen YHM, Derks MGM, et al.: Treatment and Survival of Patients with Colon Cancer Aged 80 Years and Older: A EURECCA International Comparison. Oncologist 2018; 23: 982-990
- Jessup JM, Stewart A, Greene FL, et al.: Adjuvant chemotherapy for stage Ⅲ colon cancer: implications of race/ethnicity, age, and differentiation. JAMA 2005; 294: 2703-2711
- Yothers G, O’Connell MJ, Allegra CJ, et al.: Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol 2011; 29: 3768-3774
- Tournigand C, André T, Bonnetain F, et al.: Adjuvant therapy with fluorouracil and oxaliplatin in stage Ⅱ and elderly patients(between ages 70 and 75 years)with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol 2012; 30: 3353-3360
- McCleary NJ, Meyerhardt JA, Green E, et al.: Impact of age on the efficacy of newer adjuvant therapies in patients with stage Ⅱ/Ⅲ colon cancer: findings from the ACCENT database. J Clin Oncol 2013; 31: 2600-2606
CQ 9:周術期薬物療法の前にバイオマーカー検査は推奨されるか?
- RAS,BRAF,ミスマッチ修復機能欠損(MSIもしくはMMR-IHC)検査を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:78%)
- Stage Ⅱ/Ⅲ大腸癌の術後についてはミスマッチ修復機能欠損検査を行うことを強く推奨する。(推奨度1・エビデンスレベルA,合意率:96%)
周術期薬物療法としては「Stage Ⅱ/Ⅲ大腸癌に対する術後補助化学療法」「直腸癌に対する術前化学放射線療法」「肝(肺)転移に対する周術期化学療法」が考えられる。これまでに薬物療法による治療効果および予後予測としてバイオマーカーの有用性が示唆されている。現在,大腸癌診療において測定可能なバイオマーカーとしてはRAS遺伝子変異(大腸癌全体の~50%),BRAF遺伝子変異(~7%),ミスマッチ修復機能欠損(MSI-H/dMMR:~15%)およびHER2遺伝子増幅(~5%)があるが,現在までに周術期薬物療法においてこれらバイオマーカーに基づく前向き比較試験は行われていないため,後ろ向きにバイオマーカー解析を行った研究のメタ解析ないしプール解析による検討を行った。なお周術期薬物療法とHER2遺伝子増幅の関係については十分な情報が得られなかった。
Stage Ⅱ/Ⅲ大腸癌に対する5-FU-basedの術後補助化学療法については,複数の第Ⅲ相試験のメタ解析において,RAS遺伝子変異は野生型に比してDFS(ハザード比1.36,95%信頼区間1.15-1.61,p<0.001),OS(ハザード比1.27,95%信頼区間1.03-1.55,p=0.03)ともに有意に不良であることが示されている1)。BRAF遺伝子変異も複数の第Ⅲ相試験のメタ解析の結果,不良なDFS(ハザード比1.33,95%信頼区間1.00-1.78,p=0.05)およびOS(ハザード比1.49,95%信頼区間1.31-1.70,p<0.001)と有意に相関することが示された1)。なお,BRAF遺伝子変異に対しては,5-FU/LVよりFOLFOXを使用した群でOSが良好な傾向がみられた2)。手術単独で予後良好なMSI-H/dMMRは,5-FUによる術後補助化学療法のメリットに乏しく3,4),特にStage Ⅱに対しては手術単独に劣る傾向があり,5-FU単独の術後補助化学療法を行うべきではない5-7)。同様にStage Ⅲ MSI-H/dMMR大腸癌に対して5-FU単独での術後補助化学療法は手術単独と比較しての予後を改善しないことがACCENTデータベースでのプール解析において示された8)。一方でoxaliplatinを併用した場合は,5-FU単独と比してDFS(ハザード比0.47,95%信頼区間0.27-0.82)およびOS(ハザード比0.52,95%信頼区間0.28-0.93)を改善する傾向を示した8)。
直腸癌術前化学放射線療法については,これまでにRAS遺伝子変異,MSI-H/dMMRについてメタ解析が行われている。RAS遺伝子変異は,pCRやdown stagingといった短期的な治療効果においては野生型と差を認めなかったが9,10),DFS(ハザード比1.55,95%信頼区間1.19-2.02)とOS(ハザード比1.33,95%信頼区間1.13-1.56)は不良であることが近年の解析で示されている10)。一方,MSI-H/dMMRはMSS/pMMRと比較して治療効果および生存に有意な違いは認められなかった11,12)。MSI-H/dMMR局所進行直腸癌に対しては免疫チェックポイント阻害剤の高い有効性が示され13),臨床試験が進行中である。
肝転移切除の予後とバイオマーカーとの関係において,複数のメタ解析が行われている。解析に含まれた研究のほとんどで周術期化学療法が行われていたが,いずれのメタ解析においてもRAS遺伝子変異14-16)は有意に不良なRFS(ハザード比1.89,95%信頼区間1.54-2.32),OS(ハザード比2.24,95%信頼区間1.76-2.85)と相関した14)。また,BRAF遺伝子変異15-17)も同様に不良なRFS(ハザード比1.89,95%信頼区間1.54-2.32),OS(ハザード比2.24,95%信頼区間1.76-2.85)を示した17)。肺転移切除後についてはKRAS遺伝子変異でのメタ解析があり,やはりRFS(OR 1.49,95%信頼区間1.01-2.21),OS(OR 1.981,95%信頼区間1.61-2.43)が有意に不良であった18)。ただし,一般的に肝(肺)切除可能症例に対しては肝(肺)切除を行うほうが予後を延長できる可能性があり,こうしたバイオマーカーの存在のために肝(肺)切除を回避すべきかについては不明である。したがって,RASもしくはBRAF遺伝子変異を有する症例では,肝(肺)切除後の注意深いフォローアップが必要である。
周術期薬物療法の前のバイオマーカー検査を実施するデメリットはない一方で,RAS遺伝子変異,BRAF遺伝子変異は予後予測に役立つ可能性があり,これらに対する検査を行うことが弱く推奨される。また,ミスマッチ修復機能欠損(MSI/MMR-IHC)検査はStage Ⅱ/Ⅲの術後における治療選択に有用であり,行うことを強く推奨する。なお将来的にはこれらにctDNAなど新たなバイオマーカーが加わる可能性がある。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ9-① | 22%(5/23) | 78%(18/23) | 0% | 0% | 0% |
| CQ9-② | 96%(22/23) | 4%(1/23) | 0% | 0% | 0% |
文献
- Formica V, Sera F, Cremolini C, et al.: KRAS and BRAF Mutations in Stage Ⅱ and Ⅲ Colon Cancer: A Systematic Review and Meta-Analysis. J Natl Cancer Inst 2022; 114: 517-527
- André T, de Gramont A, Vernerey D, et al.: Adjuvant Fluorouracil, Leucovorin, and Oxaliplatin in Stage Ⅱ to Ⅲ Colon Cancer: Updated 10-Year Survival and Outcomes According to BRAF Mutation and Mismatch Repair Status of the MOSAIC Study. J Clin Oncol 2015; 33: 4176-4187
- Des Guetz G, Schischmanoff O, Nicolas P, et al.: Does microsatellite instability predict the efficacy of adjuvant chemotherapy in colorectal cancer? A systematic review with meta-analysis. Eur J Cancer 2009; 45: 1890-1896
- Guastadisegni C, Colafranceschi M, Ottini L, et al.: Microsatellite instability as a marker of prognosis and response to therapy: a meta-analysis of colorectal cancer survival data. Eur J Cancer 2010; 46: 2788-2798
- Ribic CM, Sargent DJ, Moore MJ, et al.: Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer. N Engl J Med 2003; 349: 247-257
- Hutchins G, Southward K, Handley K, et al.: Value of Mismatch Repair, KRAS, and BRAF Mutations in Predicting Recurrence and Benefits From Chemotherapy in Colorectal Cancer. J Clin Oncol 2011; 29: 1261-1270
- Sargent DJ, Marsoni S, Monges G, et al.: Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010; 28: 3219-3226
- Cohen R, Taieb J, Fiskum J, Yothers G, et al.: Microsatellite Instability in Patients With Stage Ⅲ Colon Cancer Receiving Fluoropyrimidine With or Without Oxaliplatin: An ACCENT Pooled Analysis of 12 Adjuvant Trials. J Clin Oncol 2021; 39: 642-651
- Clancy C, Burke JP, Kalady MF, et al.: BRAF mutation is associated with distinct clinicopathological characteristics in colorectal cancer: a systematic review and meta-analysis. Colorectal Dis 2013; 15: e711-718
- Peng J, Lv J, Peng J: KRAS mutation is predictive for poor prognosis in rectal cancer patients with neoadjuvant chemoradiotherapy: a systemic review and meta-analysis. Int J Colorectal Dis 2021; 36: 1781-1790
- O’Connell E, Reynolds IS, McNamara DA, et al.: Microsatellite instability and response to neoadjuvant chemoradiotherapy in rectal cancer: A systematic review and meta-analysis. Surg Oncol 2020; 34: 57-62
- Swets M, Graham Martinez C, et al.: Microsatellite instability in rectal cancer: what does it mean? A study of two randomized trials and a systematic review of the literature. Histopathology 2022; 81: 352-362
- Cercek A, Lumish M, Sinopoli J, et al.: PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med 2022; 386: 2363-2376
- Brudvik KW, Kopetz SE, Li L, et al.: Meta-analysis of KRAS mutations and survival after resection of colorectal liver metastases. Br J Surg 2015; 102: 1175-1183
- Passiglia F, Bronte G, Bazan V, et al.: Can KRAS and BRAF mutations limit the benefit of liver resection in metastatic colorectal cancer patients? A systematic review and meta-analysis. Crit Rev Oncol Hematol 2016; 99: 150-157
- Tosi F, Magni E, Amatu A, et al.: Effect of KRAS and BRAF Mutations on Survival of Metastatic Colorectal Cancer After Liver Resection: A Systematic Review and Meta-Analysis. Clin Colorectal Cancer 2017; 16: e153-e163
- Gau L, Ribeiro M, Pereira B, et al.: Impact of BRAF mutations on clinical outcomes following liver surgery for colorectal liver metastases: An updated meta-analysis. Eur J Surg Oncol 2021; 47: 2722-2733
- Huang J, Zang Q, Wen Y, et al.: Prognostic value of KRAS mutation in patients undergoing pulmonary metastasectomy for colorectal cancer: A systematic review and meta-analysis. Crit Rev Oncol Hematol 2021; 160: 103308
CQ 10:直腸癌に対して側方郭清は推奨されるか?
腫瘍下縁が腹膜反転部より肛門側にあり,壁深達度がcT3以深の直腸癌には側方郭清を推奨する。側方リンパ節転移の診断基準は確立されておらず,現時点では側方郭清を省略できる症例の基準は明らかではない。
- 術前または術中診断にて側方リンパ節転移陽性の場合は,側方郭清を行うことを強く推奨する。(推奨度1・エビデンスレベルC,合意率:100%)
- 術前または術中診断にて側方リンパ節転移陰性の場合の側方郭清の生存率改善効果は限定的であるが,局所再発の抑制効果が期待できるため行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:96%)
本邦での後方視的研究によると,下部直腸癌の15~20%1-5)に側方リンパ節転移が存在する。側方リンパ節転移は欧米では全身性疾患の兆候と捉えられる傾向があり,一般にこれらの予後は不良であるが,R0切除し得た症例では45~55%1,3-5)に5年生存が得られることが多数報告されている。特にリンパ節転移個数が少ない症例6)や内腸骨領域7)に転移が限局した症例の側方郭清効果は高い。大腸癌研究会全国登録における1995~2004年のpT3・T4下部直腸癌症例の傾向スコア解析法を用いた解析では,側方郭清例の5年全生存率は非郭清例と比較して良好であり(68.9% vs. 62.0%)8),術前画像上で側方リンパ節が軽度腫大する症例には側方郭清の予後改善効果が存在することを示した多施設研究もある9)。またD3リンパ節郭清の対象となる下腸間膜根リンパ節転移に比べ,側方リンパ節転移の郭清効果は高い5,10)。後方視的研究の限界として一定のバイアスがかかっている可能性があるものの,複数の研究において郭清効果を示唆する一貫した結果が得られており,側方郭清により生存改善が期待される意義は大きいと考えられる。術前化学放射線療法を施行した症例においても,治療前に腫大した側方リンパ節が存在する場合には治療後も側方リンパ節転移が高率であることが報告されており,側方郭清の省略は推奨されない11-13)。
明らかな側方リンパ節転移のない症例における側方郭清の意義に関して,JCOG0212試験では術前CTまたはMRIにて短径10 mm以上の側方リンパ節が存在せず,腫瘍下縁が腹膜反転部より肛門側に位置する直腸癌を対象に,無再発生存期間を主要評価項目として直腸間膜切除(ME)群の直腸間膜切除+側方郭清(ME+LLND)群に対する非劣性が検討された。その結果,無再発生存期間において,ME+LLND群に対するME群のハザード比は1.07(90.9%信頼区間0.84-1.36)であり,非劣性マージンの上限を1.34とした本試験において,ME群のME+LLND群に対する非劣性は統計学的に証明されなかった(P non-inferiority=0.0547)14)。局所再発の頻度はME群(12.6%)に比べてME+LLND群で有意に低率(7.4%)であったが,両群の無再発生存曲線は極めて近似しており,副次的評価項目である全生存率,無局所再発生存率のいずれにも有意差はなかった。一方,近年報告された長期追跡データでは,7年局所無再発生存率(ME+LLND vs. ME;82.9% vs. 78.9%)と7年側方無再発生存率(ME+LLND vs. ME;85.3% vs. 80.3%)はともにME+LLND群の方が良好であり,cStage Ⅲを対象とするサブグループ解析において,ME+LLND群の無再発生存期間は有意に良好であった15)。短期手術成績において,ME+LLND群には約100分の手術時間延長と約240 mLの出血量増加が認められ,Grade 3~4の手術合併症はME群(16.0%)と比較してME+LLND群(21.7%)で多い傾向があった16)。排尿機能,男性性機能には有意な差がないものの17,18),中等度以上の勃起機能障害の発生はME群よりもME+LLND群に多い傾向を認めた18)。
側方郭清が高難度手術に位置づけられている欧米では,側方リンパ節転移が陰性と判断される症例に関しては,側方郭清を行わないことが推奨されている19)。しかしながら,JCOG0212試験の結果からは,側方領域に腫大したリンパ節が存在しない症例においても側方郭清を一律に省略することは局所制御の観点から推奨されない。局所制御や生存改善に関して側方郭清に期待される効果の程度を認識し,手術リスク・術後機能障害とのバランスを総合的に考慮して適応を決定すべきである。なお,術前化学放射線療法が施行された側方転移陰性症例における側方郭清の意義は明らかでなく,局所制御治療を併用することの侵襲性にも留意する。
現時点では側方郭清を省略できる症例の基準は明らかでない。術前放射線療法に側方リンパ節郭清と同等の治療効果があるとのランダム化比較試験の結果が本邦から報告されているが検討症例数が少なく20),この結果の再現性を検証した試験もない。また,側方リンパ節転移の術前診断の精度については十分でなく,診断基準の確立は今後の課題である。大腸癌研究会の後方視的研究によると,MRIによる側方リンパ節転移の診断能は短径10 mmをカットオフとするよりも短径5 mmをカットオフとしたほうが良好であるが,従来の撮影法によるリンパ節径のみを基準とした診断能の限界も示されている21)。現在,高解像度MRIを用いた側方転移の診断基準の確立に関する大腸癌研究会の多施設研究が進行中であり,リンパ節の長径と短径の組み合わせによって90%以上の感度でリンパ節転移の抽出が可能であることが報告されている22)。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ10-① | 100%(23/23) | 0% | 0% | 0% | 0% |
| CQ10-② | 4%(1/23) | 96%(22/23) | 0% | 0% | 0% |
文献
- Sugihara K, Kobayashi H, Kato T, et al.: Indication and benefit of pelvic sidewall dissection for rectal cancer. Dis Colon Rectum 2006; 49: 1663-1672
- Kobayashi H, Mochizuki H, Kato T, et al.: Outcomes of surgery alone for lower rectal cancer with and without pelvic sidewall dissection. Dis Colon Rectum 2009, 52: 567-576
- Ueno M, Oya M, Azekura K, et al.: Incidence and prognostic significance of lateral lymph node metastasis in patients with advanced low rectal cancer. Br J Surg 2005; 92: 756-763
- Kanemitsu Y, Komori K, Shida D, et al.: Potential impact of lateral lymph node dissection(LLND)for low rectal cancer on prognoses and local control: A comparison of 2 high-volume centers in Japan that employ different policies concerning LLND. Surgery 2017; 162: 303-314
- Inoue H, Sakai K, Nozawa H, et al.: Therapeutic significance of D3 dissection for low rectal cancer: a comparison of dissection between lateral pelvic lymph nodes and the lymph nodes along the root of the inferior mesenteric artery in a multicenter retrospective cohort study. Int J Colorectal Dis 2021; 36: 1263-1270
- Ueno H, Mochizuki H, Hashiguchi Y, et al.: Prognostic determinant of patients with lateral nodal involvement by rectal cancer. Ann Surg 2001; 234: 190-197
- Akiyoshi T, Watanabe T, Miyata S, et al.; Japanese Society for Cancer of the Colon and Rectum: Results of a Japanese nationwide multi-institutional study on lateral pelvic lymph node metastasis in low rectal cancer: is it regional or distant disease? Ann Surg 2012; 255: 1129-1134
- Ozawa H, Kotake K, Hosaka M, et al.: Impact of lateral pelvic lymph node dissection on the survival of patients with T3 and T4 low rectal cancer. World J Surg 2016; 40: 1492-1499
- Hida K, Nishizaki D, Sumii A, et al.; Japan Society of Laparoscopic Colorectal Surgery: Prognostic impact of lateral pelvic node dissection on the survival of patients in low rectal cancer subgroup based on lymph node size. Ann Surg Oncol 2021; 28: 6179-6188
- Ueno H, Mochizuki H, Hashiguchi Y, et al.: Potential prognostic benefit of lateral pelvic node dissection for rectal cancer located below the peritoneal reflection. Ann Surg 2007; 245: 80-87
- Yang X, Yang S, Hu T, et al: What is the role of lateral lymph node dissection in rectal cancer patients with clinically suspected lateral lymph node metastasis after preoperative chemoradiotherapy? A meta-analysis and systematic review. Cancer Medicine 2020; 9: 4477-4489
- Ogura A, Konishi T, Cunningham C, et al.; Lateral Node Study Consortium: Neoadjuvant(Chemo)radiotherapy with total mesorectal excision only is not sufficient to prevent lateral local recurrence in enlarged nodes: results of the multicenter lateral node study of patients with low cT3/4 rectal cancer. J Clin Oncol 2019; 37: 33-43
- Kim MJ, Chang GJ, Lim H-K, et al.: Oncological impact of lateral lymph node dissection after preoperative chemoradiotherapy in patients with rectal cancer. Ann Surg Oncol 2020; 27: 3525-3533
- Fujita S, Mizusawa J, Kanemitsu Y, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Mesorectal excision with or without lateral lymph node dissection for clinical stage Ⅱ/Ⅲ lower rectal cancer(JCOG0212): a multicenter, randomized controlled, noninferiority trial. Ann Surg 2017; 266: 201-207
- Tsukamoto S, Fujita S, Ota M, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Long-term follow-up of the randomized trial of mesorectal excision with or without lateral lymph node dissection in rectal cancer(JCOG0212). Br J Surg 2020; 107(5): 586-594
- Fujita S, Akasu T, Mizusawa J, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Postoperative morbidity and mortality after mesorectal excision with and without lateral lymph node dissection for clinical stage Ⅱ or stage Ⅲ lower rectal cancer(JCOG0212): results from a multicentre, randomised controlled, non-inferiority trial. Lancet Oncol 2012; 13: 616-621
- Ito M, Kobayashi A, Fujita S, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Urinary dysfunction after rectal cancer surgery: Results from a randomized trial comparing mesorectal excision with and without lateral lymph node dissection for clinical stage Ⅱ or Ⅲ lower rectal cancer(Japan Clinical Oncology Group Study, JCOG0212). Eur J Surg Oncol 2018; 44: 463-468
- Saito S, Fujita S, Mizusawa J, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Male sexual dysfunction after rectal cancer surgery: Results of a randomized trial comparing mesorectal excision with and without lateral lymph node dissection for patients with lower rectal cancer: Japan Clinical Oncology Group Study JCOG0212. Eur J Surg Oncol 2016; 42: 1851-1858
- You YN, Hardiman KM, Bafford A, et al.; On Behalf of the Clinical Practice Guidelines Committee of the American Society of Colon and Rectal Surgeons: The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Management of Rectal Cancer. Dis Colon Rectum 2020; 63: 1191-1222
- Nagawa H, Muto T, Sunouchi K, et al.: Randomized, controlled trial of lateral node dissection vs. nerve-preserving resection in patients with rectal cancer after preoperative radiotherapy. Dis Colon Rectum 2001; 44: 1274-1280
- Ogawa S, Hida J, Ike H, et al.: Selection of lymph node-positive cases based on perirectal and lateral pelvic lymph nodes using magnetic resonance imaging: study of the Japanese Society for Cancer of the Colon and Rectum. Ann Surg Oncol 2016; 23: 1187-1194
- Kawai K, Shiomi A, Miura T, et al.: Optimal diagnostic criteria for lateral lymph node dissection using magnetic resonance imaging: a multicenter prospective study. ANZ J Surg 2023; 93: 206-213
CQ 11:切除可能な直腸癌に対して術前治療は推奨されるか?
- 局所再発リスクが高い症例に対しては,術前化学放射線療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:91%)
- 局所再発リスクが高い症例に対しては,術前化学療法(放射線療法なし)は,行わないことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:78%)
本邦では,下部直腸進行癌に対してはTME(あるいはTSME)+自律神経温存側方郭清が標準的に行われ,生存率,局所再発率ともに良好な成績が報告されており1,2),欧米で標準である術前放射線療法は積極的には行われていないのが現状である。
側方リンパ節転移がないと診断された症例において,術前放射線単独療法後における側方リンパ節郭清の有無を比較した本邦におけるランダム化比較試験では,両群の無再発率,全生存率に差はなく,側方郭清を施行しない群で有意に排尿障害,性機能障害が少ないことが報告されているが3),45例と少数例の検討であることから,この報告の意義は限定的である。
以上より,本邦における術前放射線療法の局所再発低減における上乗せ効果,あるいは側方郭清の代替としての有効性については,現時点で明らかなエビデンスはなく,標準治療はupfront surgeryである。
切除可能な直腸癌に対する術前治療は,側方郭清が行われない欧米において,局所再発率の低減と拡大郭清の合併症回避を目的に治療開発がなされた。筋層外浸潤,またはリンパ節転移陽性の直腸癌に対する治癒切除後の症例に対する術後補助療法として,補助療法なし,化学療法単独,放射線療法単独,放射線療法と化学療法を組み合わせた治療の4群がランダム化比較された試験において,放射線療法と化学療法群を組み合わせた治療で最も再発率が低かった4)。その結果も踏まえ,NIHコンセンサス会議において,Stage ⅡまたはⅢの直腸癌に対する術後補助療法として,化学療法と放射線療法を組み合わせた治療が推奨された5)。その後,術後化学放射線療法と術前化学放射線療法をランダム化比較した試験が行われ,術前化学療法群で局所制御率が高かったことが報告された6)。
その他の複数の臨床試験およびメタアナリシスにて,術前放射線療法により,生存率の向上は認めないものの,局所再発率の低下が示されている7-9)。このため欧米では,局所進行直腸癌に対して術前放射線療法を行うことが標準であるが,適応は様々なリスク因子(NCCN/ESMOガイドラインで挙げられているリスク因子:占居部位[下部直腸],T3/4,リンパ節転移陽性,CRM involved,EMVI[+])によって層別化されており,欧州と米国でも同一ではない10,11)。また,術前放射線療法を実施した場合,腸管障害,排便機能障害,性機能障害,2次癌発生などの有害事象の発生率が増加する12-14)。
以上より,欧米のエビデンスを参照すれば,局所再発リスクが高いと予想される症例において術前放射線療法を行うことが考慮される。
術前放射線療法の方法として,術前化学放射線療法(LC-CRT:long course CRT)が標準的であるが,欧州を中心に術前短期放射線単独療法(SCRT:short course RT)も実施されている。LC-CRTとSCRTの比較ではLC-CRTがpCR率は高いものの,局所制御率,生存率および遅発性有害事象は同等と報告されている15,16)。強度変調放射線治療(IMRT:intensity modulated radiotherapy)を用いた術前化学放射線療法の第Ⅱ相試験においては,急性期消化器毒性の軽減効果は認められておらず,今後遅発性有害事象軽減も含めたIMRTの有用性についての評価が必要である17)。
術前化学放射線療法が標準である海外においては,主に低リスク症例を対象として放射線照射による有害事象を回避し,遠隔転移の制御による生存率の向上を目指した,放射線照射を伴わない術前化学療法の有効性を示唆するデータも出てきている。PROSPECT試験は括約筋温存手術が可能なcT2N1,T3N0,or T3N1(Stage ⅡA,ⅢA,or ⅢB)の低リスク症例を対象に術前化学放射線療法群と術前化学療法群(mFOLFOX6)にランダム化し,術前化学療法群ではnon-responderのみに選択的に術前化学放射線療法を実施する第Ⅱ/Ⅲ相試験である。主要評価項目の5年無病生存率がFOLFOX群で80.8%(95%信頼区間77.9-83.7),化学放射線療法群では78.6%(95%信頼区間75.4-81.8)とFOLFOX群の非劣性が証明され,病理学的完全寛解もFOLFOX群で21.9%,化学放射線療法群で24.3%であった。なお,術前化学療法群では,10.4%の症例で術前または術後に放射線治療が実施されている18)。FOWARC試験は,T4や下部直腸原発といった高リスク症例を含むcStage Ⅱ(T3-4N0)/Ⅲ(T1-4N1-2)を対象とした5-FU/LV併用術前化学放射線療法(FU+RT)とmFOLFOX併用術前化学放射線療法(mFOLFOX6+RT),術前化学療法単独(mFOLFOX6)の3群の比較で,mFOLFOXを含む治療群の3年無病生存率における優越性を検証する第Ⅲ相試験である。なお,術後補助化学療法はFU+RT群では5-FU/LV,その他の2群ではmFOLFOXであった。結果,3年無病生存率に有意差はなく(FU+RT 72.9%,mFOLFOX+RT 77.2%,mFOLFOX 73.5%,p=0.709),mFOLFOXを含む治療群の優越性は示されなかったものの,全生存率および局所再発率にも有意差は認められなかった19)。現在,cT2N+ or cT3-4aNany,MRF uninvolvedを対象とした,化学放射線療法に対する術前化学療法(CAPOX)+選択的化学放射線療法の非劣性を見るCONVERT試験が進行中であり,pCR率は両群同等であることが報告されているが,今後の主要評価項目の公表が待たれる20)。
術前化学療法については,上記のごとく,PROSPECT試験により局所再発リスクが比較的低い対象ではLC-CRTと術前化学療法+選択的化学放射線療法の非劣性が証明されているものの,本邦の標準治療であるupfrontの手術療法との比較試験はない。さらに,局所再発リスクが高い症例に対しては,術前化学療法のみの有効性は現時点では明確ではないことから,行わないことを弱く推奨する。
なお,Total neoadjuvant therapy(TNT)およびNon operative management(NOM)については,それぞれCQ 12およびCQ 13を参照されたい。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ11-① | 9%(2/23) | 91%(21/23) | 0% | 0% | 0% |
| CQ11-② | 0% | 13%(3/23) | 78%(18/23) | 4%(1/23) | 4%(1/23) |
文献
- Fujita S, Mizusawa J, Kanemitsu Y, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Mesorectal Excision With or Without Lateral Lymph Node Dissection for Clinical Stage Ⅱ/Ⅲ Lower Rectal Cancer(JCOG0212): A Multicenter, Randomized Controlled, Noninferiority Trial. Ann Surg 2017; 266: 201-207
- Ozawa H, Kotake K, Hosaka M, et al.: Impact of Lateral Pelvic Lymph Node Dissection on the Survival of Patients with T3 and T4 Low Rectal Cancer. World J Surg 2016; 40: 1492-149
- Nagawa H, Muto T, Sunouchi K, et al.: Randomized, controlled trial of lateral node dissection vs. nerve-preserving resection in patients with rectal cancer after preoperative radiotherapy. Dis Colon Rectum 2001; 44: 1274-1280
- Gastrointestinal Tumor Study Group: Prolongation of the disease-free interval in surgically treated rectal carcinoma. N Engl J Med 1985; 312: 1465-1472
- NIH consensus conference. Adjuvant therapy for patients with colon and rectal cancer. Jama 1990; 264: 1444-1450
- Sauer R, Becker H, Hohenberger W, et al.; German Rectal Cancer Study Group: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351: 1731-1740
- van Gijn W, Marijnen CA, Nagtegaal ID, et al.; Dutch Colorectal Cancer Group: Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011; 12: 575-582
- Sauer R, Liersch T, Merkel S, et al.: Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase Ⅲ trial after a median follow-up of 11 years. J Clin Oncol 2012; 30: 1926-1933
- Rahbari NN, Elbers H, Askoxylakis V, et al.: Neoadjuvant radiotherapy for rectal cancer: meta-analysis of randomized controlled trials. Ann Surg Oncol 2013; 20: 4169-4182
- Cervantes A, Adam R, Rosello S, et al. Metastatic colorectal cancer: ESMO: Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of oncology: official journal of the European Society for Medical Oncology/ESMO 2023; 34: 10-32
- NCCN Clinical Practice Guidelines in Oncology: Rectal Cancer ver. 1.2024 https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf(2024/5/14 accessed)
- Peeters KC, van de Velde CJ, Leer JW, et al.: Late side effects of short-course preoperative radiotherapy combined with total mesorectal excision for rectal cancer: increased bowel dysfunction in irradiated patients--a Dutch colorectal cancer group study. J Clin Oncol 2005; 23: 6199-6206
- Wiltink LM, Chen TY, Nout RA, et al.: Health-related quality of life 14 years after preoperative short-term radiotherapy and total mesorectal excision for rectal cancer: report of a multicenter randomised trial. Eur J Cancer 2014; 50: 2390-2398
- Birgisson H, Påhlman L, Gunnarsson U, et al.: Occurrence of second cancers in patients treated with radiotherapy for rectal cancer. J Clin Oncol 2005; 23: 6126-6131
- Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al.: Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 2006; 93: 1215-1223
- Ngan SY, Burmeister B, Fisher RJ, et al.: Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol 2012; 30: 3827-3833
- Hong TS, Moughan J, Garofalo MC, et al.: NRG Oncology Radiation Therapy Oncology Group 0822: A Phase 2 Study of Preoperative Chemoradiation Therapy Using Intensity Modulated Radiation Therapy in Combination With Capecitabine and Oxaliplatin for Patients With Locally Advanced Rectal Cancer. Int J Radiat Oncol Biol Phys 2015; 93: 29-36
- Schrag D, Shi Q, Weiser MR, et al.: Preoperative treatment of locally advanced rectal cancer. N Eng J Med 2023; 389: 322-334
- Deng Y, Chi P, Lan P, et al.: Neoadjuvant Modified FOLFOX6 With or Without Radiation Versus Fluorouracil Plus Radiation for Locally Advanced Rectal Cancer: Final Results of the Chinese FOWARC Trial. J Clin Onco. 2019; 37: 3223-3233
- Mei WJ, Wang XZ, Li YF, et al.: Neoadjuvant Chemotherapy With CAPOX Versus Chemoradiation for Locally Advanced Rectal Cancer With Uninvolved Mesorectal Fascia(CONVERT): Initial Results of a Phase Ⅲ Trial. Ann Surg 2023; 277: 557-564
CQ 12:直腸癌に対するTotal Neoadjuvant Therapy(TNT)は推奨されるか?
直腸癌に対するTNTは行わないことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:70%)
TNTとは,局所制御は改善するが,遠隔転移の抑制や予後改善効果が示されていない術前化学放射線療法(CRT:chemoradiotherapy)の弱点を補完するため,忍容性の低い術後補助化学療法に代わり全身薬物療法を術前治療に組み込んだ治療戦略である。全身薬物療法を,術前照射前に行うinduction chemotherapy(INCT),照射後に手術までの待機期間に行うconsolidation chemotherapy(CNCT)の開発が行われてきたが,照射法(long course CRT,5×5 Gy短期照射(SCRT)),薬物療法のレジメンや期間にも一定のコンセンサスが得られていないのが現状である。
<TNT(INCT/CNCT)vs. CRT>
TNTとCRTを無作為化比較した試験が,いくつか報告されている1-6)。有効性に関して,病理学的完全奏効(pCR)率については,RAPIDO試験(28% vs. 14%)4),PRODIGE23試験(28% vs. 12%)3)では,pCR率の有意な向上が報告しているが,有意差なしとする報告もある。一方,手術症例でのR0切除率が有意に改善したとする報告はない。局所再発率については有意に改善したとする報告はない一方,RAPIDO試験の最新の報告では,手術症例における5年局所再発率はTNT群で高く(12% vs. 8%),その多くは術中穿孔をきたした症例であったとしている6)。RAPIDO試験5),PRODIGE23試験3)では遠隔転移再発率はそれぞれ(TNT群vs CRT群),23% vs. 30%(5年),17% vs. 25%(3年),無病生存率については72% vs. 66%(5年),76% vs. 69%(3年)で有意な改善を報告しているが,有意差なしとする試験の報告もある。一方,5年以上経過観察を行ったうえで,全生存率(OS)が改善したとする報告はない。
毒性に関しては,CRTに薬物療法を加えることで,毒性は増すとする報告が多いが,GCR-3試験では,術後補助化学療法と比較して,術前投与では投与量を保ちつつ,薬物療法の毒性(G3/4)が低かったと報告している(19% vs. 54%)1)。
これらのランダム化試験を含む3つのCRTとTNTを比較したメタ解析の結果では,いずれもTNTで高いpCR率が得られているものの,無病生存率(DFS),OSに関しては一貫した結果が得られておらず議論の残るところである10-12)。
<INCT(全身薬物療法+long course CRT)vs. CNCT(long course CRT+全身薬物療法)>
CAO/ARO/AIO-12試験は,ドイツで行われたlong course CRTに3サイクルのFOLFOXを加えたINCTおよびCNCTの有効性を比較した試験である7,8)。CR率はCNCT群で有意に高く(21% vs. 28%),無憎悪生存率,毒性,QOLには差がなく,臓器温存を重要視するならばCNCTが推奨されると結論づけている。また,CAO/ARO/AIO-04試験との統合解析では,long course CRTに対するTNTの全生存率への上乗せ効果はなく,TNTは臓器温存を目指す一部の患者にとっての選択肢だと結論付けている13)。OPRA試験は,米国で行われたlong course CRTにFOLFOXまたはCAPOXを加えたINCTとCNCTの有効性をヒストリカルコントロールと比較した試験である9)。主評価項目であるDFSはコントロールと比較して両群で差を認めなかったものの,探索的な試験治療群間の比較では,根治切除(TME:total mesorectal excision)を回避できる,TME-free survivalという新しい副次的評価項目が,CNCT群で有意に上回ることが示され,CNCTが非切除治療(NOM:nonoperative management)を目指す場合には有用であることが示唆された。NOMの解説については,CQ 13を参照いただきたい。
一方,本邦からのTNTに関するデータは乏しく,単施設からの単アーム第Ⅱ相試験結果が報告されているのみである。KonishiらはFOLFOX+bevacizumab後にS-1/RTを行うINCTの有効性・安全性を評価し,術後合併症率を上昇させることなくpCR率が37.2%と高率で,安全で妥当な治療だと報告している14)。
これまでの大規模臨床試験の結果から,TNTによりpCR率やNOMのチャンスが上昇することが期待できるものの,全生存率の改善効果は未だ明らかでない。また,本邦の標準治療である手術先行治療と比較し,手術の難易度や術後合併症率を比較した報告は皆無であり,治療の安全性に対する評価は不十分であると言わざるを得ない。加えて,治療が過剰となる可能性,半年以上にわたる治療期間の延長,医療費の増加も問題である。
以上より,現状では直腸癌に対するTNTは日常臨床として行わないことを弱く推奨する。特に術前放射線治療に精通していない施設での安易なTNTの導入は控えるべきであり,TNTは適切に計画された臨床試験として行い,本邦での治療成績を明らかにしたうえで,治療対象および最適なレジメンを検討すべきである。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ12 | 0% | 4%(1/23) | 70%(16/23) | 4%(1/23) | 22%(5/23) |
文献
- Fernández-Martos C, Pericay C, Aparicio J, et al.: Phase Ⅱ, randomized study of concomitant chemoradiotherapy followed by surgery and adjuvant capecitabine plus oxaliplatin(CAPOX)compared with induction CAPOX followed by concomitant chemoradiotherapy and surgery in magnetic resonance imaging-defined, locally advanced rectal cancer: Grupo cancer de recto 3 study. J Clin Oncol 2010; 28: 859-865
- Fernandez-Martos C, Garcia-Albeniz X, Pericay C, et al.: Chemoradiation, surgery and adjuvant chemotherapy versus induction chemotherapy followed by chemoradiation and surgery: long-term results of the Spanish GCR-3 phase Ⅱ randomized trial. Ann Oncol 2015; 26: 1722-1728
- Conroy T, Bosset JF, Etienne PL, et al.; Unicancer Gastrointestinal Group and Partenariat de Recherche en Oncologie Digestive(PRODIGE)Group: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer(UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22: 702-715
- Bahadoer RR, Dijkstra EA, van Etten B, et al.; RAPIDO collaborative investigators: Short-course radiotherapy followed by chemotherapy before total mesorectal excision(TME)versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer(RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22: 29-42
- Bahadoer RR, Hospers GAP, Marijnen CAM, et al.; collaborative investigators: Risk and location of distant metastases in patients with locally advanced rectal cancer after total neoadjuvant treatment or chemoradiotherapy in the RAPIDO trial. Eur J Cancer 2023; 85: 139-149
- Dijkstra EA, Nilsson PJ, Hospers GAP, et al.; Collaborative Investigators: Locoregional Failure During and After Short-course Radiotherapy followed by Chemotherapy and Surgery Compared to Long-course Chemoradiotherapy and Surgery - A Five-year Follow-up of the RAPIDO Trial. Ann Surg 2023; 278: e766-e772
- Fokas E, Allgäuer M, Polat B, et al.; German Rectal Cancer Study Group: Randomized Phase Ⅱ Trial of Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer: CAO/ARO/AIO-12. J Clin Oncol 2019; 37: 3212-3222
- Fokas E, Schlenska-Lange A, Polat B, et al.; German Rectal Cancer Study Group: Chemoradiotherapy Plus Induction or Consolidation Chemotherapy as Total Neoadjuvant Therapy for Patients With Locally Advanced Rectal Cancer: Long-term Results of the CAO/ARO/AIO-12 Randomized Clinical Trial. JAMA Oncol 2022; 8: e215445
- Garcia-Aguilar J, Patil S, Gollub MJ, et al.: Organ Preservation in Patients With Rectal Adenocarcinoma Treated With Total Neoadjuvant Therapy. J Clin Oncol 2022; 40: 2546-2556
- Kasi A, Abbasi S, Handa S, et al.: Total Neoadjuvant Therapy vs Standard Therapy in Locally Advanced Rectal Cancer: A Systematic Review and Meta-analysis. JAMA Netw Open 2020; 3: e2030097
- Liu S, Jiang T, Xiao L, et al.: Total Neoadjuvant Therapy(TNT)versus Standard Neoadjuvant Chemoradiotherapy for Locally Advanced Rectal Cancer: A Systematic Review and Meta-Analysis. Oncologist 2021; 26: e1555-e1566
- Kong JC, Soucisse M, Michael M, et al.: Total Neoadjuvant Therapy in Locally Advanced Rectal Cancer: A Systematic Review and Metaanalysis of Oncological and Operative Outcomes. Ann Surg Oncol 2021; 28: 7476-7486
- Diefenhardt M, Fleischmann M, Martin D, et al.; German Rectal Cancer Study Group: Clinical outcome after total neoadjuvant treatment(CAO/ARO/AIO-12)versus intensified neoadjuvant and adjuvant treatment(CAO/ARO/AIO-04)a comparison between two multicenter randomized phase Ⅱ/Ⅲ trials. Radiother Oncol 2023; 179: 109455
- Konishi T, Shinozaki E, Murofushi K, et al.: Phase Ⅱ Trial of Neoadjuvant Chemotherapy, Chemoradiotherapy, and Laparoscopic Surgery with Selective Lateral Node Dissection for Poor-Risk Low Rectal Cancer. Ann Surg Oncol 2019; 26: 2507-2513
CQ 13:直腸癌術前治療後cCR症例に対するNon-Operative Management(NOM)は推奨されるか?
直腸癌術前治療後cCR症例に対してNOMを行わないことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:39%)
欧米では,cStage Ⅰ~Ⅲ直腸癌の再発リスクに応じて術前化学放射線治療(nCRT)を行うことが標準治療とされている。さらに,2018年から,米国NCCNガイドラインでは,術後補助療法を術前に行うTotal neoadjuvant therapy(TNT)が推奨される治療選択に加えられた1)。そして,それらの直腸癌の術前治療後に臨床的完全奏効(cCR)が達成された場合,手術を行わずに待機的な治療を行う非手術的管理(NOM:Non-Operative Management,積極的経過観察,Watch and Wait療法)が検討されることがある。
直腸癌に対するNOMは,2004年にHabr-Gamaら2)により,nCRT後にcCRを達成した一部の患者に対する有効な選択肢として世界で初めて提案された。切除可能な下部直腸腺癌患者265人に,術前補助療法として5-FU,ロイコボリン,50.4 Gyの放射線治療が行われ,27%の患者がcCRを達成した。その後,平均追跡期間57.3カ月の間に,3名(4%)が遠隔転移を,2名(3%)が局所再発を発症したが,局所再発は,小線源療法または経肛門的切除術により救済された。再発率および癌関連死亡率は,NOM群でそれぞれ7.0%および0%,手術群で13.6%および9.0%であった。Maasら3)は,NOMが選択されたcCR患者21名と,外科的切除を受けたpCR患者20名の対照群との転帰を比較した。NOM群では,対照群と比べて,失禁スコア,腸機能スコアが低く,平均排便回数が少ないことが報告された。2年無病生存率(DFS),全生存率(OS)については,両群間に統計的な差は認められなかった(NOM群vs. 対照群:DFS 89% vs. 93%,OS 100% vs. 91%)。その他にも,NOMの有効性と安全性を示す類似の研究結果が幾つか報告されている。しかし,そのほとんどがレトロスペクティブ研究であり,患者数も多岐にわたる4-9)。レトロスペクティブ研究以外では,複数の単一施設による前向き研究,NOM患者(n=880)の世界最大のデータセットであるInternational Watch & Wait Database(IWWD)10),およびいくつかのメタアナリシス11-13)からもNOMの良好な成績が報告されている。
2022年に発表されたOPRA試験14)は,腫瘍の奏効割合を高めることを目的としたTNTにNOMを組み込んだ最初の前向き無作為化第Ⅱ相試験であった。この試験では,TNTを受けた直腸癌患者の半数で臓器温存が可能であること,nCRT後に地固め化学療法を行うことが,pCR率を最大化する最適な戦略である可能性が示された。その他の第Ⅱ/Ⅲ相試験の結果も合わせると,nCRTを単独で受けた直腸癌患者の約10~20%がpCRを獲得する15,16)一方で,TNTレジメンを導入した場合,pCR率は20~60%に達する可能性がある14,17,18)。
NOMについての良好な結果がある一方で,NOMの大きな不確定要素の一つは,腫瘍学上の長期的な治療成績の不足である19)。NOMは長期に積極的なサーベイランスが必須で,現在,直腸指診,内視鏡,MRIによる密な評価が標準的な方法とされるが,検討が十分なされたとは言い難い。腫瘍の再増殖がcCR患者の25~30%で起こり10),その多くは最初の1年間に生じ2年を過ぎるとほとんどプラトーとなる。再増殖しても局所制御ができないことは少ないとされるが,遠隔転移の割合が高くなり,予後が低下する可能性があることも懸念材料の一つである10,20,21)。また,術前治療後にNOMを行った後の再発例に対して救済手術を行うと,通常の手術単独療法に比べて有害事象や機能(排尿/性機能)的障害の増加も予想される。実際に,最新のオランダからの多施設研究では,NOM後に患者が手術を必要とした場合,QOLと機能的転帰は悪化した22)。本邦からもCRT後にNOMを行った患者の41.7%に局所制御不能な増大があったとの報告があり,適切な監視プロトコルのない非手術的管理は,腫瘍学的転帰を悪化させる可能性あることに注意する必要がある23)。
以上から,術前治療が標準治療として行われる環境下においては,NOMは術前治療後のcCRを伴う直腸癌患者にとって今後の治療選択肢のオプションとなる可能性がある。しかし,このような戦略が広く実施される前に必要な,患者と医療提供者が共有する臨床データが不足している。NOMは,外科的切除を安全で積極的なサーベイランスに置き換えることを基本としており,現段階では,術前治療のレジメン,cCRの定義,疾患モニタリングのための確立された診断方法など包括的サーベイランス方法を含めて,腫瘍学的安全性を損なうことなくNOM戦略の適切な候補を特定するための客観的な標準化がなされていない。したがって,cStage Ⅰ~Ⅲ直腸癌における安易なNOMの実施は控えるべきで,原則的にプロトコルと客観的な評価基準を備えたプロスペクティブ試験のもとで行われるべきである。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ13 | 4%(1/23) | 4%(1/23) | 39%(9/23) | 52%(12/23) | 0% |
文献
- NCCN Clinical Practice Guidelines in Oncology: Rectal Cancer ver. 1.2024 https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf(2024/5/14 accessed)
- Habr-Gama A, Perez RO, Nadalin W, et al.: Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: Long-term results. Ann Surg 2004; 240: 711-717
- Maas M, Beets-Tan RG, Lambregts DM, et al.: Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol 2011; 29: 4633-4640
- Lai CL, Lai MJ, Wu CC, et al.: Rectal cancer with complete clinical response after neoadjuvant chemoradiotherapy, surgery, or“watch and wait”. Int J Colorectal Dis 2016; 31: 413-419
- Dalton RS, Velineni R, Osborne ME, et al.: A single-centre experience of chemoradiotherapy for rectal cancer: Is there potential for nonoperative management? Colorectal Dis 2012; 14: 567-571
- Smith RK, Fry RD, Mahmoud NN, et al.: Surveillance after neoadjuvant therapy in advanced rectal cancer with complete clinical response can have comparable outcomes to total mesorectal excision. Int J Colorectal Dis 2015; 30: 769-774
- Li J, Li L, Yang L, et al.: Wait-and-see treatment strategies for rectal cancer patients with clinical complete response after neoadjuvant chemoradiotherapy: A systematic review and meta-analysis. Oncotarget 2016; 7: 44857-44870
- Smith JD, Ruby JA, Goodman KA, et al.: Nonoperative management of rectal cancer with complete clinical response after neoadjuvant therapy. Ann Surg 2012; 256: 965-972
- Araujo RO, Valadão M, Borges D, et al.: Nonoperative management of rectal cancer after chemoradiation opposed to resection after complete clinical response. A comparative study. Eur J Surg Oncol 2015; 41: 1456-1463
- van der Valk MJM, Hilling DE, Bastiaannet E, et al.: Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database(IWWD): An international multicentre registry study. Lancet 2018; 391: 2537-2545
- Li J, Li L, Yang L, et al.: Wait-and-see treatment strategies for rectal cancer patients with clinical complete response after neoadjuvant chemoradiotherapy: A systematic review and meta-analysis. Oncotarget 2016; 7: 44857-44870
- Dossa F, Chesney TR, Acuna SA, et al.: A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: A systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2017; 2: 501-513
- Sammour T, Price BA, Krause KJ, et al.: Nonoperative Management or‘Watch and Wait’for Rectal Cancer with Complete Clinical Response After Neoadjuvant Chemoradiotherapy: A Critical Appraisal. Ann Surg Oncol 2017; 24: 1904-1915.
- Garcia-Aguilar J, Patil S, Gollub MJ, et al.: Organ preservation in patients with rectal adenocarcinoma treated with total neoadjuvant therapy. J Clin Oncol 2022; 40: 2546-2556
- van der Sluis FJ, van Westreenen HL, van Etten B, et al.: Pretreatment identification of patients likely to have pathologic complete response after neoadjuvant chemoradiotherapy for rectal cancer. Int J Colorectal Dis 2018; 33: 149-157
- Cercek A, Roxburgh CSD, Strombom P, et al.: Adoption of Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer. JAMA Oncol 2018; 4: e180071
- Bahadoer RR, Dijkstra EA, van Etten B, et al.; RAPIDO collaborative investigators: Short-Course radiotherapy followed by chemotherapy before total mesorectal excision(TME)versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer(RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22: 29-42
- Conroy T, Bosset JF, Etienne PL, et al.; Unicancer Gastrointestinal Group and Partenariat de Recherche en Oncologie Digestive(PRODIGE)Group: Neoadjuvant chemotherapy with Folfirinox and preoperative chemoradiotherapy for patients with locally advanced rectal cancer(UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22: 702-715
- Park IJ, You YN, Agarwal A, et al.: Neoadjuvant treatment response as an early response indicator for patients with rectal cancer. J Clin Oncol 2012; 30: 1770-1776
- Cotti GC, Pandini RV, Braghiroli OFM, et al.: Outcomes of Patients With Local Regrowth After Nonoperative Management of Rectal Cancer After Neoadjuvant Chemoradiotherapy. Dis Colon Rectum 2022; 65: 333-339
- Smith JJ, Strombom P, Chow OS, et al.: Assessment of a Watch-and-Wait Strategy for Rectal Cancer in Patients With a Complete Response After Neoadjuvant Therapy. JAMA Oncol 2019; 5: e185896
- Custers PA, van der Sande ME, Grotenhuis BA, et al.; Dutch Watch-and-Wait Consortium: Long-term Quality of Life and Functional Outcome of Patients With Rectal Cancer Following a Watch-and-Wait Approach. JAMA Surg 2023; 158: e230146
- Kawai K, Ishihara S, Nozawa H, et al.: Prediction of pathological complete response using endoscopic findings and outcomes of patients who underwent watchful waiting after chemoradiotherapy for rectal cancer. Dis Colon Rectum 2017; 60: 368-375
CQ 14:直腸癌局所再発の切除は推奨されるか?
直腸癌局所再発でR0切除が可能と判断した場合に手術を行うことを弱く推奨する。
ただし,手術侵襲とリスク,術後のQOLを考慮した上で適応を決定すべきである。骨盤内臓器全摘,骨性骨盤壁切除などは高難度であり,個々の手術チームの習熟度を十分に考慮する必要がある。(推奨度2・エビデンスレベルC,合意率:96%)
直腸癌局所再発に対し,外科治療と放射線療法を比較したランダム化試験はないが,再発切除例の報告は1980年代にはじまり1),本邦からもいくつか報告されている2-7)。R0切除が最も受容性の高い予後因子であるが,近年の報告に限ってもR0切除率は43.0~78.6%とばらつきは大きい8-11)。局所再発手術においては骨盤内臓器全摘,骨性骨盤壁切除などの技術的高難度手術が必要になる場合も少なくなく,泌尿器科や整形外科なども含めた個々の手術チームの習熟度を十分に考慮し,R0切除が可能と判断した場合に限り切除を考慮する。術後の高い合併症率やダブルストマなどの術後QOLについて,本人および家族への十分なインフォームド・コンセントも必要不可欠である。R2切除例では予後,局所制御とも明らかに不良であり,またQOLの改善も期待できないため,R0切除が見込めない場合の切除は推奨できない12-14)。吻合部再発・前方再発例と比較し,側方再発例でのR0切除率は大きく下がる3,15-17)。仙尾骨や恥坐骨など骨性骨盤壁合併切除によりR0切除が可能となるものがある1-6,18-23)が,仙骨切除は第2仙骨下縁に留めるのが一般的である2)。同時性の遠隔転移を伴う局所再発は遠隔転移のない局所再発に比べて予後不良であるが,遠隔転移切除の既往は予後に影響しないとの報告がある24,25)。また,少数の遠隔転移を有する症例に対して,同時または分割切除により全病変を切除できれば根治が得られる場合もあり,適応は慎重かつ厳格に考慮すべきである24-28)。
術前放射線(再)照射はR0切除率を向上させ,予後を改善するとの報告があり4,6,10,29-33),放射線既治療例に対しても,照射法を工夫することで比較的安全に実施可能と報告されている33-36)。一方,初回放射線既治療例での手術成績は未治療例と比較し予後が悪いとの報告や31,37),術前放射線照射や化学療法は予後改善に寄与せず,術後合併症率や再入院率が有意に増加したとの報告もある38)。根治切除可能な直腸癌局所再発に対し,放射線未治療例を対象とした本邦で行われているランダム化試験(JCOG1801;NCT04288999)や,放射線既治療例を対象としたフランスを中心に行われているランダム化試験(GRECCAR15;NCT03879109)において,術前放射線(再)照射の有用性を検証しており,その結果が待たれる。
術中照射は,実施可能な施設が限られるものの,術前化学放射線療法後に10~20 Gyの術中照射を行い,予後が改善したという報告があり39,40),特に他臓器浸潤例または再発例で切除断端が陽性もしくは近接している場合には局所制御率の向上のために考慮してもよい治療法である29,32-34,41-43)。
切除可能症例に対する周術期化学療法の有効性および安全性を示したエビデンスは皆無であり,化学療法の適応について慎重に検討する必要がある。近年,induction settingで術前化学療法および放射線(再)照射併用後に根治切除を行う戦略が有用とする報告が少数ある44,45)。現在,根治切除可能な直腸癌局所再発に対して術前化学放射線療法に術前化学療法の上乗せ効果を検証するため,オランダを中心に行われているランダム化比較試験(PelvEx-Ⅱ;NCT04389086)が進行中である。
また,2022年4月から,手術による根治的な治療が困難である局所再発大腸癌に対し,粒子線治療が保険適応となった。粒子線治療では局所に対して高線量を照射することが可能であることから,従来の放射線治療(X線治療)と比較して良好な成績が報告されている46-48)。放射線治療の既往がある症例に対しても重粒子線は比較的安全に照射することが可能48)である。したがって,R0切除が困難な症例や手術拒否例などでは粒子線治療も選択肢の1つと成り得る。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ14 | 4%(1/23) | 96%(22/23) | 0% | 0% | 0% |
文献
- Wanebo HJ, Gaker DL, Whitehill R, et al.: Pelvic recurrence of rectal cancer. Options for curative resection. Ann Surg 1987; 205: 482-495
- Moriya Y, Akasu T, Fujita S, et al.: Total pelvic exenteration with distal sacrectomy for fixed recurrent rectal cancer in the pelvis. Dis Colon Rectum 2004; 47: 2047-2053
- Yamada K, Ishizawa T, Niwa K, et al.: Patterns of pelvic invasion are prognostic in the treatment of locally recurrent rectal cancer. Br J Surg 2001; 88: 988-993
- Saito N, Koda K, Takiguchi N, et al.: Curative surgery for local pelvic recurrence of rectal cancer. Dig Surg 2003; 20: 192-199
- Kanemitsu Y, Hirai T, Komori K, et al.: Prediction of residual disease or distant metastasis after resection of locally recurrent rectal cancer. Dis Colon Rectum 2010; 53: 779-789
- Ogawa H, Uemura M, Nishimura J, et al.: Preoperative Chemoradiation Followed by Extensive Pelvic Surgery Improved the Outcome of Posterior Invasive Locally Recurrent Rectal Cancer without Deteriorating Surgical Morbidities: A Retrospective, Single-Institution Analysis. Ann Surg Oncol 2015; 22: 4325-4334
- Matsuyama T, Yamauchi S, Masuda T, et al.; Japanese Study Group for Postoperative Follow-up of Colorectal Cancer: Treatment and subsequent prognosis in locally recurrent rectal cancer: a multicenter retrospective study of 498 patients. Int J Colorectal Dis 2021; 36: 1243-1250
- Nielsen MB, Rasmussen PC, Lindegaard JC, et al.: A 10-year experience of total pelvic exenteration for primary advanced and locally recurrent rectal cancer based on a prospective database. Colorectal Dis 2012; 14: 1076-1083
- Ghouti L, Pereira P, Filleron T, et al.: Pelvic exenterations for specific extraluminal recurrences in the era of total mesorectal excision: is there still a chance for cure?: a single-center review of patients with extraluminal pelvic recurrence for rectal cancer from March 2004 to November 2010. Am J Surg 2015; 209: 352-362
- Harris CA, Solomon MJ, Heriot AG, et al.: The Outcomes and Patterns of Treatment Failure After Surgery for Locally Recurrent Rectal Cancer. Ann Surg 2016; 264: 323-329
- You YN, Skibber JM, Hu CY, et al.: Impact of multimodal therapy in locally recurrent rectal cancer. Br J Surg 2016; 103: 753-762
- Hagemans JAW, van Rees JM, Alberda WJ, et al.: Locally recurrent rectal cancer; long-term outcome of curative surgical and non-surgical treatment of 447 consecutive patients in a tertiary referral centre. Eur J Surg Oncol 2020; 46: 448-454
- Pellino G, Sciaudone G, Candilio G, et al.: Effect of Surgery on Health-Related Quality of Life of Patients With Locally Recurrent Rectal Cancer. Dis Colon Rectum 2015; 58: 753-761
- Rausa E, Kelly ME, Bonavina L, et al.: A systematic review examining quality of life following pelvic exenteration for locally advanced and recurrent rectal cancer. Colorectal Dis 2017; 19: 430-436
- Moore HG, Shoup M, Riedel E, et al.: Colorectal cancer pelvic recurrences: determinants of resectability. Dis Colon Rectum 2004; 47: 1599-1606
- Kusters M, Dresen RC, Martijn H, et al.: Radicality of resection and survival after multimodality treatment is influenced by subsite of locally recurrent rectal cancer. Int J Radiat Oncol Biol Phys 2009; 75: 1444-1449
- Sorrentino L, Belli F, Guaglio M, et al.: Prediction of R0/R+ surgery by different classifications for locally recurrent rectal cancer. Updates Surg 2021; 73: 539-545
- Uehara K, Ito Z, Yoshino Y, et al.: Aggressive surgical treatment with bony pelvic resection for locally recurrent rectal cancer. Eur J Surg Oncol 2015; 41: 413-420
- Bosman SJ, Vermeer TA, Dudink RL, et al.: Abdominosacral resection: long-term outcome in 86 patients with locally advanced or locally recurrent rectal cancer. Eur J Surg Oncol 2014; 40: 699-705
- Colibaseanu DT, Dozois EJ, Mathis KL, et al.: Extended sacropelvic resection for locally recurrent rectal cancer: can it be done safely and with good oncologic outcomes? Dis Colon Rectum 2014; 57: 47-55
- Milne T, Solomon MJ, Lee P, et al.: Assessing the impact of a sacral resection on morbidity and survival after extended radical surgery for locally recurrent rectal cancer. Ann Surg 2013; 258: 1007-1013
- Solomon MJ, Brown KG, Koh CE, et al: Lateral pelvic compartment excision during pelvic exenteration. Br J Surg 2015; 102: 1710-1717
- Austin KK, Herd AJ, Solomon MJ, et al.: Outcomes of Pelvic Exenteration with en Bloc Partial or Complete Pubic Bone Excision for Locally Advanced Primary or Recurrent Pelvic Cancer. Dis Colon Rectum 2016; 59: 831-835
- Tanaka A, Uehara K, Aiba T, et al.: The role of surgery for locally recurrent and second recurrent rectal cancer with metastatic disease. Surg Oncol 2020; 35: 328-335
- Voogt ELK, van Zoggel DMGI, Kusters M, et al.: Impact of a history of metastases or synchronous metastases on survival in patients with locally recurrent rectal cancer. Colorectal Dis 2021; 23: 1120-1131
- Hartley JE, Lopez RA, Paty PB, et al.: Resection of locally recurrent colorectal cancer in the presence of distant metastases: can it be justified? Ann Surg Oncol 2003; 10: 227-233
- Rahbari NN, Ulrich AB, Bruckner T, et al.: Surgery for locally recurrent rectal cancer in the era of total mesorectal excision: is there still a chance for cure? Ann Surg 2011; 253: 522-533
- Chen Y, Li Y, Mo S, et al.: The pattern and treatment outcomes for rectal cancer with concurrent locoregional recurrence and distant metastases after total mesorectal excision. BMC Cancer 2022; 22: 1088
- Vermaas M, Ferenschild FT, Nuyttens JJ, et al.: Preoperative radiotherapy improves outcome in recurrent rectal cancer. Dis Colon Rectum 2005; 48: 918-928
- Holman FA, Bosman SJ, Haddock MG, et al.: Results of a pooled analysis of IOERT containing multimodality treatment for locally recurrent rectal cancer: Results of 565 patients of two major treatment centres. Eur J Surg Oncol 2017; 43: 107-117
- Nordkamp S, Voogt ELK, van Zoggel DMGI, et al.: Locally recurrent rectal cancer: oncological outcomes with different treatment strategies in two tertiary referral units. Br J Surg 2022; 109: 623-631
- Dresen RC, Gosens MJ, Martijn H, et al.: Radical resection after IORT-containing multimodality treatment is the most important determinant for outcome in patients treated for locally recurrent rectal cancer. Ann Surg Oncol 2008; 15: 1937-1947
- Sorrentino L, Belli F, Valvo F, et al.: Neoadjuvant(re)chemoradiation for locally recurrent rectal cancer: Impact of anatomical site of pelvic recurrence on long-term results. Surg Oncol 2020; 35: 89-96
- Haddock MG, Gunderson LL, Nelson H, et al.: Intraoperative irradiation for locally recurrent colorectal cancer in previously irradiated patients. Int J Radiat Oncol Biol Phys 2001; 49: 1267-1274
- Mohiuddin M, Marks G, Marks J: Long-term results of reirradiation for patients with recurrent rectal carcinoma. Cancer 2002; 95: 1144-1150
- Bosman SJ, Holman FA, Nieuwenhuijzen GAP, et al.: Feasibility of reirradiation in the treatment of locally recurrent rectal cancer. Br J Surg 2014; 101: 1280-1289
- Rombouts AJ, Koh CE, Young JM, et al.: Does radiotherapy of the primary rectal cancer affect prognosis after pelvic exenteration for recurrent rectal cancer? Dis Colon Rectum 2015; 58: 65-73
- PelvEx Collaborative: Factors affecting outcomes following pelvic exenteration for locally recurrent rectal cancer. Br J Surg 2018; 105: 650-657
- Nakfoor BM, Willett CG, Shellito PC, et al.: The impact of 5-fluorouracil and intraoperative electron beam radiation therapy on the outcome of patients with locally advanced primary rectal and rectosigmoid cancer. Ann Surg 1998; 228: 194-200
- Gunderson LL, Nelson H, Martenson JA, et al.: Locally advanced primary colorectal cancer: intraoperative electron and external beam irradiation +/- 5-FU. Int J Radiat Oncol Biol Phys 1997; 37: 601-614
- Gunderson LL, Nelson H, Martenson JA, et al.: Intraoperative electron and external beam irradiation with or without 5-fluorouracil and maximum surgical resection for previously unirradiated, locally recurrent colorectal cancer. Dis Colon Rectum 1996; 39: 1379-1395
- Hashiguchi Y, Sekine T, Kato S, et al.: Indicators for surgical resection and intraoperative radiation therapy for pelvic recurrence of colorectal cancer. Dis Colon Rectum 2003; 46: 31-39
- Fahy MR, Kelly ME, Foley MP, et al.: The role of intraoperative radiotherapy in advanced rectal cancer: a meta-analysis. Colorectal Dis 2021; 23: 1998-2006
- van Zoggel DMGI, Bosman SJ, Kusters M, et al.: Preliminary results of a cohort study of induction chemotherapy-based treatment for locally recurrent rectal cancer. Br J Surg 2018; 105: 447-452
- Voogt ELK, van Zoggel DMGI, Kusters M, et al.: Improved Outcomes for Responders After Treatment with Induction Chemotherapy and Chemo(re)irradiation for Locally Recurrent Rectal Cancer. Ann Surg Oncol 2020; 27: 3503-3513
- Yamada S, Kamada T, Ebner DK, et al.: Carbon-Ion Radiation Therapy for Pelvic Recurrence of Rectal Cancer. Int J Radiat Oncol Biol Phys 2016; 96: 93-101.
- Shinoto M, Yamada S, Okamoto M, et al.: Carbon-ion radiotherapy for locally recurrent rectal cancer: Japan Carbon-ion Radiation Oncology Study Group(J-CROS)Study 1404 Rectum. Radiother Oncol 2019; 132: 236-240
- Yamada S, Takiyama H, Isozaki Y, et al.: Carbon Ion Radiotherapy for Locally Recurrent Rectal Cancer of Patients with Prior Pelvic Irradiation. Ann Surg Oncol 2022; 29: 99-106
CQ 15:遠隔転移のない切除不能直腸癌局所再発に対する放射線治療は推奨されるか?
- 腫瘍縮小によりR0切除が可能になると期待される症例に対しては,切除を指向した化学放射線療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:100%)
- 切除が望めない症例において,粒子線治療やX線による高精度放射線治療,小線源治療等を用いた高線量の投与を行うことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:95%)
直腸癌局所再発は放射線治療抵抗性を有する代表的な疾患のひとつであり,根治的外科切除が第一選択となる1,2)。局所再発症例に対する外科的切除と45~54 Gy程度の補助放射線療法を組み合わせた治療を対象として行われた報告2,3)によれば,根治的切除達成群において非達成群と比較して優位に生存率の改善を認めた。したがって,R0切除可能かどうかの境界にあるような症例については,まず切除を指向した化学放射線療法を行うことで腫瘍の縮小を図り,改めて切除可能性について判断することが望ましい3,4)。切除可能性の判断基準や根治的放射線治療の適応判断については各施設間で差異が大きいことから,治療方針についてはあらかじめ各領域担当医の間で十分なディスカッションを経てから決定することが望ましい。
明らかにR0切除が望めないような症例や外科的切除を拒否する症例においては,根治的(化学)放射線治療が選択肢となる。後方視的研究ではあるが,62.5 Gy以上の照射を行った場合に有意に局所制御率が向上し5),総線量中央値66.5 Gyの化学放射線療法により,5年全生存率40.6%,局所制御率55.9%と良好な成績を示した6)。また,優れた線量集中性を有する体幹部定位照射(SBRT)の報告7)によれば,74.8~114.8 Gy相当の照射により4年局所制御率74.3%とさらに良好な成績を示したが,SBRTに関する報告はまだ少なく本邦においても十分な経験と設備を有する施設において探索的に施行されている段階である。小線源治療は最も線量集中性に優れた照射法であり,少数ながらも有用性が報告されているが,その手技に精通した放射線治療医や施設が必要である8)。粒子線治療(重粒子線治療・陽子線治療)については,手術による根治的な治療が困難である局所再発大腸癌に対し,2022年4月から保険適用となったが,2022年10月の時点で稼働している本邦の粒子線治療施設は25か所(重粒子線:6か所,陽子線:18か所,両方:1か所)と少ない。保険適用の根拠となった報告9)では,粒子線治療全体による3年生存率81.8%,3年局所制御率76.4%と良好な成績を示し,一般的なX線治療に関する文献報告と比較して粒子線治療の成績が良好である可能性が示唆された。陽子線治療の報告は少ないが,81.2 Gy相当(一部化学療法併用)の照射を行い,3年全生存率71%,局所制御率80%であった10)。重粒子線治療は線量増加試験の結果11)から84.5~89.5 Gy相当の治療が行われており,多施設後方視的な成績報告によれば12)重粒子線治療後の5年全生存率51%,局所制御率88%であった。重粒子線に関しては本邦で多施設前向き試験が進行中であり今後エビデンスレベルの高い報告が期待される。
いずれの報告でも有害事象発生の頻度については臨床上の許容範囲内と考えられた。X線による高精度放射線治療・陽子線治療・重粒子線治療の成績を直接比較した報告はなく,かつ,治療法によって患者・腫瘍背景が異なるため,治療法別の推奨度について議論できるほどのエビデンスはない。したがって,照射の適応と照射法(粒子線治療やX線による高精度放射線治療等)の選択については,期待される効果と予測される有害事象をふまえて,十分な経験を有する放射線治療医を交えて判断されることが望ましい。
なお,骨盤部への照射歴を有する局所再発症例への再照射は,リスク臓器の耐容線量内で再発巣へ高線量を投与することが困難なこともあり,実施しない施設も多い。腫瘍やリスク臓器の位置関係,前回の照射範囲等をもとに高線量の再照射が行われることがあるが,設備・スタッフとバックアップ体制などが整った限定的な施設に限られる。X線による高精度放射線治療や重粒子線治療の報告によれば3年全生存率は37~61%と比較的良好であったが,有害事象の発生頻度は21~37%と高かったことに注意すべきである13-17)。なお,リスク臓器への線量低減を図りつつ腫瘍に高線量を投与する目的で,放射線治療に先行してスペーサーを腫瘍とリスク臓器の間に挿入することがある12,17)。患者の全身状態や,骨盤内の腫瘍や癒着の状況,期待される生命予後などを十分に考慮した上で,安全にスペーサー挿入が行えると判断される場合においては検討することが可能である。
(注:本CQ中のGy表記は,いずれもEquivalent Dose in 2 Gy fraction:2 Gy換算等価線量に換算したものである)
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ15-① | 0% | 100%(23/23) | 0% | 0% | 0% |
| CQ15-② | 0% | 95%(21/22) | 0% | 0% | 5%(1/22) |
文献
- Hagemans JAW, van Rees JM, Alberda WJ, et al.: Locally recurrent rectal cancer; long-term outcome of curative surgical and non-surgical treatment of 447 consecutive patients in a tertiary referral centre. Eur J Surg Oncol 2020; 46: 448-454
- Hahnloser D, Nelson H, Gunderson LL, et al.: Curative potential of multimodality therapy for locally recurrent rectal cancer. Ann Surg 2003; 237: 502-508
- Lee J, Kim CY, Koom WS, et al.: Practical effectiveness of re-irradiation with or without surgery for locoregional recurrence of rectal cancer: A meta-analysis and systematic review. Radiother Oncol 2019; 140: 10-19
- Guren MG, Undseth C, Rekstad BL, et al.: Reirradiation of locally recurrent rectal cancer: a systematic review. Radiother Oncol 2014; 113: 151-157.
- Tanaka H, Yamaguchi T, Hachiya K, et al.: Radiotherapy for locally recurrent rectal cancer treated with surgery alone as the initial treatment. Radiat Oncol J 2017; 35: 71-77
- Lee JH, Kim DY, Kim SY, et al.: Clinical outcomes of chemoradiotherapy for locally recurrent rectal cancer. Radiat Oncol 2011; 6: 51
- Kim MS, Choi C, Yoo S, et al.: Stereotactic body radiation therapy in patients with pelvic recurrence from rectal carcinoma. Jpn J Clin Oncol 2008; 38: 695-700
- Kuehne J, Kleisli T, Biernacki P, et al.: Use of high-dose-rate brachytherapy in the management of locally recurrent rectal cancer. Dis Colon Rectum 2003; 46: 895-899
- Murayama S, Yamada S, Hiroshima Y, et al.: Particle beam therapy for pelvic recurrence of colorectal cancer: a registry data analysis in Japan and a systematic review. J Radiat Res 2023; 64(Supplement_1): i25-i33
- Hiroshima Y, Ishikawa H, Murakami M, et al.: Proton Beam Therapy for Local Recurrence of Rectal Cancer. Anticancer Res 2021; 41: 3589-3595
- Yamada S, Kamada T, Ebner DK, et al.; Working Group on Locally Recurrent Rectal Cancer: Carbon-Ion Radiation Therapy for Pelvic Recurrence of Rectal Cancer. Int J Radiat Oncol Biol Phys 2016; 96: 93-101
- Shinoto M, Yamada S, Okamoto M, et al.: Carbon-ion radiotherapy for locally recurrent rectal cancer: Japan Carbon-ion Radiation Oncology Study Group(J-CROS)Study 1404 Rectum. Radiother Oncol 2019; 132: 236-240
- Cai G, Zhu J, Palmer J, et al.: CAPIRI-IMRT: a phase Ⅱ study of concurrent capecitabine and irinotecan with intensity-modulated radiation therapy for the treatment of recurrent rectal cancer. Radiat Oncol 2015; 10: 57
- Hu JB, Sun XN, Yang QC, et al.: Three-dimensional conformal radiotherapy combined with FOLFOX4 chemotherapy for unresectable recurrent rectal cancer. World J Gastroenterol 2006; 12: 2610-2614
- Dagoglu N, Mahadevan A, Nedea E, et al.: Stereotactic body radiotherapy(SBRT)reirradiation for pelvic recurrence from colorectal cancer. J Surg Oncol 2015; 111: 478-482
- Defoe SG, Bernard ME, Rwigema JC, et al.: Stereotactic body radiotherapy for the treatment of presacral recurrences from rectal cancers. J Cancer Res Ther 2011; 7: 408-411
- Yamada S, Takiyama H, Isozaki Y, et al.; Working Group on Locally Recurrent Rectal Cancer: Carbon Ion Radiotherapy for Locally Recurrent Rectal Cancer of Patients with Prior Pelvic Irradiation. Ann Surg Oncol 2022; 29: 99-106
CQ 16:薬物療法が奏効して画像上消失した肝転移巣の切除は推奨されるか?
薬物療法にて造影CT上消失した肝転移巣に対しては,術前にEOB-MRIを併施し,術中は造影超音波を用いて病変を同定し,切除することを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:43%)
化学療法後に大腸癌肝転移巣の5~25%が造影CT上同定されなくなることがあり1,2),化学療法後に画像診断で確認できなくなった病変はdisappearing liver metastasis(DLM)と呼ばれている。目下,DLMに対する最適な治療方法についてはコンセンサスが得られているとはいえない。
DLMを生じやすい条件として,腫瘍径2 cm未満,化学療法回数の増加,oxaliplatinを用いた化学療法,腫瘍数3個以上,同時性肝転移が挙げられる1,2)。ただし,画像上の完全奏効が認められたとしても,病理学的な完全奏効(CPR:complete pathological response)が常に得られているわけではなく3),DLMの34~83%ではがん細胞が生存しているとされる4-6)。これらのDLMは,術前あるいは術中の同定が困難であり,すでに薬物療法が著効したDLMを切除する腫瘍学的な意義は不明であり,DLMをどこまで切除すべきかについては様々な見解がある。
現在のところ,DLMの治療報告は単独施設で行われた後方視的観察研究に限られている。DLMといえども生存がん細胞が存在している確率が高率のため,ethoxybenzyl diethylenetriamine penta-acetic acid-enhanced magnetic resonance imaging(EOB-MRI)やcontrast-enhanced intraoperative ultrasonography(CE-IOUS,術中造影超音波検査)を用いた積極的な切除が報告されている。CE-IOUSは通常のIOUSでは同定できない腫瘍を高率に同定できるため,特に化学療法後の転移性肝がんの切除では,最終的な画像診断法となる7)。
造影CTでは同定できなくなった59人の患者の275個のDLMのうち,EOB-MRIで同定して切除できたのは26%で,そのうち92%に生存癌細胞がみられたとする報告がある6)。さらにCE-IOUSを用いると造影CTで同定できなくなったDLMの60%が指摘され,切除したDLMの77%に生存癌細胞がみられた。一方,EOB-MRIでもCE-IOUSでも同定されなかったが切除されたDLMの4%に生存癌細胞がみられ,切除しなかったDLMのうち14%が再発した。総じて,EOB-MRIでもCE-IOUSでも同定されないDLMが生存癌細胞を含む割合は8%だった。この結果から,EOB-MRIとCE-IOUSを用いたDLMの検索と切除の重要性が示唆される6)。
また,20人の患者に同定された111個のDLMに対して,EOB-MRIとCE-IOUSを用いた検証では,切除病変での癌の残存や非切除病変の再増大が見られた病変の割合は,EOB-MRIとCE-IOUSで同定された病変では100%に,EOB-MRIで同定できたがCE-IOUSでは同定できず非切除した病変では71%,EOB-MRIで同定されないがCE-IOUSで同定した病変では15%,EOB-MRIでもCE-IOUSでも同定されない病変では7%であった8)。
以上の報告のように,EOB-MRIとCE-IOUSを用いても定されないDLMに癌細胞が生存している確率は10%未満と推測される。画像では同定できないDLMに対して,化学療法前の腫瘍存在領域を参考にして腫瘍の位置を予測して切除する方法もある。しかし,この方法では切除範囲が広くなり,肝切除の付加による出血量の増加,手術時間の延長,胆汁漏や肝不全などの合併症の増加を伴うことが予想される。また,大腸癌肝転移に対する肝切除後の再発率は70%と高率であり,残肝容量を極力温存するためにCE-IOUSを駆使した部分切除が望ましい9,10)。したがって,造影CT,EOB-MRI,CE-IOUSの3つの画像検査でも同定できない腫瘍を,化学療法前の腫瘍位置を予想して積極的に切除するべきとは言いがたい。
米国やフランスでは,薬物療法前にコイルや金のマーカーを留置した後に切除する試みも行われている11,12)。薬物療法前の腫瘍径が20 mm未満で,深度1 cm以上の肝転移巣19個にマーキングを行った。薬物療法後にこれらの腫瘍の46%が画像上消失したが,マーキングを頼りに切除やラジオ波焼灼を行った。結果的に,化学療法によるCPRの割合は29%と算出された9)。
切除せずに経過を観察した場合,再増大したDLMに対しては再切除,薬物療法,薬物療法後の切除13)などの選択肢が存在する。ただし,化学療法の発達した現在でも,治癒を得るためには肝切除による腫瘍の切除は重要であり,画像上同定可能な再発腫瘍に対しては積極的な切除が望ましい14)。薬物療法が奏効して画像上消失した大腸癌肝転移病変に対する,DW-MRIの術前診断能の妥当性に関する日欧共同の観察研究(DREAM study,JCOG1609INT)が2016年に開始された。解析に必要な199個のDLMが登録されたため2021年3月に登録終了となり,2023年度末に主たる解析が予定されている。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ16 | 57%(13/23) | 43%(10/23) | 0% | 0% | 0% |
文献
- van Vledder MG, de Jong MC, Pawlik TM, et al.: Disappearing colorectal liver metastases after chemotherapy: should we be concerned? J Gastrointest Surg 2010; 14: 1691-1700
- Tsilimigras DI, Ntanasis-Stathopoulos I, Paredes AZ, et al.: Disappearing liver metastases: A systematic review of the current evidence. Surg oncol 2019; 29: 7-13
- Adam R, Wicherts DA, de Haas RJ, et al.: Complete pathologic response after preoperative chemotherapy for colorectal liver metastases: myth or reality? J Clin Oncol 2008; 26: 1635-1641
- Auer RC, White RR, Kemeny NE, et al.: Predictors of a true complete response among disappearing liver metastases from colorectal cancer after chemotherapy. Cancer 2010; 116: 1502-1509
- Benoist S, Brouquet A, Penna C, et al.: Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol 2006; 24: 3939-3945
- Oba A, Mise Y, Ito H, et al.: Clinical implications of disappearing colorectal liver metastases have changed in the era of hepatocyte-specific MRI and contrast-enhanced intraoperative ultrasonography. HPB(Oxford)2018; 20: 708-714
- Arita J, Ono Y, Takahashi M, et al.: Usefulness of contrast-enhanced intraoperative ultrasound in identifying disappearing liver metastases from colorectal carcinoma after chemotherapy. Ann Surg Oncol 2014; 21 Suppl 3: S390-S397
- Tani K, Shindoh J, Akamatsu N, et al.: Management of disappearing lesions after chemotherapy for colorectal liver metastases: Relation between detectability and residual tumors. J Surg Oncol 2018; 117: 191-197
- Kokudo N, Tada K, Seki M, et al.: Anatomical major resection versus nonanatomical limited resection for liver metastases from colorectal carcinoma. Am J Surg 2001; 181: 153-159
- Mise Y, Aloia TA, Brudvik KW, et al.: Parenchymal-sparing hepatectomy in colorectal liver metastasis improves salvageability and survival. Ann Surg 2016; 263: 146-152
- Passot G, Odisio BC, Zorzi D, et al.: Eradication of Missing Liver Metastases After Fiducial Placement. J Gastrointest Surg 2016; 20: 1173-1178
- Kepenekian V, Muller A, Valette PJ, et al.: Evaluation of a strategy using pretherapeutic fiducial marker placement to avoid missing liver metastases. BJS open 2019; 3: 344-353
- Goèré D, Gaujoux S, Deschamp F, et al.: Patients operated on for initially unresectable colorectal liver metastases with missing metastases experience a favorable long-term outcome. Ann surg 2011; 254: 114-118
- Oba M, Hasegawa K, Matsuyama Y, et al.: Discrepancy between recurrence-free survival and overall survival in patients with resectable colorectal liver metastases: a potential surrogate endpoint for time to surgical failure. Ann Surg Oncol 2014; 21: 1817-1824
CQ 17:大腸癌肝転移に対する低侵襲手術は推奨されるか?
- 腹腔鏡下肝切除の短期予後および長期予後は開腹肝切除に比較して同等ないし良好であるため,安全性や適応を十分に考慮した上で行うことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:100%)
- 一方,ロボット支援肝切除の安全性や有効性については,不明点が多い。(推奨度なし・エビデンスレベルD,合意率:83%)
日本のNational Clinical Databaseの集計によれば,2011年から2017年の6年間に施行された腹腔鏡下肝切除(LLR:laparoscopic liver resection)は27,146件で,24.8%の肝切除が腹腔鏡下に行われている。2011年では9.9%であり,LLRの普及は急速に進んでいる。特に,肝部分切除,区域切除,外側区域切除という基本的な術式では30.8%に腹腔鏡が用いられている。死亡率は1.0%で,開腹肝切除(OLR:open liver resection)では2.0%である1)。
大腸癌肝転移を含めた肝腫瘍に対する肝切除において,LLRとOLRの成績を比較した単施設2-4),多施設共同5-8)の後方視的研究やランダム化比較試験9-12),システマティックレビュー13,14)が報告されている。その多くは,出血量や術後合併症,在院期間を減少させるが,R0切除率,全生存期間や無再発生存期間は同等である,とするものである。
スペインで2005~2016年に193例の大腸癌肝転移患者を96例のLLR群と97例のOLR群に振り分け,合併症率を主要評価項目としたランダム化比較試験が行われた(LapOpHuva)9)。結果的に,合併症率はLLRで有意に低率(11.5% vs. 23.7%,p=0.025)で,在院期間の短縮も認められた(4日vs. 6日,p<0.001)が,手術時間,出血量,R0切除割合,無再発生存期間や全生存期間には有意差を認めなかった。ノルウェーでは2012~2016年に280名の大腸癌肝転移患者を133例のLLR群と147例のOLRに振り分け,術後30日以内の合併症率を主要評価項目としたランダム化比較試験(OSLO-COMET)10)が行われた。短期成績はLapOpHuva試験の結果とほぼ同様であった。術後の生活の質をHRQoLという8領域に渡る評価票で比較したところ,術後1カ月では4領域,4カ月では1領域においてLLR群で生活の質は良好だった11)。一方,無再発生存期間や全生存期間には有意差を認めなかった12)。このように,欧州で行われた2つのランダム化比較試験は同様の結果を示した。LLRではOLRに比較して術後補助療法の導入を早めることができるとする報告もある15)が,補助療法の早期導入が予後に与える影響は不明である。
LLRを安全に導入するための基準が報告されており,Iwate criteria16),IMM criteria17),Hasegawa criteria18)が代表的である。適応基準を施設ごとに十分に検討し,安全性に留意するならば,LLRでは,長期予後を損なうことなく,OLRと同等ないし良好な短期予後を期待できる。安全な施行が可能な適応において,LLRでの大腸癌肝転移の切除は推奨される。
一方,ロボット支援肝切除についても,単施設19)あるいは多施設7,8,20)からの報告が散見されるが,その数は十分とはいえず,未だロボット支援肝切除の方法は標準化されているとはいえない。ロボット支援肝切除では,LLRに比較して用いることのできる鉗子の数が1本少なく,助手の鉗子の操作はロボットアームが存在するために自由度に制限がある。また,LLRで汎用する超音波切開凝固装置がない,肝臓の展開が困難である,などの不具合もある。ロボット支援肝切除はLLRに比較して十分な安全性や汎用性が認められているとは言えず,現時点では先進的なアプローチ方法であり,限られた施設で行われるべきである。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ17-① | 0% | 100%(23/23) | 0% | 0% | 0% |
| CQ17-② | 0% | 13%(3/23) | 0% | 4%(1/23) | 83%(19/23) |
文献
- Ban D, Tanabe M, Kumamaru H, et al.: Safe dissemination of laparoscopic liver resection in 27,146 cases between 2011 and 2017 from the National Clinical Database of Japan. Ann Surg 2021; 274: 1043-1050
- Aghayan DL, Kazaryan AM, Fretland AA, et al.: Evolution of laparoscopic liver surgery: 20-year experience of a Norwegian high-volume referral center. Surg Endosc 2022; 36: 2818-2816
- Shin JK, Kim HC, Lee WY, et al.: Comparative study of laparoscopic versus open technique for simultaneous resection of colorectal cancer and liver metastases with propensity score analysis. Surg Endosc 2020; 34: 4772-4780
- 大村仁昭,武田 裕,桂 宜輝,他: 大腸癌肝転移に対する腹腔鏡下肝切除術の検討.癌と化学療法2022; 49: 1835-1837
- Beppu T, Wakabayashi G, Hasegawa K, et al.: Long-term and perioperative outcomes of laparoscopic versus open liver resection for colorectal liver metastases with propensity score matching: a multi-institutional Japanese study. J Hepatobiliary Pancreat Sci 2015; 22: 711-720
- Cacciaguerra AB, Görgec B, Cipriani F, et al.: Risk Factors of Positive Resection Margin in Laparoscopic and Open Liver Surgery for Colorectal Liver Metastases: A New Perspective in the Perioperative Assessment: A European Multicenter Study. Ann Surg 2022; 275: e213-e221
- Gumbs AA, Lorenz E, Tsai TJ, et al.: Study: international multicentric minimally invasive liver resection for colorectal liver metastases(SIMMILR-CRLM). Cancers(Basel)2022; 14: 1379
- Gumbs AA, Croner R, Lorenz E, et al.: Survival study: international multicentric minimally invasive liver resection for colorectal liver metastases(SIMMILR-2). Cancers(Basel)2022; 14: 4190
- Robles-Campos R, Lopez-Lopez V, Brusadin R, et al.: Open vesus minimally invasive liver surgery for colorectal liver metastases(LapOpHuva): a prospective randomized controlled trial. Surg Endosc 2019; 33: 3926-3936
- Fretland ÅA, Dagenborg VJ, Bjørnelv GMW, et al.: Laparoscopic Versus Open Resection for Colorectal Liver Metastases: The OSLO-COMET Randomized Controlled Trial. Ann Surg 2018; 267: 199-207
- Fretland ÅA, Dagenborg VJ, Bjørnelv GMW, et al.: Quality of life from a randomized trial of laparoscopic or open liver resection for colorectal liver metastases. Br J Surg 2019; 106: 1372-1380
- Aghayan DL, Kazaryan AM, Dagenborg VJ, et al.: Long-Term Oncologic Outcomes After Laparoscopic Versus Open Resection for Colorectal Liver Metastases: A Randomized Trial. Ann Intern Med 2021; 174: 175-182
- Alvikas J, Lo W, Tohme S, et al.: Outcomes and patient selection in laparoscopic vs. open liver resection for HCC and colorectal cancer liver metastasis. Cancers(Basel)2023; 15: 1179
- Chen Y, Zhang L, Li H, et al.: Laparoscopic versus open liver resection for colorectal liver metastases: a systemic review. J Surg Res 2017; 220: 234-246
- Kawai T, Goumard C, Jeune F, et al.: Laparoscopic liver resection for colorectal liver metastasis patients allows patients to start adjuvant chemotherapy without delay: a propensity score analysis. Surg Endosc 2018; 32: 3273-3281
- Ban D, Tanabe M, Ito H, et al.: A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci 2014; 21: 745-753
- Kawaguchi Y, Fuks D, Kokudo N, et al.: Difficulty of Laparoscopic Liver Resection: Proposal for a New Classification.. Ann Surg 2018; 267: 13-17
- Hasegawa Y, Wakabayashi G, Nitta H, et al.: A novel model for prediction of pure laparoscopic liver resection surgical difficulty. Surg Endosc 2017; 31: 5356-5363
- Kato Y, Sugioka S, Kojima M, et al.: Initial experience with robotic liver resection: Audit of 120 consecutive cases at a single center and comparison with open and laparoscopic approaches. J Hepatobiliary Pancreat Sci 2023; 30: 72-90
- Guerra F, Guadagni S, Pesi B, et al.: Outcomes of robotic liver resections for colorectal liver metastases. A multi-institutional analysis of minimally invasive ultrasound-guided robotic surgery. Surg Oncol 2019; 28: 14-18
CQ 18:肝転移巣に対する熱凝固療法は推奨されるか?
- 切除可能な大腸癌肝転移巣に対しては肝切除が標準療法であり,熱凝固療法を第一選択とはしないことを強く推奨する。(推奨度1・エビデンスレベルC,合意率:91%)
- 完全な切除が不能な多発肝転移巣に対する薬物療法や肝切除と熱凝固療法の併用を弱く推奨する。(推奨度2・エビデンスレベルD,合意率:78%)
肝腫瘍に対する熱凝固療法では,ラジオ波焼灼療法(RFA:radiofrequency ablation)やマイクロ波凝固療法(MWA:microwave ablation therapyやMCT:microwave coagulation therapy)が用いられている。大腸癌肝転移病変は腺癌が主体で,肝細胞癌と異なり,熱凝固療法後の局所再発率は高率であるが,最近10年以内の報告では5.1~32.0%と改善してきている1-9)。肝切除施行後の局所再発率は3~12%1-3)であり,局所制御能は肝切除が熱凝固療法を明らかに上回っている。大腸癌肝転移に対する肝切除と熱凝固療法を比較したシステマティックレビューやメタ解析論文では,局所再発率は肝切除で有意に低く,無再発生存率や全生存率も肝切除が良好であるとされている1,10-13)。したがって,切除可能な大腸癌肝転移には肝切除が第一選択となる。ただし,切除とRFAでは前者で合併症率が高率10,12,14)で,入院期間が長期であること14)は留意しなければならない。
両葉多発肝転移巣に対して,手術による過大侵襲を避ける目的で,一部の腫瘍にはRFAを施行する治療の成績が海外で報告されている。肝切除の技術がしっかりと確立された施設での切除+RFA併用群と切除単独群の比較では,切除+RFA群の局所再発率が29%と高率であったにも関わらず,化学療法などの集学的治療を含めれば,無再発生存率や全生存率に有意差を認めなかった2)。同様の報告は他にも認められている3,15-17)。大腸癌肝転移に対する肝切除では,70%以上とされる高い残肝再発率が予想されるため,系統的切除よりも残肝を温存した部分切除が望ましく18,19),特に両葉多発の肝転移に対する肝切除では,一度の肝切除による腫瘍の完全切除が必ずしも最終目標ではなく,再肝切除や集学的治療も視野に入れた戦略が必要となる。病変の全切除は困難であると判断された場合に,肝切除と術中RFAを組みあわせた治療は選択肢のひとつとなる。
また,欧州の大腸癌治療における国際グループで行った第Ⅱ相ランダム化比較試験では,切除不能大腸癌肝転移に対してFOLFOXとbevacizumabをベースにした薬物療法にRFAを併用した上乗せ効果を検証した。RFA併用60例と化学療法単独59例の5年生存率は43.1% vs. 30.3%で,RFA併用群が有意に良好で,無増悪生存期間でも良好だった20)。結果的に,切除不能大腸癌肝転移に対する化学療法とRFAの併用療法の効果が示された。また,欧州では,3 cm未満で10個以下の大腸癌肝転移に対して,全生存期間を主要評価項目とした肝切除と熱凝固療法のランダム化比較試験(COLLISION)が進行中である。また,イギリスとオランダ共同の非劣性ランダム化比較試験で,肝切除群に対する熱凝固療法の非劣性を検証する試験(LAVA)も進行中である21)。すでにスウェーデンで施行された3 cm未満の大腸癌肝転移巣に対して,切除(n=53)とMWA(n=52)を比較する準ランダム化比較試験(MAVERRIC trial)の結果では,切除群で合併症率が高く,入院期間が長く,治療費は高額であるが,5年生存率は切除群で54%,MWA群で50%(p=0.95)という結果も得られている14)。
熱凝固対象とする転移巣の腫瘍径については十分留意しなければならない。一般には3 cm未満が適応だが,局所再発率を低率にするには,2 cm未満に制限することも考慮される。18 mmあるいは20 mmを超えると局所再発率が上昇するとする報告がある22,23)。化学療法前には25 mmを超えていたが,化学療法後に縮小して25 mm未満となった病変に対するRFA後の局所再発率は64%と高率で,化学療法前から25 mm未満だった症例の16%や25 mmを超えていた症例の32%と比較しても高率だったことから,化療後に縮小した病変に対するRFAは禁忌であるとする報告もある6)。
同じ熱凝固療法でも,RFAとMWAの比較では,後者で焼灼時間が短時間で,局所再発率も低率であるとする報告がある8,9)。一方,両群で局所再発率や生存率に有意差をみとめていないとする最近の報告もあり5),最適な熱凝固療法の選択は施設ごとに異なっている。一般にRFAの適応や技術には施設間格差が大きく,局所再発率も高率なために一様に許容できるものではない。しかし,充分な技術力のある施設での,切除不能大腸癌肝転移に対するRFAと肝切除,また,RFAと化学療法の併用療法は,許容されると考えられる。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ18-① | 0% | 4%(1/23) | 4%(1/23) | 91%(21/23) | 0% |
| CQ18-② | 0% | 78%(18/23) | 9%(2/23) | 0% | 13%(3/23) |
文献
- Mao R, Zhao JJ, Bi XY, et al.: Resectable recurrent colorectal liver metastasis: can radiofrequency ablation replace repeated metastatectomy? ANZ J Surg 2019; 89: 908-913
- Imai K, Allard MA, Castro Benitez C, et al.: Long-term outcomes of radiofrequency ablation combined with hepatectomy compared with hepatectomy alone for colorectal liver metastases. Br J Surg 2017; 104: 570-579
- Lee BC, Lee HG, Park IJ, et al.: The role of radiofrequency ablation for treatment of metachronous isolated hepatic metastasis from colorectal cancer. Medicine(Baltimore). 2016; 95: e49999
- De Cobelli F, Calandri M, Della-Corte A, et al.: Multi-institutional analysis of outcomes for thermosphere microwave ablation treatment of colorectal liver metastases: the SMAC study. Erur Radiol 2022; 32: 4147-4159
- Krul MF, Gerritsen SL, Vissers FL, et al.: Radiofrequency versus microwave ablation for intraoperative treatment of colorectal liver metastases. Eur J Surg Oncol 2022; 48: 834-840
- Benhaim L, El Hajjam M, Malafosse R, et al.: Radiofrequency ablation for colorectal cancer liver metastases initially greater than 25 mm but downsized by neo-adjuvant chemotherapy is associated with increased rate of local tumor progression. HPB 2018; 20: 76-82
- Aksoy E, Aliyev S, Taskin HE, et al.: Clinical scenarios associated with local recurrence after laparoscopic radiofrequency thermal ablation of colorectal liver metastases. Surgery 2013; 154: 748-752; discussion 752-4.
- Takahashi H, Kahramangil B, Kose E, et al.: A comparison of microwave thermosphere versus radiofrequency thermal ablation in the treatment of colorectal liver metastases. HPB(Oxford)2018; 20: 1157-1162
- Correa-Gallego C, Fong Y, Gonen M, et al.: A retrospective comparison of microwave ablation vs. radiofrequency ablation for colorectal cancer hepatic metastases. Ann Surg Oncol 2014; 21: 4278-4283
- van Amerongen MJ, Jenniskens SFM, van den Boezem PB, et al.: Radiofrequency ablation compared to surgical resection for curative treatment of patients with colorectal liver metastases―a meta-analysis. HPB(Oxford)2017; 19: 749-756
- Di Martino M, Rompianesi G, Mora-Guzmán I, et al.: Systematic review and meta-analysis of local ablative therapies for resectable colorectal liver metastases. Eur J Surg Oncol 2020; 46: 772-781
- Meijerink MR, PuijkRS, van Tiborg AAJM, et al.: Radiofrequency and Microwave Ablation Compared to Systemic Chemotherapy and to Partial Hepatectomy in the Treatment of Colorectal Liver Metastases: A Systematic Review and Meta-Analysis. Canriovac Intervent Radiol 2018; 41: 1189-1204
- Yang G, Wang G, Sun J, et al.: The prognosis of radiofrequency ablation versus hepatic resection for patients with colorectal liver metastases: A systemic review and meta-analysis based on 22 studies. Int J Surg 2021; 87: 105896
- Triguely P, Laurell G, Enander A, et al.: Ablation versus resection for resectable colorectal liver metastases―health care related cost and survival analysis from a quasi-randomised study. Eur J Surg Oncol 2023; 49: 416-425
- van Amerongen MJ, van der Stok EP, Futterer JJ, et al.: Short term and long term results of patients with colorectal liver metastases undergoing surgery with or without radiofrequency ablation. Eur J Surg Oncol 2016; 42: 523-530
- Karanicolas PJ, Jarnagin WR, Gonen M, et al.: Long-term outcomes following tumor ablation for treatment of bilateral colorectal liver metastases. JAMA Surg 2013; 148: 597-601
- Liu M, Wnag K, Wang Y, et al.: Shor- and long-term outcomes of hepatectomy combined with intraoperative radiofrequency ablation for patients with multiple primarily unresectable colorectal liver metastases: a propensity matching analysis. HPB(Oxford)2021; 23: 1586-1594
- Kokudo N, Tada K, Seki M, et al.: Anatomical major resection versus nonanatomical limited resection for liver metastases from colorectal carcinoma. Am J Surg 2001; 181: 153-159
- Mise Y, Aloia TA, Brudvik KW, et al.: Parenchymal-sparing Hepatectomy in Colorectal Liver Metastasis Improves Salvageability and Survival. Ann Surg 2016; 263: 146-152
- Ruers T, van Coevorden F, Punt CJA, et al.: Local Treatment of Unresectable Colorectal Liver Metastases: Results of a Randomized Phase Ⅱ Trial. J Natl Cancer Inst 2017; 109: djx015
- Gurusamy K, Corrigan N, Croft J, et al.: Liver resection surgery versus thermal ablation for colorectal liver metastases(LAVA): study protocol for a randomized controlled trial. Trials 2018; 19: 105
- 大和田善之,村田幸平,三上恒治,他: 大腸癌肝転移に対する全身化学療法後ラジオ波焼灼療法(RFA)の有効性.癌と化学療法2013; 40: 1984-1986.
- 中島隆善,相原 司,生田真一,他: 大腸癌肝転移に対する経皮的ラジオ波焼灼療法.癌と化学療法2018; 45: 1791-1793
CQ 19:切除可能な肝転移に対する術前化学療法は推奨されるか?
切除可能な肝転移に対する術前化学療法は行わないことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:91%)
切除可能肝転移に対する最も有効な治療法は外科的切除である。しかし根治切除後の残肝再発率も依然高く,より一層の予後改善を目的とした集学的治療が求められている。
肝転移切除を考慮する際には,「技術的な切除可能性」つまり重要脈管温存,残肝容量を考慮した評価により切除の可能性を判断することに加え,「腫瘍学的な切除可能性」つまり原発巣部位,肝転移個数,肝転移最大径,同時異時性肝転移,腫瘍マーカー,RAS,BRAF遺伝子変異(CQ 9参照)などの肉眼的な根治性以外の悪性度も考慮することが求められる1-7)。ただし,切除の可能性は施設ごとに大きく異なり,外科医,内科医,放射線科医など多職種チーム(MDT:multi-disciplinary team)で検討し最終的な切除可能肝転移診断を行うことが望ましい8)。
切除可能肝転移症例に対する術前化学療法の利点は,腫瘍縮小による肝切除量の減少による残肝量の確保9,10)や切除断端の確保,画像上とらえきれない微小転移巣の治療9,10),薬物療法の奏効判定から術後の補助療法を行う際の参考にすることができる10),悪性度の高い肝転移に対する手術回避10,11)が挙げられる。一方,欠点は非奏効例では腫瘍増大による肝転移切除の機会を失う可能性がある9,10),抗がん剤による肝機能障害や周術期合併症・死亡割合の増加10),化学療法によって消失した肝転移巣の切除が困難となり腫瘍を取り残す可能性がある10)ことである。これまでに切除可能肝転移に対して,術前化学療法が手術単独に比べ生存率を改善したというエビデンスはない。現在,技術的に切除は可能であるが,腫瘍学的には早期再発が想定される症例に対する術前化学療法後の有用性については,臨床試験として探索中である12-14)。
一方,肝転移切除の術前および術後の周術期化学療法に関してはEORTC40983試験15,16),New EPOC試験17,18)の2つの第Ⅲ相試験が行われた。EORTC40983試験は,切除可能な肝転移(最大4個)を有する364症例を,手術単独もしくは手術前後にFOLFOX4を6サイクルずつ行う群に無作為に割り付けて検証された。周術期にFOLFOX4を行うことで,手術単独に比べて主評価項目である無増悪生存期間は有意に延長したが,最終的に生存率を改善することはできなかった15,16)。New EPOC試験17,18)では,切除可能または切除可能境界領域の肝転移を有するKRASエクソン2野生型大腸癌患者を肝転移の切除前後に化学療法(oxaliplatin+fluorouracil, oxaliplatin+capecitabine, irinotecan+fluorouracil)にcetuximabを併用する群と併用しない群に無作為化,比較検証された。Cetuximabによる治療が奏効した患者数が多かったにもかかわらず,中間解析でPFSに悪い影響が認められたため試験は中止され,最終的にcetuximab投与群でOSが26カ月短縮した。
これらの臨床試験結果を踏まえ,NCCNガイドラインやESMOガイドラインでは肝切除±術後化学療法とともに周術期化学療法(術前+術後)も提案されているが,術前化学療法のみ行うことは推奨されていない。切除可能な肝転移に対して術前化学療法と周術期化学療法を比較検討したエビデンスは存在しない9,19)。周術期化学療法の基本レジメンはFOLFOXもしくはCAPOXであり,抗EGFR抗体薬は使用すべきではない17,18)。また,薬剤に起因する肝機能障害を考慮し,術前治療期間は2~3カ月に留める20)。先に述べた技術的および腫瘍学的な切除の可能性をより高めるために,実臨床として術前化学療法は行われることがあるが,MDTで検討し慎重に治療選択を行っていくことが重要である。
以上より,切除可能な肝転移に対する術前化学療法は行わないことを弱く推奨する。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ19 | 0% | 9%(2/23) | 91%(21/23) | 0% | 0% |
文献
- Yamashita S, Brudvik KW, Kopetz SE, et al.: Embryonic Origin of Primary Colon Cancer Predicts Pathologic Response and Survival in Patients Undergoing Resection for Colon Cancer Liver Metastases. Ann Surg 2018; 267: 514-520
- Margonis GA, Buettner S, Andreatos N, et al.: Association of BRAF Mutations With Survival and Recurrence in Surgically Treated Patients With Metastatic Colorectal Liver Cancer. JAMA Surg 2018; 153: e180996.
- Brudvik KW, Jones RP, Giuliante F, et al.: RAS Mutation Clinical Risk Score to Predict Survival After Resection of Colorectal Liver Metastases. Ann Surg 2019; 269: 120-126
- Passot G, Denbo JW, Yamashita S, et al.: Is hepatectomy justified for patients with RAS mutant colorectal liver metastases? An analysis of 524 patients undergoing curative liver resection. Surgery 2017; 161: 332-340
- Sasaki K, Morioka D, Conci S, et al.: The Tumor Burden Score: A New“Metro-ticket”Prognostic Tool For Colorectal Liver Metastases Based on Tumor Size and Number of Tumors. Ann Surg 2018; 267: 132-141
- Vauthey JN, Zimmitti G, Kopetz SE, et al.: RAS mutation status predicts survival and patterns of recurrence in patients undergoing hepatectomy for colorectal liver metastases. Ann Surg 2013; 258: 619-626; discussion 626-627
- Gagnière J, Dupré A, Gholami SS, et al.: Is Hepatectomy Justified for BRAF Mutant Colorectal Liver Metastases?: A Multi-institutional Analysis of 1497 Patients. Ann Surg 2020; 271: 147-154
- Pawlik TM, Choti MA: Surgical therapy for colorectal metastases to the liver. J Gastrointest Surg 2007; 11: 1057-1077
- Kawaguchi Y, Vauthey JN: The Landmark Series: Randomized Control Trials Examining Perioperative Chemotherapy and Postoperative Adjuvant Chemotherapy for Resectable Colorectal Liver Metastasis. Ann Surg Oncol 2020; 27: 4263-4270
- Mattar RE, Al-Alem F, Simoneau E, et al.: Preoperative selection of patients with colorectal cancer liver metastasis for hepatic resection. World J Gastroenterol 2016; 22: 567-581
- Adam R, Pascal G, Castaing D, et al.: Tumor progression while on chemotherapy: a contraindication to liver resection for multiple colorectal metastases? Ann Surg 2004; 240: 1052-1061; discussion 1061-1064
- Ichida H, Mise Y, Ito H, et al.: Optimal indication criteria for neoadjuvant chemotherapy in patients with resectable colorectal liver metastases. World J Surg Oncol 2019; 17: 100
- Ninomiya M, Emi Y, Motomura T, et al.: Efficacy of neoadjuvant chemotherapy in patients with high-risk resectable colorectal liver metastases. Int J Clin Oncol 2021; 26: 2255-2264
- Ayez N, van der Stok EP, de Wilt1 H, et al.: Neo-adjuvant chemotherapy followed by surgery versus surgery alone in high-risk patients with resectable colorectal liver metastases: the CHARISMA randomized multicenter clinical trial. BMC Cancer 2015; 15: 180
- Nordlinger B, Sorbye H, Glimelius B, et al.: Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer(EORTC Intergroup trial 40983): a randomized controlled trial. Lancet 2008; 371: 1007-1016
- Nordlinger B, Sorbye H, Glimelius B; EORTC Gastro-Intestinal Tract Cancer Group, et al.: Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer(EORTC 40983): long-term results of a randomized, controlled, phase 3 trial. Lancet Oncol 2013; 14: 1208-1215
- Primrose J, Falk S, Finch-Jones M, et al.: Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol 2014; 15: 601-611
- Bridgewater JA, Pugh SA, Maishman T, et al.: Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis(New EPOC): long-term results of a multicentre, randomized, controlled, phase 3 trial. Lancet Oncol 2020; 21: 398-411
- Di Martino M, Primavesi F, Syn N, et al.: Long-Term Outcomes of Perioperative Versus Neoadjuvant Chemotherapy for Resectable Colorectal Liver Metastases: An International Multicentre Propensity-Score Matched Analysis with Stratification by Contemporary Risk-Scoring. Ann Surg Oncol 2022; 29: 6829-6842
- Nakano H, Oussoultzoglou E, Rosso E, et al.: Sinusoidal injury increases morbidity after major hepatectomy in patients with colorectal liver metastases receiving preoperative chemotherapy. Ann Surg 2008; 247: 118-124
CQ 20:肝転移巣切除後の術後補助化学療法は推奨されるか?
肝転移巣切除後に対して術後補助化学療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:87%)
切除可能な肝転移に対する最も効果が高い治療法は根治的な外科切除である。しかし,肝転移巣切除後の再発率は約45~70%と高く1-3),治療成績の向上が必要である。そのため,再発を抑制して予後を改善する目的に補助化学療法が検討されてきた。
補助化学療法を行う目的は根治であり,臨床試験における主要評価項目としては全生存期間(OS)が用いられてきたが,長い観察期間が問題となる。治癒切除可能な病期においては術後の無病生存期間(DFS)や無再発生存期間(RFS),無増悪生存期間(PFS)がOSの代替エンドポイントとして確立しており,臨床試験における主要評価項目として用いられることが多い。しかし,大腸癌肝転移切除後においては,こうしたエンドポイントとOSとの相関が弱く,OSの代替として不適であることがメタ解析において示された4)。したがって大腸癌肝転移切除後の術後補助化学療法において,DFS/RFS/PFSとOSは別の価値を持つエンドポイントとして捉えるべきである。
肝切除切除後の術後補助化学療法については,肝動注療法と全身薬物療法のデータがある。肝動注療法は,残肝への再発抑制効果は示されているものの,肝以外の遠隔転移再発抑制や生存期間延長には寄与しないことが報告されている5-7)。一方,全身薬物療法は,現在まで3つのランダム化比較試験(FFCD09002試験,Hasegawaらの試験,JCOG0603試験)と1つの統合解析にて,有用性に関する報告がある。FFCD09002試験2)は,肝転移治癒切除例を対象に手術単独と5-FU+LV療法による術後補助化学療法の比較試験であり,5年RFSは化学療法群で有意に良好であったが,OSは有意差を認めなかった。本試験と欧州,カナダで実施されたENG試験を合わせた統合解析において,5-FU+l-LV療法による術後補助化学療法群は手術単独と比べて,有意差はないもののPFS,OSが良好であり,多変量解析では術後補助化学療法の実施は独立した予後良好因子であることが報告された8)。Hasegawaらの試験1)は,肝転移治癒切除例を対象に手術単独とUFT+LV療法を用いた術後補助化学療法が比較され,3年RFSは術後UFT+LV群で有意に良好(ハザード比0.56,95%信頼区間0.38-0.83)であったが,OSでは有意差を認めず(ハザード比0.80,95%信頼区間0.48-1.35),7年を超える長期フォローアップにおいても,その傾向は変わらなかった9)。JCOG0603試験は,手術単独とmFOLFOX6療法を用いた術後補助化学療法のランダム化比較試験であり,主要評価項目のDFSは術後補助化学療法群で有意に良好(ハザード比0.63,95%信頼区間0.45-0.89)であったが,OSには有意差を認めなかった(ハザード比1.35,95%信頼区間0.84-2.19)3)。
以上より,肝転移切除後の全身補助化学療法では,再発抑制効果は示されるがOSの延長は示されない,という一貫した結果が得られている。再発の抑制あるいは再発時期の遅延は,補助療法が適切に施行されれば,患者の利益となり得ると考えられ,術後の補助化学療法が弱く推奨される。ただし,実施の判断は,生存期間の延長効果が示されていない現状を踏まえ,治療に伴う通院や有害事象による患者への負担,肝障害による再発した場合の再肝切除への影響なども考慮して個々の患者に応じて行う。また,Stage Ⅱ/Ⅲの治癒切除後に補助化学療法を行い,その後に肝転移再発をした症例の場合は,補助化学療法終了後からの期間も考慮する10)。大腸癌肝転移切除後の主な予後因子として,原発巣組織型や壁深達度,リンパ節転移個数,肝転移時期(同時,異時),肝転移最大径,肝転移個数などが報告されている11)が,再発高リスクの定義は確立していない。術後補助化学療法の治療レジメンはフッ化ピリミジン単独療法とoxaliplatin併用療法が選択肢となるが,明確な使い分けはなく,期待される効果と有害事象,患者背景などを考慮して選択する。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ20 | 4%(1/23) | 87%(20/23) | 4%(1/23) | 0% | 4%(1/23) |
文献
- Hasegawa K, Saiura A, Takayama T, et al: Adjuvant oral uracil-tegafur with leucovorin for colorectal cancer liver metastases: a randomized controlled trial. PLoS One 2016; 11: e0162400
- Portier G, Elias D, Bouche O, et al: Multicenter randomized trial of adjuvant fluorouracil and folnic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol 2006; 24: 4976-4982
- Kanemitsu Y, Shimizu Y, Mizusawa J, et al: Hepatectomy Followed by mFOLFOX6 Versus Hepatectomy Alone forLiver Only Metastatic Colorectal Cancer(JCOG0603): A Phase Ⅱ or Ⅲ Randomized Controlled Trial. J Clin Oncol 2021; JCO2101032: 39: 3789-3799
- Ecker BL, Lee J, Saadat LV, Aparicio T, Buisman FE, Balachandran VP, et al. Recurrence-free survival versus overall survival as a primary endpoint for studies of resected colorectal liver metastasis: a retrospective study and meta-analysis. Lancet Oncol. 2022; 23(10): 1332-42.
- Lorenz M, Müller HH, Schramm H, et al: Randomized trial of surgery versus surgery followed by adjuvant hepatic arterial infusion with 5-fluorouracil and folinic acid for liver metastases of colorectal cancer. German Cooperative on Liver Metastases(Arbeitsgruppe Lebermetastasen). Ann Surg 1998; 228: 756-762
- 森 武生,高橋慶一,大植雅之,他: 大腸癌肝転移に対する肝切除後の残肝再発予防としての動注療法.消化器外科2001; 24: 313-319
- Kemeny MM, Adak S, Gray B, et al: Combined-modality treatment for resectable metastatic colorectal carcinoma to the liver: surgical resection of hepatic metastases in combination with continuous infusion of chemotherapy--an intergroup study. J Clin Oncol 2002; 15: 1499-1505
- Mitry E, Fields AL, Bleiberg H, et al: Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol 2008; 26: 4906-4911
- Kokudo T, Saiura A, Takayama T, Miyagawa S, Yamamoto J, Ijichi M, et al. Adjuvant chemotherapy can prolong recurrence-free survival but did not influence the type of recurrence or subsequent treatment in patients with colorectal liver metastases. Surgery. 2021; 170(4): 1151-4.
- Cervantes A, Adam R, Rosello S, Arnold D, Normanno N, Taieb J, et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of oncology: official journal of the European Society for Medical Oncology/ESMO. 2023; 34(1): 10-32.
- Kato T, Yasui K, Hirai T, et al: Therapeutic results for hepatic metastasis of colorectal cancer with special reference to effectiveness of hepatectomy. Dis Colon Rectum 2003; 46(Suppl): S22-S31
CQ 21:肝転移以外の遠隔転移巣切除後の術後補助化学療法は推奨されるか?
肺転移など肝転移以外の遠隔転移巣では,術後補助化学療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:87%)
切除可能な肺転移や腹膜播種に対する最も効果が高い治療法は外科切除である。しかし,遠隔転移巣切除後の再発率は50~70%と高いことから,治療成績の向上のために術後薬物療法の実施が検討されてきた。
肝転移の術後補助化学療法に関しては,CQ 20のようにこれまでいくつかのランダム化比較試験が行われ一定のエビデンスが積み重ねられてきた1,2)。しかし,肝転移以外の遠隔転移に関しての臨床試験は少なく2),腹膜播種切除後の全身化学療法やHIPECの有用性を検討したランダム化比較試験が行われてきたが,明確な有用性を示した報告はない3-11)。肺転移切除例や腹膜転移切除例の後方視的検討において,補助化学療法の実施が予後良好因子であったとの報告がある一方12-14),予後の改善がないなど様々な結果が報告されている15)。
本邦から報告された肺転移切除後524例の傾向スコア解析では,術後補助化学療法の5年OSおよびDFSへの寄与は認められなかった15)。また,最近報告された肺転移切除後の術後補助化学療法に関する18個の後ろ向き研究を検討したシステマティックレビューにおいても,術後薬物療法を行った患者では行わなかった患者と比較してOSが良好な傾向はあるものの(ハザード比0.78,95%信頼区間0.60-1.03),有意な差は示されなかった16)。
肺転移症例に対する周術期薬物療法に関する後ろ向き研究のシステマティックレビューにおいて,周術期薬物療法を行った患者でOS(ハザード比0.83,95%信頼区間0.75-0.92)およびPFS(ハザード比0.67,95%信頼区間0.53-0.86)が良好であったことから,周術期に薬物療法を行うことで予後の改善に寄与する可能性が示唆されたが17),システマティックレビューに含まれた8研究のうち3研究が術前および術後,5研究は術後のみであったこと,いずれもランダム化比較試験ではないこと等から,術前,術後の薬物療法のいずれの治療が有効かを評価するエビデンスとしては十分でなく,薬物療法の至適時期に関しては更なる知見の蓄積が待たれる。現時点では,転移臓器によって薬物療法の有効性が異なるという明確なエビデンスがないため,肝転移で示された補助化学療法の再発抑制効果を参考に,肝以外の肺転移,腹膜転移などの遠隔転移巣を切除した患者に対して,術後補助化学療法は治療選択肢の一つとして考慮される。
遠隔転移切除後の補助化学療法の最適な治療レジメンおよび治療期間は現時点では確立していない。肝転移再発抑制効果を示したランダム化比較試験は,フッ化ピリミジン単独療法(5-FU+l-LV療法,UFT+LV療法)を用いた試験であったが,Stage Ⅲ術後の補助化学療法の推奨レジメンであるoxaliplatin併用療法を,Stage Ⅲよりも再発リスクが明らかに高い遠隔転移切除例に適用することも実地臨床では選択肢の一つと考えられる。ただし,転移巣手術では手術侵襲が原発巣手術よりも大きく,患者の回復に時間がかかる場合が多いことを考慮する必要がある。治療期間に関して,Stage Ⅲの再発低リスクでは補助化学療法の3カ月投与への期間短縮も推奨されているが,明らかに再発率の高い遠隔転移術後は6カ月投与が原則と考えられる。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ21 | 0% | 87%(20/23) | 0% | 0% | 13%(3/23) |
文献
- Portier G, Elias D, Bouche O, et al.: Multicenter randomized trial of adjuvant fluorouracil and folnic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol 2006; 24: 4976-4982
- Mitry E, Fields AL, Bleiberg H, et al.: Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol 2008; 26: 4906-4911
- Guinney J, Dienstmann R, Wang X, et al.: The consensus molecular subtypes of colorectal cancer. Nat Med 2015; 21: 1350-1356
- Dalerba P, Sahoo D, Paik S, et al.: CDX2 as a prognostic biomarker in stage Ⅱ and stage Ⅲ colon cancer. N Engl J Med 2016; 374: 211-222
- Phallen J, Sausen M, Adleff V, et al.: Direct detection of early-stage cancers using circulating tumor DNA. Sci Transl Med 2017; 9: eaan2415
- Iveson TJ, Sobrero AF, Yoshino T, et al.: Duration of Adjuvant Doublet Chemotherapy(3 or 6 months)in Patients With High-Risk Stage Ⅱ Colorectal Cancer. J Clin Oncol 2021; 39: 631-641
- Yamazaki K, Yamanaka T, Shiozawa M, et al.: Oxaliplatin-based adjuvant chemotherapy duration(3 versus 6 months)for high-risk stage Ⅱ colon cancer: the randomized phase Ⅲ ACHIEVE-2 trial. Ann Oncol 2021; 32: 77-84
- Rovers KP, Bakkers C, van Erning FN, et al.: Adjuvant Systemic Chemotherapy vs Active Surveillance Following Up-front Resection of Isolated Synchronous Colorectal Peritoneal Metastases. JAMA Oncol 2020; 6: e202701
- Goéré D, Glehen O, Quenet F, et al.: Second-look surgery plus hyperthermic intraperitoneal chemotherapy versus surveillance in patients at high risk of developing colorectal peritoneal metastases(PROPHYLOCHIP-PRODIGE 15): a randomised, phase 3 study. Lancet Oncol 2020; 21: 1147-1154
- Quénet F, Elias D, Roca L, Goéré D, et al.: Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductive surgery alone for colorectal peritoneal metastases(PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22: 256-266
- Klaver CEL, Wisselink DD, Punt CJA, et al.: Adjuvant hyperthermic intraperitoneal chemotherapy in patients with locally advanced colon cancer(COLOPEC): a multicentre, open-label, randomised trial. Lancet Gastroenterol Hepatol 2019; 4: 761-770
- Brandi G, Derenzini E, Falcone A, et al.: Adjuvant systemic chemotherapy after putative curative resection of colorectal liver and lung metastases. Clin Colorectal Cancer 2013; 12: 188-189
- Renaud S, Schaeffer M, Falcoz PE, et al.: Perioperative bevacizumab improves survival following lung metastasectomy for colorectal cancer in patients harbouring v-Ki-ras2 Kirsten rat sarcoma viral oncogene homologue exon 2 codon 12 mutations. Eur J Cardiothorac Surg 2017; 51: 255-262
- Park HS, Jung M, Shin SJ, et al.: Benefit of Adjuvant Chemotherapy After Curative Resection of Lung Metastasis in Colorectal Cancer. Ann Surg Oncol 2016; 23: 928-935
- Imanishi M, Yamamoto Y, Hamano Y, et al.: Efficacy of adjuvant chemotherapy after resection of pulmonary metastasis from colorectal cancer: a propensity score-matched analysis. Eur J Cancer 2019; 106: 69-77
- Zhang C, Tan Y, Xu H: Does adjuvant chemotherapy improve the prognosis of patients after resection of pulmonary metastasis from colorectal cancer? A systematic review and meta-analysis. Int J Colorectal Dis 2019; 34: 1661-1671
- Li Y, Qin Y: Peri-operative chemotherapy for resectable colorectal lung metastasis: a systematic review and meta-analysis. J Cancer Res Clin Oncol 2020; 146: 545-553
CQ 22:大腸癌の卵巣転移に対して卵巣切除は推奨されるか?
- 根治切除可能な同時性および異時性卵巣転移に対しては,切除することを強く推奨する。(推奨度1・エビデンスレベルB,合意率:74%)
- 卵巣転移および卵巣転移以外の切除不能遠隔転移を同時に有する場合,薬物療法を選択するが,卵巣転移の増大による自覚症状がある場合は,卵巣転移の姑息切除を行うことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:91%)
卵巣転移に対する卵巣切除に関するエビデンスは,主に比較的小規模な後ろ向き研究である。
女性の大腸癌症例の1.6~8.1%に卵巣転移が存在し,同時性転移が0.8~3.4%,異時性転移が0.6~3.3%と報告されている1-5)。
同時性または異時性卵巣転移切除例の5年全生存率(OS)は25.0~46.0%と報告され,切除例が非切除例に対して有意に予後を延長したと報告されている2,3,6-8)。したがって,大規模な前向き研究やランダム化比較試験によるエビデンスは存在しないものの,切除可能な卵巣転移は,肝転移や肺転移同様,切除による予後延長が期待できるため,切除することを強く推奨する。
一方,切除不能遠隔転移を同時に有する卵巣転移に対する治療方針は,「2.Stage Ⅳ大腸癌の治療方針」,または,「3.再発大腸癌の治療方針」のとおり,一般に全身性疾患ととらえ,切除不能な進行再発大腸癌に対する薬物療法の項を参考にして全身薬物療法を実施する。しかし,卵巣転移は,他の遠隔転移巣に比べて薬物療法の効果が低いことが指摘されている9-12)。また,少数ではあるが,このような症例に対する姑息的切除の予後延長の報告も存在する13,14)。したがって,薬物療法開始後に卵巣転移の増大を認めそれによる自覚症状が出現した際,また将来の症状出現が予想される場合には,速やかに姑息的卵巣切除を行うことを検討すべきである。
卵巣転移を有する患者の,肉眼的健側卵巣への転移頻度に関する報告は少ない。
卵巣転移切除症例31例の後ろ向き観察研究では,予防的に切除した肉眼的健側卵巣切除9例のうち1例に顕微鏡的転移を認めた。また肉眼的健側卵巣温存例8例のうち1例に異時性卵巣再発を生じた8)と報告されている。したがって,同時性または異時性卵巣転移に対して,肉眼的健側卵巣を予防的に切除すべきかについて,結論を得ることは難しい。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ22-① | 74%(17/23) | 26%(6/23) | 0% | 0% | 0% |
| CQ22-② | 9%(2/23) | 91%(21/23) | 0% | 0% | 0% |
文献
- Huang PP, Weber TK, Mendoza C, et al.: Long-term survival in patients with ovarian metastases from colorectal carcinoma. Ann Surg Oncol 1998; 5: 695-698
- Kim DD, Park IJ, Kim HC, et al.: Ovarian metastases from colorectal cancer: a clinicopathological analysis of 103 patients. Colorectal Dis 2009; 11: 32-38
- Fujiwara A, Noura S, Ohue M, et al.: Significance of the resection of ovarian metastasis from colorectal cancers. J Surg Oncol 2010; 102: 582-527
- Tan KL, Tan WS, Lim JF, et al.: Krukenberg tumors of colorectal origin: a dismal outcome--experience of a tertiary center. Int J Colorectal Dis 2010; 25: 233-238
- Segelman J, Flöter-Rådestad A, Hellborg H, et al.: Epidemiology and prognosis of ovarian metastases in colorectal cancer. Br J Surg 2010; 97: 1704-1709
- Xu KY, Gao H, Lian ZJ, et al.: Clinical analysis of Krukenberg tumours in patients with colorectal cancer-a review of 57 cases. World J Surg Oncol 2017; 15: 25
- Thornblade LW, Han E, Fong Y: Colorectal cancer ovarian metastases. Int J Gynecol Cancer 2021; 31: 1137-1144
- Al-Busaidi IS, Bailey T, Dobbs B, et al.: Complete resection of colorectal cancer with ovarian metastases combined with chemotherapy is associated with improved survival. ANZ J Surg 2019; 89: 1091-1096
- Sekine K, Hamaguchi T, Shoji H, et al.: Retrospective Analyses of Systemic Chemotherapy and Cytoreductive Surgery for Patients with Ovarian Metastases from Colorectal Cancer: A Single-Center Experience. Oncology 2018; 95: 220-228
- Zhou R, Liu Y, Wang Y, et al.: Clinicopathological characteristics and prognosis analysis of ovarian metastases in colorectal cancer: a single-center experience. Int J Clin Oncol 2020; 25: 1822-1829
- Goéré D, Daveau C, Elias D, et al. The differential response to chemotherapy of ovarian metastases from colorectal carcinoma. Eur J Surg Oncol 2008; 34: 1335-1339
- Ribeiro Gomes J, Belotto M, D’Alpino Peixoto R: The role of surgery for unusual sites of metastases from colorectal cancer: A review of the literature. Eur J Surg Oncol 2017; 43: 15-19
- Lee SJ, Lee J, Lim HY, et al.: Survival benefit from ovarian metastatectomy in colorectal cancer patients with ovarian metastasis: a retrospective analysis. Cancer Chemother Pharmacol 2010; 66: 229-235
- Garrett CR, George B, Viswanathan C, et al.: Survival benefit associated with surgical oophorectomy in patients with colorectal cancer metastatic to the ovary. Clin Colorectal Cancer 2012; 11: 191-194
CQ 23:切除不能大腸癌に対する免疫チェックポイント阻害薬は推奨されるか?
- MSI-HまたはdMMRの切除不能大腸癌一次治療例に,pembrolizumab療法を行うことを強く推奨する。(推奨度1・エビデンスレベルA,合意率:100%)
- MSI-HまたはdMMRの切除不能大腸癌既治療例に,pembrolizumab療法,nivolumab療法,またはnivolumab+ipilimumab療法を行うことを強く推奨する。(推奨度1・エビデンスレベルA,合意率:100%)
- TMB-Hかつnon MSI-Hの切除不能大腸癌既治療例に,pembrolizumab療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:96%)
DNAミスマッチ修復(MMR:mismatch repair)機能に欠損がある腫瘍は,マイクロサテライト不安定性(MSI)検査で高頻度マイクロサテライト不安定性(MSI-H:microsatellite instability-high),あるいはMMRタンパクの免疫組織化学染色(MMR-IHC)検査での発現消失(dMMR:deficient MMR)を認め,その頻度は日本人の切除不能大腸癌では約4%と報告されている1)。MSI-HまたはdMMRの固形癌は,体細胞変異の蓄積(hypermutation)から,ネオアンチゲン数も多くなり,免疫原性が高いと考えられている。
MSI-HまたはdMMRの切除不能大腸癌初回治療例を対象に抗PD-1抗体薬pembrolizumab(Pembro)と標準治療(FOLFOX/FOLFIRI±BEV/CET)を比較した第Ⅲ相試験(KEYNOTE-177)では,PFSはPembro群で有意に良好であり2)(PFS中央値16.5カ月vs. 8.2カ月;ハザード比0.60,95%信頼区間0.45-0.80,p=0.0002),OSも有意差はないもののPembro群で良好な傾向であった(ハザード比0.74,95%信頼区間0.53-1.03)3)。Grade 3以上の有害事象はPembro群で低い傾向にあり(56% vs. 78%),免疫関連有害事象はPembro群で多い傾向であった(31% vs. 13%)。以上から,MSI-HまたはdMMRの切除不能大腸癌の一次治療としてPembro療法が強く推奨され,治療開始前にMSI検査もしくはMMR-IHC検査を実施しておくことが望ましい。
一方,既治療例(免疫チェックポイント阻害薬は未治療)では,Pembro,抗PD-1抗体薬nivolumab(Nivo)療法の第Ⅱ相試験が報告され,高い奏効割合と無増悪生存率が報告された4,5)。また,抗CTLA4抗体薬Ipilimumab(Ipi)+Nivo併用療法は,奏効割合55%,1年PFS率71%とさらに良好な成績が示唆される一方で,Grade 3以上の有害事象の頻度も高い6)ことが報告された。Ipi+Nivo併用療法とNivo療法とを直接比較した試験ではない点に留意が必要である。以上から,もし一次治療でPembroが使用されなかった場合,Pembro療法,Nivo療法,またはIpi+Nivo療法を行うことが強く推奨される。ただし,現時点ではMMR-IHC検査はPembroのコンパニオン診断薬ではあるもののNivo,Ipi+Nivoのコンパニオン診断薬にはなっていないことに留意する必要がある(最新情報はhttps://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.htmlを参照)。
近年,腫瘍遺伝子変異量が高い(TMB-H:tumor mutation burden-high)固形癌という概念が確立し,FoundationOne CDxによりTMBスコア10 mut/Mb以上の標準的治療に不応または・不耐の進行・再発固形癌においてPembro療法が有効であることが示唆された(KEYNOTE-158試験)7)。しかし,KEYNOTE-158試験には大腸癌患者は含まれていないため,TMBスコア10mut/Mbというカットオフ値が適切かを含め大腸癌患者に対する実際の治療効果は不明な点も多い。DNAポリメラーゼ校正機能異常例(POLD1もしくはPOLE遺伝子の異常)では高い効果が期待されるものの,それらを除くと有効性が乏しいという報告もある8,9)。対象が標準的治療に不応または・不耐であることを考慮すれば,TMB-H大腸癌に対し,Pembroを治療選択肢として提供することは考慮されるものの,TMB-H大腸癌のうちNon MSI-Hの患者(約6%)に対するPembroの有効性は明らかでなく,実際のTMBスコア,DNAポリメラーゼ校正関連遺伝子異常の有無などから期待される効果を推定し,FTD/TPI±BEVやregorafenibなどの他の治療選択肢,想定される有害事象等による不利益も考慮して,その適応を慎重に判断する必要がある。
上記以外のpMMR(MMR proficient)/Non-MSI-H/Non-TMB-Hの大腸癌に対しては,免疫チェックポイント阻害薬の有効性は確立されておらず,現時点では臨床試験以外では使用されるべきではない。
免疫チェックポイント阻害薬の使用の際には,免疫関連有害事象が一定頻度で認められ,さらにIpi+Nivo療法では,他癌腫における報告と同様,Nivo療法と比較して,その頻度が高くなることから,使用にあたっては注意深いモニタリングと発現時の適切な対応が必要である(日本臨床腫瘍学会「がん免疫療法ガイドライン」,「適正使用ガイド」等を参照のこと)。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ23-① | 100%(23/23) | 0% | 0% | 0% | 0% |
| CQ23-② | 100%(23/23) | 0% | 0% | 0% | 0% |
| CQ23-③ | 0% | 96%(22/23) | 0% | 0% | 4%(1/23) |
文献
- Akagi K, Oki E, Taniguchi H, et al.: Real-world data on microsatellite instability status in various unresectable or metastatic solid tumors. Cancer Sci 2021; 112: 1105-1113
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 2020; 383: 2207-2218
- Diaz LA Jr, Shiu KK, Kim TW, et al.: Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer(KEYNOTE-177): final analysis of a randomized, open-label, phase 3 study. Lancet Oncol. 2022; 23: 659-670
- Le DT, Kim TW, Van Cutsem E, et al.: Phase Ⅱ Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164. J Clin Oncol 2020; 38: 11-19
- Overman MJ, McDermott R, Leach JL, et al.: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer(CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017; 18: 1182-1191
- Overman MJ, Lonardi S, Wong KYM, et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 2018; 36: 773-779
- Marabelle A, Fakih M, Lopez J, et al.: Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open label, phase 2 KEYNOTE-158 study. Lancet Oncol 2020; 21: 1353-1365
- Rousseau B, Foote MB, Maron SB, et al.: The Spectrum of Benefit from Checkpoint Blockade in Hypermutated Tumors. N Engl J Med 2021; 384: 1168-1170.
- Duvivier HL, Rothe M, Mangat PK, et al.: Pembrolizumab in Patients With Tumors With High Tumor Mutational Burden: Results From the Targeted Agent and Profiling Utilization Registry Study. J Clin Oncol 2023; 41: 5140-5150
CQ 24:切除不能大腸癌に対する後方治療は推奨されるか?
フッ化ピリミジン,oxaliplatin,irinotecan,血管新生阻害薬,抗EGFR抗体薬(RAS野生型の場合)に不応または不耐(投与不適を含む)となった場合,後方治療を行うことを推奨する。
- FTD/TPI+BEV療法(推奨度1・エビデンスレベルA,合意率:96%)
- Regorafenib療法(推奨度2・エビデンスレベルA,合意率:74%)
- FTD/TPI療法(推奨度2・エデビデンスレベルA,合意率:87%)
切除不能大腸癌では,フッ化ピリミジン,oxaliplatin,irinotecan,血管新生阻害薬,抗EGFR抗体薬(RAS野生型の場合)に不応または不耐(投与不適を含む)となった際の後方治療として,regorafenib療法(REG)およびtrifluridine(FTD)/tipiracil塩酸塩(TPI)単独療法(TAS-102,以下FTD/TPI)の有用性が,日本人患者も含まれたプラセボ対照国際共同第Ⅲ相試験CORRECT試験1,2)およびRECOURSE試験3)により,検証されている(CORRECT試験:全生存期間中央値6.4 vs. 5.0カ月,ハザード比0.77,95%信頼区間0.64-0.94,p=0.0052;RECOURSE試験:全生存期間中央値7.1カ月 vs. 5.3カ月,ハザード比0.68,95%信頼区間0.58-0.81,p<0.001)。また,FTD/TPIとBEVの併用療法は,本邦で実施された第Ⅰ/Ⅱ相試験にて良好な有効性が示唆され4-6),その後,欧州を中心に三次治療例を対象に実施されたFTD/TPI療法との第Ⅲ相試験SUNLIGHT試験では,主要評価項目である全生存期間の有意な延長が示された(中央値10.8カ月 vs. 7.5カ月,ハザード比0.61,95%信頼区間0.49-0.77,p<0.001)7)。
有害事象として,REGでは手足皮膚反応,疲労,下痢,高血圧等の非血液毒性が,FTD/TPIでは白血球・好中球数減少などの血液毒性の頻度が高く,有害事象のプロファイルが異なる。また,FTD/TPIにBEVを併用することで好中球数・血小板数減少といった血液毒性や悪心,疲労,口内炎,高血圧等の非血液毒性の頻度が増加することが報告されている。以上より,REGおよびFTD/TPI,FTD/TPI+BEVはいずれも生存期間の延長が確認されており,副作用に留意が必要であるが,推奨される治療である。
いずれの治療を先行するかについては,REGとFTD/TPIまたはFTD/TPI+BEVを直接比較したランダム化比較試験はないが,大腸癌研究会が行ったREGとFTD/TPIの後方視的研究における650名の傾向スコア解析8)では,生存期間のハザード比は0.96(95%信頼区間0.78-1.18,p=0.69)であり,両薬剤の有効性は同程度と考えられる。したがって,FTD/TPIに対して生存期間延長効果を示したFTD/TPI+BEVが後方治療の第一選択肢と考えるが,BEVの併用が困難な患者にはREG,FTD/TPI単独療法のいずれかをリスクとベネフィットを考慮したうえで選択することが望ましい。なお,PS 2以上の患者に対してはREGおよびFTD/TPI,FTD/TPI+BEVのいずれも有効性・安全性は確立されておらず,治療適応外とし対症療法を選択するのが望ましい。また,安全性を高めるため,REGについては,160 mg/日の標準用量で治療を開始せず,80 mgあるいは120 mgから開始し副作用が軽度であれば増量していくストラテジーが試みられており,有効性を損なわずに安全に投与できる可能性が示唆されている9,10)。
抗EGFR抗体薬に不応のRAS野生型に対し,一定期間抗EGFR抗体薬を含まない治療を行った後に再度抗EGFR抗体薬を投与するリチャレンジ療法の開発が行われている。一次治療としてFOLFIRI+抗EGFR抗体薬併用療法を行い奏効が認められた患者を対象に,二次治療としてBEV併用療法を施行後,三次治療としてCET+IRI療法を行う第Ⅱ相試験(CRICKET試験11))では奏効割合21%,病勢制御割合54%と報告され,奏効が認められた患者では,治療前の血液循環腫瘍DNA(ctDNA:circulating tumor DNA)検査にてRAS変異が認められなかったことが報告されている。また,抗EGFR抗体薬療法に奏効を認め,抗EGFR抗体薬を含まない後治療を行った後,ctDNA検査にてRAS,BRAF,EGFR ECDに変異を認めない患者を対象にPANI療法を行う第Ⅱ相試験(CHRONOS試験12))では,奏効割合30%,病勢制御割合63%と報告されている。本邦でも,ctDNAからRAS遺伝子変異を検出するOncoBEAMTM RAS CRCキットが2020年8月に保険償還されている。しかしながら,ctDNA検査でRAS遺伝子型を確認することの臨床的意義や,その結果に基づく抗EGFR抗体薬のリチャレンジ療法の後方治療としての推奨について現時点では明確ではなく,現在進行中のランダム化比較試験の結果を待ちたい。
メモ
新たな後方治療として,VEGFR-1/2/3のチロシンキナーゼ阻害薬であるfruquintinibの有効性が報告されている。Fruquintinibは中国国内で実施されたプラセボ対照第Ⅲ相試験であるFRESCO試験13)において生存期間延長効果を示し,その後,REGまたはFTD/TPI不応例を対象に実施されたプラセボ対照国際共同第Ⅲ相試験FRESCO-2試験14)においても生存期間延長効果を示し,今後の臨床導入が期待される。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ24-① | 96%(22/23) | 4%(1/23) | 0% | 0% | 0% |
| CQ24-② | 26%(6/23) | 74%(17/23) | 0% | 0% | 0% |
| CQ24-③ | 13%(3/23) | 87%(20/23) | 0% | 0% | 0% |
文献
- Grothey A, Van Cutsem E, Sobrero A, et al.; CORRECT Study Group: Regorafenib monotherapy for previously treated metastatic colorectal cancer(CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381: 303-312
- Yoshino T, Komatsu Y, Yamada Y, et al.: Randomized phase Ⅲ trial of regorafenib in metastatic colorectal cancer: analysis of the CORRECT Japanese and non-Japanese subpopulations. Invest New Drugs 2015; 33: 740-750
- Mayer RJ, Van Cutsem E, Falcone A, et al.; RECOURSE Study Group: Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 2015; 372: 1909-1919
- Kuboki Y, Nishina T, Shinozaki E, et al.: TAS-102 plus bevacizumab for patients with metastatic colorectal cancer refractory to standard therapies(C-TASK FORCE): an investigator-initiated, open-label, single-arm, multicentre, phase 1/2 study. Lancet Oncol 2017; 18: 1172-1181
- Takahashi T, Yamazaki K, Oki E, et al.: Phase Ⅱ study of trifluridine/tipiracil plus bevacizumab by RAS mutation status in patients with metastatic colorectal cancer refractory to standard therapies: JFMC51-1702-C7. ESMO Open 2021; 6: 100093
- Yoshida Y, Yamada T, Kamiyama H et al.: Combination of TAS-102 and bevacizumab as third-line treatment for metastatic colorectal cancer: TAS-CC3 study. Int J Clin Oncol 2021; 26: 111-117
- Prager GW, Taieb J, Fakih M et al.: Trifluridine-Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med 2023; 388: 1657-1667
- Moriwaki T, Fukuoka S, Taniguchi H, et al.: Propensity score analysis of regorafenib versus trifluridine/tipiracil in patients with metastatic colorectal cancer refractory to standard chemotherapy(REGOTAS): A Japanese Society for Cancer of the Colon and Rectum Multicenter Observational Study. Oncologist 2018; 23: 7-15
- Bekaii-Saab TS, Ou FS, Ahn DH, et al.: Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer(ReDOS): a randomised, multicentre, open-label, phase 2 study. Lancet Oncol 2019; 20: 1070-1082
- Kato T, Kudo T, Kagawa Y et al.: Phase Ⅱ dose titration study of regorafenib in progressive unresectable metastatic colorectal cancer. Sci Rep 2023; 13: 2331.
- Cremolini C, Rossini D, Dell’Aquila E, et al.: Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial. JAMA Oncol 2019; 5: 343-350
- Sartore-Bianchi A, Pietrantonio F, Lonardi S et al.: Circulating tumor DNA to guide rechallenge with panitumumab in metastatic colorectal cancer: the phase 2 CHRONOS trial. Nat med 2022; 28: 1612-1618
- Li J, Qin S, Xu RH et al.: Effect of Fruquintinib vs Placebo on Overall Survival in Patients With Previously Treated Metastatic Colorectal Cancer: The FRESCO Randomized Clinical Trial. Jama 2018; 319: 2486-2496.
- Dasari NA, Lonardi S, Garcia-Carbonero R et al.: FRESCO-2: A global phase Ⅲ multiregional clinical trial(MRCT)evaluating the efficacy and safety of fruquintinib in patients with refractory metastatic colorectal cancer. Annals of Oncology 2022; 33(Suppl 7): S1391-S1392
CQ 25:切除不能大腸癌に対する導入薬物療法後の維持療法は推奨されるか?
Oxaliplatin併用導入薬物療法開始後に,患者のQOL等を考慮して,維持療法に移行することを推奨する。
- FOLFOXIRI+BEV後のフッ化ピリミジン+BEV(推奨度1・エビデンスレベルA,合意率:100%)
- FOLFOX/CAPOX/SOX+BEV後のフッ化ピリミジン+BEV(推奨度2・エビデンスレベルA,合意率:65%)
- FOLFOX+CET/PANI後の5-FU+l-LV+CET/PANI(推奨度2・エビデンスレベルB,合意率:91%)
切除不能大腸癌に対する一次治療の薬物療法は,Conversionや症状緩和を目指し強力なレジメンによる導入薬物療法が行われる。しかし,導入薬物療法が奏効した一定期間後は,それ以上の腫瘍縮小が得られる期待は小さく,有害事象等によるQOL低下をできるだけ回避しながら,病勢制御による生存延長を目指すことが治療目標となる。つまり,強力な導入薬物療法の後にless toxicなレジメンによる維持療法を行う治療戦略が存在する(図1)。例えば,FOLFOXIRI+BEV療法は,ほとんどの臨床試験で8~12サイクルの導入薬物療法後は計画的にフッ化ピリミジン+BEVによる維持療法に移行する投与スケジュールとして規定されている1,2)。
oxaliplatinは感覚性末梢神経障害の蓄積が課題となり,中断後も改善しないことも多い。そのため,漫然と継続するのではなく,累積投与量を考慮して12~16週後に計画的に投与を中断し,16~24週または増悪後に再導入する“Stop and Go”が古くから提案されてきた。oxaliplatin併用療法の維持療法に関するランダム化比較試験のIPDメタアナリシスにおいて,通常の毒性に応じて休薬減量しながら継続投与を行う群と計画的にoxaliplatinを休止するStop and Goでは全生存期間に差がないことが示された(3試験,1,271例,ハザード比0.99,95%信頼区間0.87-1.13)3)。FOLFOX/CAPOX+BEV療法開始後に奏効もしくは病勢安定が得られた後に維持療法に移行する群と経過観察群の比較試験のメタアナリシスでは,フッ化ピリミジン+BEVによる維持療法は有意な無増悪生存期間の延長は認めたものの(メタアナリシス:ハザード比0.56),全生存期間は有意差を認めなかった(メタアナリシス:ハザード比0.88)4)。一方,BEV単独による維持療法と経過観察を比較したIPDメタアナリシスでは,認められた無増悪生存期間の延長がわずか3週間(ハザード比0.78)であったことから,維持療法としてのBEV単独療法は推奨されないとされた5)。以上から,FOLFOX/CAPOX/SOX+BEV療法後の維持療法としてはフッ化ピリミジン+BEV療法が選択肢として推奨される。
FOLFOX+CET/PANIによる導入薬物療法後の維持療法は,第Ⅲ相試験がなくエビデンスが乏しい。FOLFOX+PANI療法6サイクル後にFOLFOX+PANI継続群と5-FU+l-LV+PANI維持療法群のランダム化第Ⅱ相試験(N=164)では,無増悪生存期間,全生存期間は同程度であったが,感覚性末梢神経障害は維持療法群で軽度であった6)。また,抗EGFR抗体薬の継続使用は皮膚障害などQOL低下が懸念されうるが,メタアナリシスでは,抗EGFR抗体薬を継続使用した方が,抗EGFR抗体薬中断群と比較して,無増悪生存期間,全生存期間が良好な傾向を示した7)。現時点では,FOLFOX+CET/PANI療法後の維持療法としても有効性の観点から5-FU+l-LV+CET/PANIがオプションの一つとなる。
一方,irinotecan併用療法は,蓄積毒性について問題となる機会が比較的少なく,維持療法についてのエビデンスに乏しい。FOLFIRI療法を2カ月継続し2カ月休薬する間欠投与群と継続投与群を比較したランダム化試験(N=337)では,間欠投与群で3.5カ月の無治療期間(drug holiday)が得られたが,無増悪生存期間,全生存期間,有害事象に大きな差は認めなかったと報告されている8)。
また,導入薬物療法後病勢が安定した時点での一時的な完全治療休止(経過観察)も,メタアナリシスで薬物療法継続と比較して明らかな全生存期間の差を認めなかったと報告されている(6試験,2,907例,ハザード比1.04,95%信頼区間0.87-1.25)1)。患者の希望や新型コロナウイルス感染症パンデミック時のやむをえない治療中断も含め,考慮される選択肢となり得る。ただし,腫瘍量や病勢安定期間など患者個別の因子を考慮してshared decision makingのもと決定されるのが望ましい。
なお,薬剤の有効性がないと判断した場合(不応)の治療中止と異なり,副作用に忍容性がないと判断した場合の休止(不耐)や計画的な投与中断の場合には,薬剤再投与(reintroduction)による治療効果が期待できる。増悪した際は,以降の治療ラインにおける後治療の選択肢として考慮される。
図1 導入薬物療法の治療戦略
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ25-① | 100%(23/23) | 0% | 0% | 0% | 0% |
| CQ25-② | 35%(8/23) | 65%(15/23) | 0% | 0% | 0% |
| CQ25-③ | 9%(2/23) | 91%(21/23) | 0% | 0% | 0% |
文献
- Loupakis F, Cremolini C, Masi G, et al.: Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014; 371: 1609-1618
- Cremolini C, Antoniotti C, Rossini D, et al.; GONO Foundation Investigators: Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer(TRIBE2): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol 2020; 21: 497-507
- Adams R, Goey K, Chibaudel B, et al.: Treatment breaks in first line treatment of advanced colorectal cancer: An individual patient data meta-analysis. Cancer Treat Rev 2021; 99: 102226
- Tamburini E, Rudnas B, Santelmo C, et al.: Maintenance based Bevacizumab versus complete stop or continuous therapy after induction therapy in first line treatment of stage Ⅳ colorectal cancer: A meta-analysis of randomized clinical trials. Crit Rev Oncol Hematol 2016; 104: 115-123
- Salvatore L, Bria E, Sperduti I, et al.: Bevacizumab as maintenance therapy in patients with metastatic colorectal cancer: A meta-analysis of individual patients’ data from 3 phase Ⅲ studies. Cancer Treat Rev 2021; 97: 102202
- Munemoto Y, Nakamura M, Takahashi M, et al.: SAPPHIRE: a randomised phase Ⅱ study of planned discontinuation or continuous treatment of oxaliplatin after six cycles of modified FOLFOX6 plus panitumumab in patients with colorectal cancer. Eur J Cancer 2019; 119: 158-167
- Parisi A, Ghidini M, Giampieri R, et al.: Post-induction Strategies in Metastatic Colorectal Cancer Patients Treated With First-Line Anti-EGFR-Based Treatment: A Systematic Review and Meta-Analysis. Clin Colorectal Cancer 2022; 21: e162-e170
- Labianca R, Sobrero A, Isa L, et al.: Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised‘GISCAD’trial. Ann Oncol 2011; 22: 1236-1242
CQ 26:切除不能大腸癌に対する包括的がんゲノムプロファイリング検査は推奨されるか?
全身状態および臓器機能等から本検査施行後に薬物療法の適応となる可能性が高い患者に対し,適切な時期に,包括的がんゲノムプロファイリング検査を行うことを弱く推奨する。(推奨度2・エビデンスレベルB,合意率:91%)
包括的ゲノムプロファイリング検査(CGP検査)は,多数の遺伝子を網羅的に解析するゲノムプロファイルから治療方針策定の補助となる遺伝子異常の情報を得て,適切ながん薬物療法を提供するために実施される。腫瘍組織検体を用いるCGP検査に加えて,血漿検体を用いたCGP検査も薬事承認されており,腫瘍組織検体が得られない患者に対してもCGP検査が可能である。大腸癌では,NTRK,ALK,ROS1などの融合遺伝子異常やTMB-H,HER2(ERBB2)遺伝子増幅などが標的治療の対象となり得る。このうちNTRK融合遺伝子陽性例にはentrectinib/larotrectinib療法が1,2),TMB-Hにはpembrolizumab療法3)が薬事承認され,実地診療として使用できる。また,他のいくつかの遺伝子異常に対しても治験や患者申出制度の活用などにより治療を提供できる可能性がある。ただし,CGP検査の結果に基づき治療が行われた患者は約7%と報告されており,これらに対する治療薬を受けた患者での明らかな生存延長は示されていない4)。
CGP検査は全国のがんゲノム医療中核拠点病院・拠点病院・連携病院でのみ実施することができるため,それ以外の施設でCGP検査を検討する際には患者紹介が必要である。また,患者1人につき原則1回限り実施可能であることから,適切なタイミングでCGP検査および患者紹介が行われるべきである。そのタイミングは,CGP検査結果返却までに通常4週間以上要する点や,腫瘍量,腫瘍進行速度や治療抵抗性には個体差が大きいことを考慮して決定する。すでにECOG PSが不良,重度の肝機能障害,腎機能障害などで回復の見込みがない場合には,検査の適応がなくなることを考慮すれば,大腸癌患者では一次治療開始後から後方治療移行時までの適切な時期に,CGP検査を実施することが望ましい。なお,実地臨床において本検査を患者に提案する際には,実際に検査を受けた患者のうち治験に参加できる患者の割合は高くないこと,実際の患者の治験実施施設への通院などの負担にも配慮する必要がある。
CGP検査の詳細や注意点については,「次世代シークエンサー等を用いた遺伝子パネル検査に基づくがん診療ガイダンス」(日本臨床腫瘍学会,日本癌治療学会,日本癌学会),「大腸がん遺伝子関連検査等のガイダンス」(日本臨床腫瘍学会),「ゲノム診療用病理組織検体取り扱い規程」(日本病理学会:https://pathology.or.jp/genome_med/),「血中循環腫瘍DNAを用いたがんゲノムプロファイリング検査の適正使用に関する政策提言」(日本臨床腫瘍学会,日本癌治療学会,日本癌学会)等も参照のこと。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ26 | 4%(1/23) | 91%(21/23) | 0% | 0% | 4%(1/23) |
文献
- Doebele RC, Drilon A, Paz-Ares L, et al.; trial investigators: Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020; 21: 271-282
- Hong DS, DuBois SG, Kummar S, et al.: Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 2020; 21: 531-540
- Marabelle A, Fakih M, Lopez J, et al.: Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, openlabel, phase 2 KEYNOTE-158 study. Lancet Oncol 2020; 21: 1353-1365
- Ikegami M: Prognostic benefit of comprehensive genomic profiling in clinical practice remains uncertain. Cancer Sci 2023; 114: 3053-3055
CQ 27:大腸癌治癒切除後に多重がん(多発癌および重複がん)のサーベイランスは推奨されるか?
- 大腸癌切除症例における異時性大腸癌の発生頻度は一般集団より高く,定期的な大腸内視鏡検査を行うことを強く推奨する。(推奨度1・エビデンスレベルB,合意率:100%)
-
重複がんを標的とした術後サーベイランスの有効性は示されていないため,行わないことを弱く推奨する。(推奨度2・エビデンスレベルC,合意率:83%)
がん検診の必要性を啓発し,定期的な検診を勧めるのが妥当である。
※遺伝性大腸癌に対しては,適切なカウンセリングのもとに多重がんのサーベイランスを実施する必要がある(『遺伝性大腸癌診療ガイドライン』参照)1)。
大腸癌には,多発大腸癌,重複がんの高い発生リスクを有する遺伝性大腸癌がある。日常診療においては,遺伝性大腸癌を鑑別することが重要であり,遺伝性大腸癌に対しては適切なカウンセリングのもとに多重がんのサーベイランスを実施する必要がある(『遺伝性大腸癌診療ガイドライン』参照)1)。
一般的に,異時性大腸癌の発生頻度は1.5~3.0%とされる2-6)。これは一般集団と比較した場合の1.3~1.5倍と高く3-5,7,8),大腸癌罹患歴は異時性大腸癌の危険因子である。特に診断年齢が若年な症例や7,8)同時性多発癌を有する症例5)では,以後に発生する異時性大腸癌のリスクは高い。定期的な内視鏡検査により発見される異時性大腸癌の約90%が治癒切除可能であり2),異時性大腸癌を標的とした術後サーベイランスは予後の改善に有効と考えられる。
推奨される術後の大腸内視鏡検査のスケジュールは確立されたものがない9-11)。異時性大腸癌は術後3年以内の発見率が高い2,5,8,12)。近年報告された内視鏡サーベイランスのメタアナリシスでは,異時性大腸癌の発見率は術後3年までは0.63~0.74%であるのに対し,36カ月を超えて大腸癌が発見される頻度は,0.45%(術後37~48カ月),0.34%(49~60カ月),0.29%(85~96カ月)と漸減する6)。大腸癌の初回手術時に多発癌を合併する頻度は2~7%と比較的高いことから2,4),術後早期に発見される異時性大腸癌には術前検査で見逃した同時性大腸癌も含まれると考えられる。
術後初回の大腸内視鏡検査の至適施行時期は術前検査の質に左右されるが13),一般的には術後1年時の検査が推奨され11,12,14-16),術前に全大腸の観察が不能であった症例には,より早期の実施が望ましい11)。なお,前述の内視鏡サーベイランスのメタアナリシスでは,異時性大腸癌の3割が術後5年以降に発見されており6),再発を標的としたサーベイランスが終了した以降も異時性大腸癌の検診の必要性を啓発する必要がある。適切な検査手段や間隔は確立されておらず,個々の症例の年齢や身体的・社会的背景,患者自身の意思等を考慮する。
一方,重複がんを標的とするサーベイランスを散発性大腸癌症例に行うことの妥当性は十分に検証されていない。本邦における異時性重複がんの発生頻度は1~5%とされる4,17-22)。臓器別には,胃が最多であり(1~3%)4,17-21,23,24),肺や肝臓がこれに続くとする報告が多い4,18,24)。近年,大腸癌術後の重複がん発生頻度は一般集団の罹患率を上回る可能性を指摘する報告が増えている24-28)。しかしながら,散発性大腸癌症例における重複がんのサーベイランスの有効性を証明したコホート研究はない。前立腺癌29-32),子宮癌20,27,30-34),卵巣癌20,27,30,31,33),乳癌27,30),小腸癌25,31,32,34-36),女性の甲状腺癌20,31),胆管癌34),腎癌25),尿管癌25)などの発生頻度が高いとする報告があるが,多くは欧米からの報告であり,遺伝性大腸癌との関連も明確ではない。また,若年発症大腸癌の症例にリスクが高いという報告がある一方25,26,34),相反する結果の報告もあるなど28,37),重複がんの発症リスクに関しても統一した見解はない。直腸癌への放射線治療後の二次がんの増加については,近年ではこれを否定する研究結果が散見される38-40)。
以上から,重複がんのサーベイランスに関しては,医療経済的側面も考慮した検討が必要であり,重複がん発生リスクの評価基準の確立が急務であるが,現状では大腸癌術後に重複がんを標的とするサーベイランスを実施する根拠は乏しい。がん検診の必要性を啓発し22),定期的な検診を勧めるのが妥当である4,18,21,41)。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ27-① | 100%(23/23) | 0% | 0% | 0% | 0% |
| CQ27-② | 0% | 17%(4/23) | 83%(19/23) | 0% | 0% |
文献
- 大腸癌研究会編: 遺伝性大腸癌診療ガイドライン2024年版,金原出版,東京,2024
- Rex DK, Kahi CJ, Levin B, et al.: Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2006; 130: 1865-1871
- Green RJ, Metlay JP, Propert K, et al.: Surveillance for second primary colorectal cancer after adjuvant chemotherapy: an analysis of Intergroup 0089. Ann Intern Med 2002; 136: 261-269
- 石黒めぐみ,望月英隆,杉原健一,他.大腸癌に合併する多発癌・重複がんに関するフォローアップについて.日本大腸肛門病会誌2006; 59: 863-868
- Mulder SA, Kranse R, Damhuis RA, et al.: The incidence and risk factors of metachronous colorectal cancer: an indication for follow-up. Dis Colon Rectum 2012; 55: 522-531
- Fuccio L, Rex D, Ponchon T, et al.: New and Recurrent Colorectal Cancers After Resection: a Systematic Review and Meta-analysis of Endoscopic Surveillance Studies. Gastroenterol 2019; 156: 1309-1323
- Levi F, Randimbison L, Blanc-Moya R, et al.: High constant incidence of second primary colorectal cancer. Int J Cancer 2013; 132: 1679-1682
- Dasgupta P, Youlden DR, Baade PD: Multiple primary cancers among colorectal cancer survivors in Queensland, Australia, 1996-2007. Cancer Causes Control 2012; 23: 1387-1398
- Schmoll HJ, Van Cutsem E, Stein A, et al.: ESMO consensus guidelines for management of patients with colon and rectal cancer. a personalized approach to clinical decision making. Ann Oncol 2012; 23: 2479-2516
- Desch CE, Benson AB 3rd, Somerfield MR, et al.: Colorectal cancer surveillance: 2005 update of an American Society of Clinical Oncology practice guidelines. J Clin Oncol 2005; 23: 8512-8519
- National Comprehensive Cancer Network: NCCN clinical practice guidelines in oncology. Colon Cancer(version 2. 2023). http://www.nccn.org/professionals/physician_gls/pdf/colon.pdf(10 June 2023 accessed)
- Chen TA, Horng JT, Lin WC: Metachronous colorectal cancer in Taiwan: analyzing 20 years of data from Taiwan Cancer Registry. Int J Clin Oncol 2013; 18: 267-272
- Sakamoto T, Matsuda T, Nakajima T, et al.: How often should we perform surveillance colonoscopy after surgery for colorectal cancer? Int J Colorectal Dis 2013; 28: 835-840
- Gan S, Wilson K, Hollington P: Surveillance of patients following surgery with curative intent for colorectal cancer. World J Gastroenterol 2007; 13: 3816-3823
- Arditi C, Gonvers JJ, Burnand B, et al.: Appropriateness of colonoscopy in Europe(EPAGE Ⅱ). Surveillance after polypectomy and after resection of colorectal cancer. Endoscopy 2009; 41: 209-217
- van Lanschot MCJ, van Leerdam ME, Lansdorp-Vogelaar I, et al.: Yield of surveillance colonoscopies 1 year after curative surgical colorectal cancer resections. Clin Gastroenterol Hepatol 2019; 17: 2285-2293
- 甲斐俊吉,小泉浩一,今里 真,他.大腸癌切除後の異時性重複癌について 大腸と他臓器との重複癌の検討.外科1995; 57: 1300-1305
- 万井真理子,吉川宣輝,西庄 勇,他.大腸重複癌の臨床病理学的検討.日本大腸肛門病会誌2000; 53: 540-546
- 塩澤学,土田知史,菅野伸洋,他.大腸癌における多臓器重複癌の検討.日消外会誌2007; 40: 1557-1564
- Tanaka H, Hiyama T, Hanai A, et al.: Second primary cancers following colon and rectal cancer in Osaka, Japan. Jpn J Cancer Res 1991; 82: 1356-1365
- 寺本龍生,渡邊昌彦,北島政樹.大腸癌二次発癌のサーベイランスと対策.消化器癌1997; 7: 169-172
- Tsukuma H, Fujimoto I, Hanai A, et al.: Incidence of second primary cancers in osaka residents, Japan, with special refernece ot cumulative and relative risks. Jpn J Cancer Res 1994; 85: 339-345,
- Ueno M, Muto T, Oya M, et al.: Multiple primary cancer: an experience at the Cancer Institute Hospital with special reference to colorectal cancer. Int J Clin Oncol 2003; 8: 162-167
- Noura S, Ohue M, Seki Y, et al.: Second primary cancer in patients with colorectal cancer after a curative resection. Dig Surg 2009; 26: 400-405
- Yang J, Li S, Lv M, et al.: Risk of subsequent primary malignancies among patients with prior colorectal cancer: a population-based cohort study. Onco Targets Ther 2017; 10: 1535-1548
- Feller A, Matthes KL, Bordoni A, et al.; NICER Working Group: The relative risk of second primary cancers in Switzerland: a population-based retrospective cohort study. BMC Cancer 2020; 20: 51
- Shin DW, Choi YJ, Kim HS, et al.: Secondary Breast, Ovarian, and Uterine Cancers After Colorectal Cancer: A Nationwide Population-Based Cohort Study in Korea. Dis Colon Rectum 2018; 61: 1250-1257
- Jia H, Li Q, Yuan J, et al.: Second Primary Malignancies in Patients with Colorectal Cancer: A Population-Based Analysis. Oncologist 2020; 25: e651-e658
- Yamamoto S, Yoshimura K, Ri S, et al.: The risk of multiple primary malignancies with colorectal carcinoma. Dis Colon Rectum 2006; 49: S30-S36
- Hoar SK, Wilson J, Blot WJ, et al.: Second cancer following cancer of the digestive system in Connecticut, 1935-82. Natl Cancer Inst Monogr 1985; 68: 49-82
- McCredie M, Macfarlane GJ, Bell J, et al.: Second primary cancers after cancers of the colon and rectum in New South Wales, Australia, 1972-1991. Cancer Epidemiol Biomarkers Prev 1997; 6: 155-160
- Armed F, Goodman MT, Kosary C, et al.: Excess risk of subsequent primary cancers among colorectal carcinoma survivors, 1975-2001. Cancer 2006; 107: 1162-1171
- Lynge E, Jensen OM, Carstensen B: Second cancer following cancer of the digestive system in Denmark, 1943-80. Natl Cancer Inst Monogr 1985; 68: 277-308
- He X, Wu W, Ding Y, et al.: Excessive risk of second primary cancers in young-onset colorectal cancer survivors. Cancer Med 2018; 7: 1201-1210
- Buiatti E, Crocetti E, Acciai A, et al.: Incidence of second primary cancers in three Italian population-based cancer registries. Eur J Cancer 1997; 33: 1829-1834
- Evans HS, Møller H, Robinson D, et al.: The risk of subsequent primary cancers after colorectal cancer in southeast England. Gut 2002; 50: 647-652
- Halamkova J, Kazda T, Pehalova L, et al.: Second primary malignancies in colorectal cancer patients. Sci Rep 2021; 11: 2759
- Kendal WS, Nicholas G. A population-based analysis of second primary cancers after irradiation for rectal cancer. Am J Clin Oncol 2007; 30: 333-339
- Wiltink LM, Nout RA, Fiocco M, et al.: No Increased Risk of Second Cancer After Radiotherapy in Patients Treated for Rectal or Endometrial Cancer in the Randomized TME, PORTEC-1, and PORTEC-2 Trials. J Clin Oncol 2015; 33: 1640-1646
- Rombouts AJM, Hugen N, Elferink MAG, et al.: Incidence of second tumors after treatment with or without radiation for rectal cancer. Ann Oncol 2017; 28: 535-540
- 島谷英彦,藤井久男,小山文一,他.大腸他臓器重複癌症例の検討.日本大腸肛門病会誌2003; 56: 294-298
CQ 28:肛門管扁平上皮癌に対して化学放射線療法は推奨されるか?
遠隔転移を認めない肛門管扁平上皮癌患者に対して,化学放射線療法を行うよう強く推奨する。(推奨度1・エビデンスレベルA,合意率:100%)
肛門管扁平上皮癌に対して,根治切除と放射線治療単独,または化学放射線療法とを直接比較した臨床試験は行われていないが,肛門管扁平上皮癌の高い放射線感受性により1),化学放射線療法は標準治療として位置づけられる。
遠隔転移を有さない肛門管扁平上皮癌に対して,放射線治療単独と化学放射線療法を比較したUKCCCR ACT Ⅰ trialでは,化学放射線療法群で,治療後12年の局所再発が25.3%(95%信頼区間17.5-32.0),人工肛門造設または死亡リスクが低減した(ハザード比0.76,95%信頼区間0.63-0.91,p=0.004)2,3)。同様に,T3-4N0-3またはT1-2N1-3の肛門管扁平上皮癌を対象に,放射線治療単独と化学放射線療法を比較したEORTC 22861試験では,化学放射線療法群で,5年の局所制御率や無人工肛門造設生存率をそれぞれ18%,32%改善した4)。これらの臨床試験で,化学療法を併用する上乗せ効果が証明された。
併用化学療法の探索としては,5-FU単独と5-FU+MMC併用療法を比較した第Ⅲ相試験が実施され,4年時点での全生存率には有意差を認められなかったものの,人工肛門造設率(22% vs. 9%,p=0.002),無人工肛門造設生存率(59% vs. 71%,p=0.014),無病生存率(51% vs. 73%,p=0.0003)は有意にMMC併用群で良好であり,5-FU+MMC併用が標準レジメンとして確立された5)。なお,血液関連有害事象はMMC併用群で有意に高頻度に認めた。
血液関連有害事象が高頻度となるMMCの代替としてのCisplatin(CDDP)の有用性に関しては様々な検討が行われており6-12),化学放射線療法において,5-FU+MMC併用療法に対する5-FU+CDDP併用療法の完全奏効割合における有用性,および5-FU+CDDPによる維持療法の3年無増悪生存率における有用性を検証した第Ⅲ相試験(ACTⅡ試験)において,5-FU+CDDP併用療法(完全奏効割合90.5% vs. 89.6%,p=0.64),および維持療法(3年無増悪生存率74% vs. 73%,p=0.70)の有用性を示すことができなかった6)。また,5-FU+MMC併用療法に対する,5-FU+CDDP併用導入療法に続く5-FU+CDDP併用化学放射線療法の有用性を検証した第Ⅲ相試験(RTOG98-11試験)において,主要評価項目の無増悪生存期間の有用性を示すことができず8),長期成績では5年無増悪生存率(67.8% vs. 57.8%,p=0.006),全生存率(78.3% vs. 70.7%;p=0.026)はMMC併用群で有意に良好であった9)。これら2試験の結果より併用薬剤は5-FU+MMCが推奨され,MMCの使用が難しい場合は5-FU+CDDP併用療法を実施することは許容されると考える。5-FUをcapecitabineやS-1に置き換える検討も行われており,第Ⅱ相試験では有望な成績が報告されているが13-15),第Ⅲ相試験での検証は行われておらず,今後の検討が期待される。
アジア人に対して安全に遂行可能な併用薬剤(5-FU+MMC)の至適容量を確認した本邦の第Ⅱ相試験(JROSG10-2試験)では,5-FUの投与量を800 mg/m2/dayに減量した。国内でのMMCの供給停止のため予定登録数に達しなかったが,31例の解析で2年無病生存率77.4%,2年全生存率93.5%,2年局所制御率83.9%と良好な成績であり,重篤な有害事象は発生しなかった16)。一方,本邦でも近年,欧州と同用量の5-FU(1,000 mg/m2/day)を併用した報告もあり17),安全性や有効性に配慮しながら,治療スケジュールを決定する必要がある。
近年,照射技術の進歩により,腫瘍への高い線量集中性を維持しながら,正常臓器への線量低減を可能とする強度変調放射線治療(IMRT)が日常臨床で用いられるようになり,RTOG0529試験において肛門管扁平上皮癌に対するIMRTの有用性が検証され,Grade 3以上の急性期皮膚/消化管有害事象,およびGrade 2以上の血液毒性の発生率が低減したことを示した。しかしIMRTは,通常照射法と比べ複雑な治療計画や高い位置精度管理を要するため,実施には経験のあるスタッフや施設の下で行うことが求められる18,19)。
化学放射線療法により大部分の症例で肛門括約筋温存が可能となるため,初回治療としての直腸切断術(APR)の役割は乏しい。大腸癌研究会による遡及的な多施設の調査研究では,病期毎の5年全生存率は手術と化学放射線療法で差を認めなかった。また,化学放射線療法,放射線治療,化学療法が選択された比率は,1991~2000年では14.3%であったのに対し,2011~2015年では84.3%とその比率は増加している20)。現時点では,化学放射線療法後の残存や再発症例に対して選択される。化学放射線療法後の残存や再発症例のAPRに関するシステマティックレビューでは,APR後の局所再発率は23.5%(IQR 15.8-46.9%,19試験),遠隔転移の発生を9.0%(IQR 6.4-13.3%,16試験)に認めた21)。なお,化学放射線治療後の効果判定時期は,化学放射線療法終了後8~12週が推奨されているが,ACTⅡ試験の追加解析にて,臨床的完全奏効割合は時間経過とともに上昇し,化学放射線療法開始後11週の時点で臨床的完全奏効割合でなかった症例の72%が26週時に臨床的完全奏効割合に達したと報告されており,救済手術の要否判断時には考慮すべき結果と考える22)。
Ⅰ期の肛門管扁平上皮癌に対する放射線治療単独と化学放射線療法の治療成績を検討したシステマティックレビューでは,5年全生存率は化学放射線療法で良好だったが(リスク比1.18,95%信頼区間1.10-1.26,p<0.00001),無病生存率に有意差を認めなかった(リスク比1.01,95%信頼区間0.92-1.11,p=0.87)。5年無人工肛門生存率は放射線治療単独で84%(95%信頼区間72-92%),化学放射線療法で90%(95%信頼区間85-94%)であり,有意差を認めなかった(p=0.1)23)。また,Ⅰ期肛門管扁平上皮癌に対する化学放射線療法と局所切除による治療成績を検討したシステマティックレビューでは,5年全生存率は化学放射線療法,局所切除を施行した症例で,85.0~91.6%,85.3~100%と明らかな差は示されなかった24)。以上から,Ⅰ期肛門管扁平上皮癌に対して化学放射線療法を行うことが望ましいと考えられるが,併用化学療法の遂行可否や腫瘍径,分化度などにより放射線治療単独や局所切除も選択肢となり得る。
投票結果
| 推奨度 | 行うことを | 行わないことを | 推奨度なし | ||
|---|---|---|---|---|---|
| 強く推奨する | 弱く推奨する | 弱く推奨する | 強く推奨する | ||
| CQ28 | 100%(22/22) | 0% | 0% | 0% | 0% |
文献
- Leichman L, Nigro N, Vaitkevicius VK, et al.: Cancer of the anal canal. Model for preoperative adjuvant combined modality therapy. Am J Med 1985; 78: 211-215
- UKCCCR Anal Cancer Trial Working Party: Epidermoid anal cancer: results from the UKCCCR rendomised trial of radiotherapy alone versus radiotherapy, 5-fluorouracil, and mitomycin. Lancet 1996; 348: 1049-1054
- Northover J, Glynne-Jones R, Sebeg-Montefiore D, et al.: Chemoradiation for the treatment of epidermoid anal cancer: 13-year follow-up of the first randomized UKCCCR Anal Cancer Trial(ACTⅠ). Br J Cancer 2010; 102: 1123-1128
- Bartelink H, Roelofsen F, Eschwege F, et al.: Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase Ⅲ randomized trial of the European Organization for Research and Treatment of Cancer Radiotherapy and Gastrointestinal Cooperative Groups. J Clin Oncol 1997; 15: 2040-2049
- Flam M, John M, Pajak TF, et al.: Role of mitomycin in combination with fluorouracil and radiotherapy, and of salvage chemoradiation in the definitive nonsurgical treatment of epidermoid carcinoma of the anal canal: results of a phase Ⅲ randomized intergroup study. J Clin Oncol 1996; 14: 2527-2539
- James RD, Glynne-Jones R, Meadows HM, et al.: Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus(ACT Ⅱ): a randomized, phase 3, open-label, 2×2 factorial trial. Lancet Oncol 2013; 14: 516-524
- Glynne-Jones R, Kadalayil L, Meadows HM, et al.: Tumor- and treatment- related colostomy rates following mitomycin C or cisplatin chemoradiation with or without maintenance chemotherapy in squamous cell carcinoma of the anus in the ACT Ⅱ trial. Ann Oncol 2014; 25: 1616-1622
- Ajani JA, Winter KA, Gunderson LL, et al.: Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial. JAMA 2008; 299: 1914-1921
- Gunderson LL, Winter KA, Ajani JA, et al.: Long-term update of US GI intergroup RTOG 98-11 phase Ⅲ trial for anal carcinoma: survival, relapse, and colostomy failure with concurrent chemoradiation involving fluorouracil/mitomycin versus fluorouracil/cisplatin. J Clin Oncol 2012; 30: 4344-4351
- Ajani JA, Winter KA, Gunderson LL, et al.: US intergroup anal carcinoma trial: tumor diameter predicts for colostomy. J Clin Oncol 2009; 27: 1116-1121
- Chakravarthy AB, Catalano PJ, Martenson JA, et al.: Long-term follow-up of high-dose radiation with concurrent 5-fluorouracil and cisplatin in patients with anal cancer(ECOG E4292). Int J Radiat Oncol Biol Phys 2011; 81: e607-e613
- Holliday EB, Morris VK, Johnson B, et al.: Definitive Intensity-Modulated Chemoradiation for Anal Squamous Cell Carcinoma: Outcomes and Toxicity of 428 Patients Treated at a Single Institution. Oncologist 2022; 27: 40-47
- Glynne-Jones R, Meadows H, Wan S, et al.: EXTRA-a multicenter phase Ⅱ study of chemoradiation using a 5 day per week oral regimen of capecitabine and intravenous mitomycin C in anal cancer. Int J Radiat Oncol Biol Phys 2008; 72: 119-126
- Olivera SCR, Moniz CMV, Riechelmann R, et al.: Phase Ⅱ study of capecitabine in substitution of 5-FU in the chemoradiotherapy regimen for patients with localized squamous cell carcinoma of the anal canal. J Gastrointest Cancer 2016; 47: 75-81
- Ito Y, Hamaguchi T, Takashima A, et al.; Colorectal Cancer Study Group of the Japan Clinical Oncology Group: Definitive S-1/mitomycin-C chemoradiotherapy for stage Ⅱ/Ⅲ anal canal squamous cell carcinoma: a phase Ⅰ/Ⅱ dose-finding and single-arm confirmatory study(JCOG0903). Int J Clin Oncol. 2023; 28: 1063-1072
- Murofushi KN, Itasaka S, Shimokawa M, et al.: A phase Ⅱ study of concurrent chemoradiotherapy with 5-fluorouracil and mitomycin-C for squamous cell carcinoma of the anal canal(the JROSG 10-2 trial). J Radiat Res 2023; 64: 154-161
- Tachibana I, Nishimura Y, Inaba M, et al.: Definitive chemoradiotherapy for anal canal cancer: single-center experience. Int J Clin Oncol 2018; 23: 1121-1126
- Kachnic LA, Winter K, Myerson RJ, et al.: RTOG 0529: a phase 2 evaluation of dose-painted intensity modulated radiation therapy in combined with 5-fluorouracil and mitomycin-C for the reduction of acute morbidity in carcinoma of the anal canal. Int J Radiat Oncol Biol Phys 2013; 86: 27-33
- Kachnic LA, Winter KA, Myerson RJ, et al.: Long-Term Outcomes of NRG Oncology/RTOG 0529: A Phase 2 Evaluation of Dose-Painted Intensity Modulated Radiation Therapy in Combination With 5-Fluorouracil and Mitomycin-C for the Reduction of Acute Morbidity in Anal Canal Cancer. Int J Radiat Oncol Biol Phys 2022; 112: 146-157
- Yamada K, Shiraishi K, Takashima A, et al.: Characteristics of anal canal squamous cell carcinoma as an HPV-associated cancer in Japan. Int J Clin Oncol 2023; 28: 990-998
- Ko G, Sarkaria A, Merchant SJ, et al.: A systematic review of outcomes after salvage abdominoperineal resection for persistent or recurrent anal squamous cell cancer. Colorectal Dis 2019; 21: 632-650
- Glynne-Jones R, Sebag-Montefiore D, Meadows HM, et al.; ACT Ⅱ study group: Best time to assess complete clinical response after chemoraiotherapy in squamous cell carcinoma of the auns(ACT Ⅱ): a post-hoc analysis of randomized controlled phase 3 trial. Lancet Oncol 2017; 18: 347-356
- Werner RN, Gaskins M, Valle GA, et al.: State of the art treatment for stage Ⅰ to Ⅲ anal squamous cell carcinoma: a systematic review and meta-analysis. Radiother Oncol 2021; 157: 188-196
- Portale G, Parotto M, Pozza A, et al.: Chemoradiation vs. local excision in the management of early squamous cell carcinoma of the anus: a systematic review. Int J Colorectal Dis 2022; 37: 1937-1944









