
各論
1 Stage 0~Stage Ⅲ大腸癌の治療方針
1)内視鏡治療
〔cTis癌またはcT1癌の治療方針〕
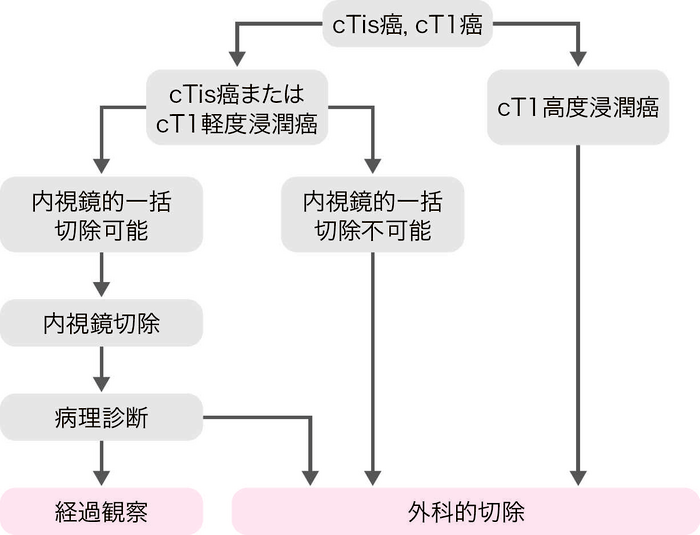
適応の原則
- リンパ節転移の可能性がほとんどなく,腫瘍が一括切除できる大きさと部位にある。
内視鏡切除の適応基準
- (1)
- 粘膜内癌,粘膜下層への軽度浸潤癌。
- (2)
- 大きさは問わない。
- (3)
- 肉眼型は問わない。
- 本法は内視鏡的に大腸の病巣部を切除し,切除組織を回収する方法である。
- 治療法にはスネアポリペクトミー(ポリペクトミー)1)注1,内視鏡的粘膜切除術(EMR:endoscopic mucosal resection)2,3)注2とEMRの亜型であるunderwater EMR(UEMR)4)注2,内視鏡的粘膜下層剝離術(ESD:endoscopic submucosal dissection)3,5)注3,また,ESDの亜型としてprecutting EMR6)注4,hybrid ESD6)注5がある。
- 内視鏡治療の適応と治療法を決める際には,腫瘍の大きさ,予測壁深達度,肉眼形態および発育進展分類であるLST亜分類に関する情報が不可欠である。
注1 ポリペクトミー
病巣茎部にスネアをかけて高周波電流によって焼灼切除する方法。主として隆起型病変に用いられる。最近,高周波電流を使用しないコールドポリペクトミーという手技が主に1 cm未満の腫瘍に適用されるようになったが,本手技は,深部断端が十分確保されないため癌は適応にならない。したがって術前の拡大観察による質的診断(腺腫,SSLと癌の鑑別)が重要である。
注2 EMR
粘膜下層に生理食塩水などを局注して病巣を挙上させ,ポリペクトミーの手技により焼灼切除する方法。スネア法1),吸引キャップ法(EMRC)2)などがある。主として表面型腫瘍や大きな無茎性病変に用いられる。
局注の代わりに浸水下(生食)で浮力を利用する方法がunderwater EMR(UEMR)4)である。
注3 ESD
病変周囲,粘膜下層にヒアルロン酸ナトリウム溶液などを局注して病巣を挙上させ,専用のナイフで病変周辺の切開,粘膜下層の剝離を進め腫瘍を一括切除する手技である3)。主として,EMRで一括切除できない大きな腫瘍,特に早期癌が適応である。
注4 precutting EMR
ESD用ナイフあるいはスネア先端を用いて病変周囲切開後,粘膜下層の剝離を全く行わずにスネアリングを施行する手技6)。
注5 hybrid ESD
ESD専用ナイフあるいはスネア先端を用いて病変周囲切開後,粘膜下層の剝離操作を行い,最終的にスネアリングを施行する手技6)。
コメント
- 内視鏡切除の目的には診断と治療の両面がある。本法は切除生検(excisional biopsy)であり,切除標本の組織学的検索によって治療の根治性と外科的追加腸切除の必要性を判定する。(CQ 1)
- cT1高度浸潤癌の診断指標として,「緊満感,びらん,潰瘍,ヒダ集中,変形・硬化像」などの内視鏡所見,X線造影検査,色素内視鏡観察,NBI/BLIなどの画像強調観察7),拡大内視鏡観察,超音波内視鏡検査所見などを参考にする8-12)。
-
内視鏡切除後の治療方針の決定に際しては,切除標本の緻密な組織学的検索が必須である。そのため,下記の点に留意する。
- ポリペクトミー標本では切除断端に墨汁などによるマーキングを施し,切除断端を含む最大割面を観察する。
- EMR標本やESD標本では切除標本を伸展固定し,粘膜筋板と垂直な割面を作製する。
- 治療内容(切除法,併用療法の有無,一括切除か分割切除か,その選択理由など)と切除標本の肉眼所見を記載することが望ましい。
-
切除断端および最深部の癌浸潤状況を正確に診断するには,一括切除が必須である。
- スネアポリペクトミーやEMRで無理なく一括切除できる限界は20 mmである3)。
- 大腸のESDは,2012年4月に「早期悪性腫瘍」に対して保険適用が認可された「大きさにかかわらず一括切除が可能な内視鏡切除手技」であるが,技術的難易度が高く偶発症(穿孔)の危険性が高いので,施行術者の技量を考慮して施行する。径20~50 mmまでの病変が保険適用になっていたが,2018年4月の改訂で腫瘍径の上限が撤廃され,最大径20 mm以上の早期大腸癌および20 mm以下でも線維化を伴う早期大腸癌が適応となった。
- 吸引キャップ法(EMRC)は,結腸病変に用いると穿孔の危険性が高いとする報告がある。
- 術前診断で腺腫に伴う癌(粘膜内癌)と確信できれば癌部の分断を避け腺腫部分に関しての分割切除を行ってもよいが,一般的に分割切除では不完全切除率が高く,局所再発率が高いことに留意する。また正確な組織学的判定が困難となるような多分割切除は避けるべきである3)。
また費用対効果においても,サーベイランスを考慮するとESDが分割切除より優れている可能性も報告14)されており,適切な術者であれば,腺腫に伴う癌(粘膜内癌)に対しても分割切除よりESDを選択することが多くなっている。 -
内視鏡切除後は,切除局所を詳細に観察し遺残病変の有無を確認する。
- 遺残病変の診断には色素撒布・拡大観察が有用である10)。
- 粘膜内病変の遺残があれば内視鏡的追加切除を行う。
- 内視鏡治療後の経過観察15,16,18)
2)手術治療
〔cStage 0~cStageⅢ大腸癌の手術治療方針〕
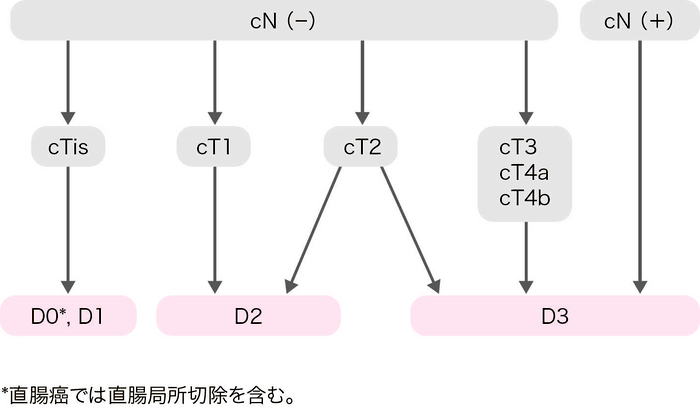
手術の原則
- 大腸癌手術におけるリンパ節郭清度は,術前の臨床所見(c)および術中所見(s)によるリンパ節転移の有無と腫瘍の壁深達度から決定する。
- 術前・術中診断でリンパ節転移を認める,または疑う場合は,D3郭清を行う19)。
- 術前・術中診断でリンパ節転移を認めない場合は,壁深達度に応じたリンパ節郭清を行う。
- 直腸癌における側方郭清の適応については,CQ 10を参照。
直腸癌の手術治療
- 直腸切除の原則は,TME(total mesorectal excision)またはTSME(tumor-specific mesorectal excision)である22-25)。
- 腫瘍学的に遺残のない切除(肛門側切離端・外科剝離面ともに陰性=DM0,RM0)が可能であること,術後の肛門機能が保たれることが,括約筋温存の適応の必要条件である。
- 癌の進行度,肉眼的な神経浸潤の有無などを考慮して,根治性を損なわない範囲で,排尿機能,性機能温存のため自律神経の温存に努める。
- 側方郭清の適応基準は,腫瘍下縁が腹膜反転部より肛門側にあり,かつ壁深達度がT3以深の症例である26)。(CQ 10)
腹腔鏡下手術
- 腹腔鏡下手術の適応は,癌の部位や進行度などの腫瘍側要因および肥満,開腹歴などの患者側要因だけでなく,術者の経験,技量を考慮して決定する。
- 本邦で行われたランダム化比較試験であるJCOG0404試験27)のサブグループ解析ではRS,cN2,肥満例やT4にて腹腔鏡下手術の予後が悪い傾向が認められたこと等から,これらを考慮して慎重に適応を決定する必要がある。
- 単孔式手術などポート数を減らした腹腔鏡下手術も試みられているが,多数例を検討した報告はなく,その有効性と安全性は十分に確立されていない。
ロボット支援手術
- ロボット支援手術は,2018年4月から直腸癌に対して,また,2022年4月からは結腸癌に対して,保険適用となっている。大腸癌に対するロボット支援手術の導入にあたっては,日本内視鏡外科学会等の定める術者条件・施設条件を遵守する必要がある。(CQ 3)
周術期薬物療法
- R0切除が行われたpStage Ⅲ大腸癌,再発リスクが高いpStage Ⅱ大腸癌では,術後補助化学療法を考慮する。(「1)補助化学療法」参照)(CQ 6,CQ 7)
- 切除可能な直腸癌に対する,薬物療法,放射線療法,またはそれらを組み合わせた周術期治療の有効性・安全性が検討されている。(「6.放射線療法」参照)(CQ 11,CQ 12)
コメント
〔切離腸管長〕- D1,D2,D3郭清では,『大腸癌取扱い規約』に定める腸管傍リンパ節が郭清されるよう,切離腸管長を決定する。
- 結腸癌における腸管傍リンパ節の範囲は,腫瘍と支配動脈の位置関係によって定義されるが,結腸癌において,腫瘍辺縁から10 cm以上離れた腸管傍リンパ節の転移は稀である。大腸癌研究会プロジェクト研究における多施設前向きコホート研究において,2,996例のpStage Ⅰ~Ⅲ結腸癌切除例を検討した結果,腫瘍辺縁から10 cm以上離れた腸管傍リンパ節の転移は4例(0.1%)のみであった。また,腫瘍と支配動脈の位置関係によって,転移リンパ節の分布に違いを認めなかった28)。
- 直腸癌における腸管傍リンパ節の範囲は,口側は最下S状結腸動脈流入点,肛門側は腫瘍辺縁からの距離によって定義される。cStage 0~cStage Ⅲの症例では,RS癌およびRa癌で3 cm以上,Rb癌で2 cmを超える直腸壁内および間膜内の肛門側進展は稀である29-32)ことから,切離腸管長および直腸間膜の切離長は,この範囲を含む遠位(肛門側)切離端を確保することを目安に決定する。
- pT4,pN2,M1(Stage Ⅳ),低分化な組織型の直腸癌症例では,肛門側進展を有する頻度が高く,進展距離が長い傾向があることに留意する28,30-32)。
- 直腸間膜全切除(TME)とは肛門管直上までの直腸間膜をすべて切除する術式である22)。TSMEとは腫瘍の位置に応じた直腸間膜を部分的に切除する術式である25)。
- 括約筋間直腸切除術(ISR:intersphincteric resection)は,肛門に近い下部直腸癌に対し,内肛門括約筋を合併切除することにより肛門側切離端を確保し,永久人工肛門を回避する術式である。
- 適応の原則は,①外科剝離面の確保が可能であること(外肛門括約筋・肛門挙筋への浸潤が無いこと),②肛門側切離端の確保が可能であること(T2・T3では2 cm以上,T1では1 cm以上を基準とするのが一般的)である。低分化な組織型の症例や,肛門括約筋のトーヌスが低下している症例は適応から除外することが望ましい。
- 大腸癌研究会のアンケート調査による2,125例の検討では,5年生存率は大腸癌全国登録の下部直腸癌症例と同等であったが,5年局所再発率(吻合部再発含む)は11.5%と比較的高率であり,壁深達度が深くなるにつれ局所再発率は明らかに高くなる(T1で4.2%,T2で8.5%,T3で18.1%,T4で36.0%33))ことが報告されている。
- 肛門括約筋の切除範囲が広くなるにしたがって便失禁などの術後排便機能の低下が問題となる。特に術前放射線療法施行例,縫合不全例,高齢者では排便機能低下の頻度が高いことが報告されている34-37)。
- 経肛門的直腸間膜全切除(TaTME:Transanal TME)は,肛門側から単孔式内視鏡手術デバイスを用いて直腸間膜の剝離・授動操作を逆行性に行う術式である。
- 腹腔側からの視野が取りにくい狭骨盤や肥満患者などにおいて,剝離層を確認しやすいこと,肛門側の腸管切離ラインを直視下に決定できること等の利点がある。一方で,尿道,自律神経,腸管などの術中損傷,腫瘍の肛門側を閉鎖するpurse-string sutureの破綻による術野汚染や腫瘍細胞の散布による局所再発などのリスクがある。
- TaTMEと通常の腹腔鏡下手術で局所再発率に差はなかった(TaTME症例で3.5%,腹腔鏡下手術症例で2.2%)とする非ランダム化試験のメタアナリシスの報告がある38)。一方,ノルウェーにおけるレジストリデータ解析では,TaTMEで高い局所再発率(9.5%)が報告されており,ノルウェーではTaTMEを推奨しないとの勧告が出されている39)。技術的な難易度が高く,手技に習熟した術者・施設に限定して行われるべき術式である。
- 直腸癌手術に関連した自律神経系には,腰内臓神経*,上下腹神経叢*,下腹神経*,骨盤内臓神経#,骨盤神経叢がある。(*交感神経,#副交感神経)
- 排尿機能については,片側の骨盤神経叢が温存されれば〔AN1~4〕一定の機能は維持される。
- 下腹神経は射精機能を,骨盤内臓神経は勃起機能を司る。男性性機能の維持には両側の自律神経系の全温存〔AN4〕が必要である。
- 側方郭清の施行の有無に関わらず,自律神経系を全温存しても排尿機能や男性性機能が障害されることがある点に留意する40-42)。
- 第2 Houston弁(腹膜反転部)より肛門側にあるcTis癌,cT1癌(軽度浸潤)が主な対象となる。
- 直腸局所切除のアプローチ法は経肛門的切除,経括約筋的切除,傍仙骨的切除に分類される43)。
- 経肛門的切除には,直視下に切除・縫合する方法と経肛門的内視鏡下切除術がある44)。直視下に切除・縫合する方法には,用手的に切除・縫合する従来法と,自動縫合器を用いる方法45)がある。
- 直腸局所切除の目的には診断と治療の両面がある。本法は切除生検(excisional biopsy)であり,切除標本の組織学的検索によって,治療の根治性と追加治療(リンパ節郭清を伴う腸切除)の必要性を判定する。判定基準は,「CQ 1:内視鏡切除されたpT1大腸癌の追加治療の適応基準は何か?」の基準に準ずる。
- 表3,表4,表5に組織学的壁深達度別のリンパ節転移度,Stage別の治癒切除率,5年生存率を示した20)。
- pStage 0~pStage Ⅲの治癒切除例の5年生存率は,全症例では82.2%,結腸癌では83.8%,RS癌では81.7%,Ra・Rb癌では79.3%であった(2000~2004年症例)。
文献
- Kudo S: Endoscopic mucosal resection of flat and depressed types of early colorectal cancer. Endoscopy 1993; 25: 455-461
- 井上晴洋,竹下公矢,遠藤光夫,他: 早期胃癌に対する内視鏡的粘膜切除術―透明プラスチックキャップを用いる方法(EMRC)―.Gastroenterol Endosc 1993; 35: 600-607
- Tanaka S, Oka S, Chayama K: Colorectal endoscopic submucosal dissection: the present status and future perspective including its differentiation from endoscopic mucosal resection. J Gastroenterol 2008; 43: 641-651
- Binmoeller KF, Weilert F, Shah J, et al.: “Underwater”EMR without submucosal injection for large sessile colorectal polyps(with video). Gastrointest Endosc 2012; 75: 1086-1091
- Tanaka S, Kashida H, Saito Y, et al.: JGES guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Dig Endosc 2015; 27: 417-434
- 田中信治,樫田博史,斎藤 豊,他: 大腸ESD/EMRガイドライン 第2版.Gastroenterol Endosc 2019; 61: 1321-1344
- Iwatate M, Sano Y, Tanaka S, et al.: Validation study for development of the Japan NBI Expert Team classification of colorectal lesions. Dig Endosc 2018; 30: 642-651
- Saitoh Y, Obara T, Watari J, et al.: Invasion depth diagnosis of depressed type early colorectal cancers by combined use of videoendoscopy and chromoendoscopy. Gastrointest Endosc 1998; 48: 362-370
- Watari J, Saitoh Y, Obara T, et al.: Early nonpolypoid colorectal cancer: radiographic diagnosis of depth of invasion. Radiology 1997; 205: 67-74
- Tanaka S, Kaltenbach T, Chayama K, et al.: High-magnification colonoscopy(with videos). Gastrointest Endosc 2006; 64: 604-613
- 浜本順博,平田一郎,安本真悟,他: 早期大腸癌における浸潤度の臨床診断精度―超音波内視鏡を中心に.胃と腸2004; 39: 1375-1386
- Ikehara H, Saito Y, Matsuda T, et al.: Diagnosis of depth of invasion for early colorectal cancer using magnifying colonoscopy. J Gastroenterol Hepatol 2010; 25: 905-912
- Ohata K, Kobayashi N, Sakai E, et al.: Long-term Outcomes After Endoscopic Submucosal Dissection for Large Colorectal Epithelial Neoplasms: A Prospective, Multicenter, Cohort Trial From Japan. Gastroenterology 2022; 163: 1423-1434.e2
- Sekiguchi M, Igarashi A, Mizuguchi Y, et al.: Cost-effectiveness analysis of endoscopic resection for colorectal laterally spreading tumors: Endoscopic submucosal dissection versus piecemeal endoscopic mucosal resection. Dig Endosc 2022; 34: 553-568
- 若村邦彦,工藤進英,竹村織江,他: 大腸腺腫・早期癌の内視鏡切除後のfollow up.胃と腸2007; 42: 1453-1457
- 浦上尚之,五十嵐正広,千野晶子,他: 大腸SM癌の内視鏡切除後のfollow up―サーベイランスに向けて(局所再発,転移再発).胃と腸2007; 42: 1470-1476
- Oka S, Tanaka S, Kanao H, et al.: Mid-term prognosis after endoscopic resection for submucosal colorectal carcinoma: summary of a multicenter questionnaire survey conducted by the colorectal endoscopic resection standardization implementation working group in Japanese Society for Cancer of the Colon and Rectum. Dig Endosc 2011; 23: 190-194
- Saito Y, Oka S, Kawamura T, et al.: Colonoscopy screening and surveillance guidelines. Dig Endosc 2021; 33: 486-519.
- Kotake K, Mizuguchi T, Moritani K, et al.: Impact of D3 lymph node dissection on survival for patients with T3 and T4 colon cancer. Int J Colorectal Dis 2014; 29: 847-852
- Japanese Society for Cancer of the Colon and Rectum: Multi-Institutional Registry of Large Bowel Cancer in Japan. Cases treated in 2000-2002. Vol. 29(2011), Cases treated in 2003-2004. Vol. 30(2012)
- Kotake K, Kobayashi H, Asano M, et al.: Influence of extent of lymph node dissection on survival for patients with pT2 colon cancer. Int J Colorectal Dis 2015; 30: 813-820
- Heald RJ, Husband EM, Ryall RD: The mesorectum in rectal cancer surgery―the clue to pelvic recurrence? Br J Surg 1982; 69: 613-616
- MacFarlane JK, Ryall RD, Heald RJ: Mesorectal excision for rectal cancer. Lancet 1993; 341: 457-460
- Enker WE, Thaler HT, Cranor ML, et al.: Total mesorectal excision in the operative treatment of carcinoma of the rectum. J Am Coll Surg 1995; 181: 335-346
- Lowry AC, Simmang CL, Boulos P, et al.: Consensus statement of definitions for anorectal physiology and rectal cancer: report of the Tripartite Consensus Conference on Definitions for Anorectal Physiology and Rectal Cancer, Washington, D. C., May 1, 1999. Dis Colon Rectum 2001; 44: 915-919
- Sugihara K, Kobayashi H, Kato T, et al.: Indication and benefit of pelvic sidewall dissection for rectal cancer. Dis Colon Rectum 2006; 49: 1663-1672
- Kitano S, Inomata M, Mizusawa J, et al.: Survival outcomes following laparoscopic versus open D3 dissection for stage Ⅱ or Ⅲ colon cancer(JCOG0404): a phase 3, randomised controlled trial. Lancet Gastroenterol Hepatol 2017; 2: 261-268
- Ueno H, Hase K, Shiomi A, et al.: Optimal bowel resection margin in colon cancer surgery: prospective multicentre cohort study with lymph node and feeding artery mapping. Lancet Reg Health West Pac 2023; 33: 100680
- Ono C, Yoshinaga K, Enomoto M, et al.: Discontinuous rectal cancer spread in the mesorectum and the optimal distal clearance margin in situ. Dis Colon Rectum 2002; 45: 744-749
- Shimada Y, Takii Y, Murayama S, et al.: Intramural and mesorectal distal spread detected by whole-mount sections in the determination of optimal distal resection margin in patients undergoing surgery for rectosigmoid or rectal cancer without preoperative therapy. Dis Colon Rectum 2011; 54: 1510-1520
- Shirouzu K, Isomoto H, Kakegawa T: Distal spread of rectal cancer and optimal distal margin of resection for sphincter-preserving surgery. Cancer 1995; 76: 388-392
- Zhao GP, Zhou ZG, Lei WZ, et al.: Pathological study of distal mesorectal cancer spread to determine a proper distal resection margin. World J Gastroenterol 2005; 11: 319-322
- 山田一隆,緒方俊二,佐伯泰愼,他: [第84回大腸癌研究会アンケート調査報告]括約筋間直腸切除術(ISR)の適応と長期成績.大腸疾患NOW 2017-2018,日本メディカルセンター,東京,2017: 125-130
- 山田一隆,緒方俊二,佐伯泰愼,他: 下部直腸・肛門管癌に対する括約筋間直腸切除術(ISR)の術後排便機能障害.日本大腸肛門病会誌2016; 69: 513-520
- Pollack J, Holm T, Cedermark B, et al.: Long-term effect of preoperative radiation therapy on anorectal function. Dis Colon Rectum 2006; 49: 345-352
- Lange MM, den Dulk M, Bossema ER, et al.; Cooperative Clinical Investigators of the Dutch Total Mesorectal Excision Trial: Risk factors for faecal incontinence after rectal cancer treatment. Br J Surg 2007; 94: 1278-1284
- Yamada K, Ogata S, Saiki Y, et al.: Long-term results of intersphincteric resection for low rectal cancer. Dis Colon Rectum 2009; 52: 1065-1071
- Aubert M, Mege D, Panis Y: Total mesorectal excision for low and middle rectal cancer: laparoscopic versus transanal approach-a meta-analysis. Surg Endosc 2020; 34: 3908-3919
- Larsen SG, Pfeffer F, Kørner H: Norwegian Colorectal Cancer Group. Norwegian moratorium on transanal total mesorectal excision. Br J Surg 2019; 106: 1120-1121
- Fujita S, Akasu T, Mizusawa J, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Postoperative morbidity and mortality after mesorectal excision with and without lateral lymph node dissection for clinical stage Ⅱ or stage Ⅲ lower rectal cancer(JCOG0212): results from a multicentre, randomised controlled, non-inferiority trial. Lancet Oncol 2012; 13: 616-621
- Saito S, Fujita S, Mizusawa J, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group: Male sexual dysfunction after rectal cancer surgery: Results of a randomized trial comparing mesorectal excision with and without lateral lymph node dissection for patients with lower rectal cancer: Japan Clinical Oncology Group Study JCOG0212. Eur J Surg Oncol 2016; 42: 1851-1858
- Ito M, Kobayashi A, Fujita S, et al.; Colorectal Cancer Study Group of Japan Clinical Oncology Group. Urinary dysfunction after rectal cancer surgery: Results from a randomized trial comparing mesorectal excision with and without lateral lymph node dissection for clinical stage Ⅱ or Ⅲ lower rectal cancer(Japan Clinical Oncology Group Study, JCOG0212). Eur J Surg Oncol 2018; 44: 463-468
- 大腸癌研究会編: 大腸癌取扱い規約 第9版,金原出版,東京,2018
- Mentges B, Buess G, Schäfer D, et al.: Local therapy of rectal tumors. Dis Colon Rectum 1996; 39: 886-892
- Maeda K, Maruta M, Sato H, et al.: Outcomes of novel transanal operation for selected tumors in the rectum. J Am Coll Surg 2004; 199: 353-360
サイドメモ
■虫垂癌の治療方針
虫垂癌は粘液癌と通常の腺癌に分けられる。さらに粘液癌は組織型によってグレード分類され,グレード1の低異型度虫垂粘液性腫瘍(LAMN:low-grade appendiceal mucinous neoplasm)の頻度がもっとも高い。グレード1(LAMN)では,深達度に関わらずリンパ節転移の頻度は極めて低く,海外のガイドライン1)では,遺残がなければ通常の大腸癌のようなリンパ節郭清目的の追加切除を行う必要はないとされ,大腸癌研究会のプロジェクト研究でも確認された2)。グレード2,3の粘液癌,および通常の腺癌では,他の大腸癌同様に深達度T1以深ではリンパ節転移のリスクがあり,追加切除(回結腸動脈根部を郭清する回盲部切除)を考慮する。
文献
- Glasgow SC, Gaertner W, Stewart D, et al.: The American Society of Colon and Rectal Surgeons, Clinical Practice Guidelines for the Management of Appendiceal Neoplasms. Dis Colon Rectum 2019; 62: 1425-1438
- Takeyama H, Murata K, Takeda T, et al.; study group of appendiceal neoplasms in Japan Society of Colorectal Cancer Research Group: Clinical Significance of Lymph Node Dissection and Lymph Node Metastasis in Primary Appendiceal Tumor Patients After Curative Resection: a Retrospective Multicenter Cohort Study. J Gastrointest Surg 2022; 26: 128-40
2 Stage Ⅳ大腸癌の治療方針
〔Stage Ⅳ大腸癌の治療方針〕
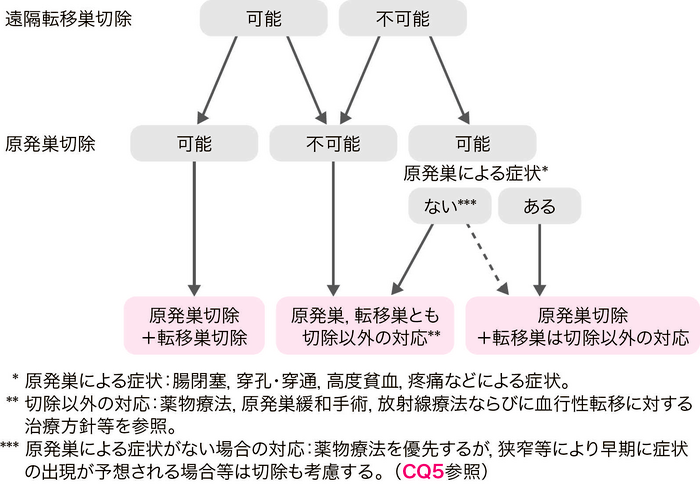
- Stage Ⅳ大腸癌では以下のいずれかの同時性遠隔転移を伴う。
肝転移,肺転移,腹膜転移,卵巣転移,遠隔(領域外)リンパ節転移,その他の転移(骨,脳,副腎など)。 - 遠隔転移巣ならびに原発巣がともに切除可能な場合には,原発巣の根治切除を行うとともに遠隔転移巣の切除を考慮する。
- 遠隔転移巣が切除可能であるが原発巣の切除が不可能な場合は,原則として原発巣および遠隔転移巣の切除は行わず,他の治療法を選択する。
- 遠隔転移巣の切除は不可能であるが原発巣切除が可能な場合は,原発巣の臨床症状や原発巣が有する予後への影響を考慮して,原発巣切除の適応を決める。(CQ 5)
コメント
〔血行性再発(肝・肺・脳転移など)〕(「4.血行性転移の治療方針」を参照)。
- 遠隔転移の頻度を表6に示す。
-
肝転移を伴う場合
- 転移巣が切除可能であれば,原発巣切除の根治性を確認して,肝転移巣切除を行う。
- 切除のタイミングについては,原発巣と肝転移巣との同時切除も安全に行われるが1),手術の侵襲度や患者の全身状態などにより,異時切除も行われる。しかし,同時切除と異時切除のどちらが長期予後に寄与するかは明らかではない。
-
肺転移を伴う場合
- 転移巣が切除可能であれば,原発巣切除のうえ,肺転移巣切除を考慮する。
- 原発巣切除後に改めて肺転移巣を切除する異時切除が一般的である。
-
腹膜転移を伴う場合
- P1は完全切除が強く推奨される2,3)。
- P2で容易に切除可能なものは完全切除を推奨する4-6)。
- P3 の切除効果は確立されていない。
-
卵巣転移を伴う場合(CQ 22)
- 根治切除が可能であれば,同時性・異時性にかかわらず切除が推奨される。
- 他に切除不能遠隔転移を有する場合,薬物療法を行う。ただし,薬物療法で制御不能な増大があり自覚症状を認める場合には,姑息切除を考慮する。
-
遠隔(領域外)リンパ節転移を伴う場合
- 遠隔(領域外)リンパ節転移の切除を考慮してよいが,明確な治療効果を示す比較試験はない7)。近年,大動脈周囲リンパ節転移に対し,切除することで根治や生存期間の延長を得られる症例が一定の頻度である報告がなされている8-12)。
-
その他の遠隔転移(骨,脳,副腎など)を伴う場合
- これらの転移巣については切除の報告はあるが,生命予後への明確な効果は示されていない。
-
複数部位への遠隔転移を伴う場合
- 肝と肺への転移が代表的なものである。
- 原発巣と肝・肺転移巣の切除が安全かつ容易であれば,切除が推奨される13-17)。
- 遠隔転移巣切除後の補助療法
-
遠隔転移巣への切除以外の治療法
- 薬物療法,放射線療法などが行われる。
-
原発巣に対する切除以外の緩和手術
- 人工肛門造設術,腸管バイパス術などが行われる。
文献
- de Santibañes E, Lassalle FB, McCormack L, et al.; Simultaneous colorectal and hepatic resections for colorectal cancer: postoperative and longterm outcomes. J Am Coll Surg 2002; 195: 196-202
- 望月英隆:腹膜播種を伴う大腸癌.上西紀夫,田中雅夫編,消化器癌の外科治療,東京,中外医学社; 2001: 100-102
- 岡 正,内山 哲,森近 博,他: 腹膜播種を伴う大腸癌症例の臨床病理学的検討―肝転移症例との比較―.日臨外医会誌1993; 54: 2535-2329
- Kobayashi H, Kotake K, Funahashi K, et al.: Clinical benefit of surgery for stage Ⅳ colorectal cancer with synchronous peritoneal metastasis. J Gastroenterol 2014; 49: 646-54
- Kobayashi H, Kotake K, Sugihara K. Outcomes of surgery without HIPEC for synchronous peritoneal metastasis from colorectal cancer: data from a multi-center registry. Int J Clin Oncol 2014; 19: 98-105
- Shida D, Kobayashi H, Kameyama M, et al.: Factors affecting R0 resection of colorectal cancer with synchronous peritoneal metastases: a multicenter prospective observational study by the Japanese Society for Cancer of the Colon and Rectum. Int J Clin Oncol 2020; 25: 330-337
- 正木忠彦,武藤徹一郎,安富正幸: 大動脈周囲リンパ節転移の実態 第44回大腸癌研究会アンケート調査報告.日本大腸肛門病会雑誌1997; 50: 318-330
- Nakai N, Yamaguchi T, Kinugasa Y, et al.: Long-term outcomes after resection of para-aortic lymph node metastasis from left-sided colon and rectal cancer. Int J Colorectal Dis 2017; 32: 999-1007
- Min BS, Kim JS, Kim NK, et al.: Extended lymph node dissection for rectal cancer with radiologically diagnosed extramesenteric lymph node metastasis. Ann Surg Oncol 2009; 16: 3271-3278
- Choi PW, Kim HC, Kim AY, et al.: Extensive lymphadenectomy in colorectal cancer with isolated para-aortic lymph node metastasis below the level of renal vessels. J Surg Oncol 2010; 101: 66-71
- Arimoto A, Uehara K, Kato T, et al.: Clinical Significance of Para-Aortic Lymph Node Dissection for Advanced or Metastatic Colorectal Cancer in the Current Era of Modern Chemotherapy. Dig Surg 2015; 32: 439-444
- Bae SU, Han YD, Cho MS, et al.: Oncologic Outcomes of Colon Cancer Patients with Extraregional Lymph Node Metastasis: Comparison of Isolated Paraaortic Lymph Node Metastasis with Resectable Liver Metastasis. Ann Surg Oncol 2016; 23: 1562-1568
- Murata S, Moriya Y, Akasu T, et al.: Resection of both hepatic and pulmonary metastases in patients with colorectal carcinoma. Cancer 1998; 83: 1086-1093.
- Kobayashi K, Kawamura M, Ishihara T: Surgical treatment for both pulmonary and hepatic metastases from colorectal cancer. J Thorac Cardiovasc Surg 1999; 118: 1090-1096
- Ambiru S, Miyazaki M, Ito H, et al.: Resection of hepatic and pulmonary metastases in patients with colorectal carcinoma. Cancer 1998; 82: 274-278
- Andres A, Mentha G, Adam R, et al.: Surgical management of patients with colorectal cancer and simultaneous liver and lung metastases. Br J Surg 2015; 102: 691-699
- Shah SA, Haddad R, Al-Sukhni W, et al.: Surgical resection of hepatic and pulmonary metastases from colorectal carcinoma. J Am Coll Surg 2006; 202: 468-475
3 再発大腸癌の治療方針
〔再発大腸癌の治療方針〕
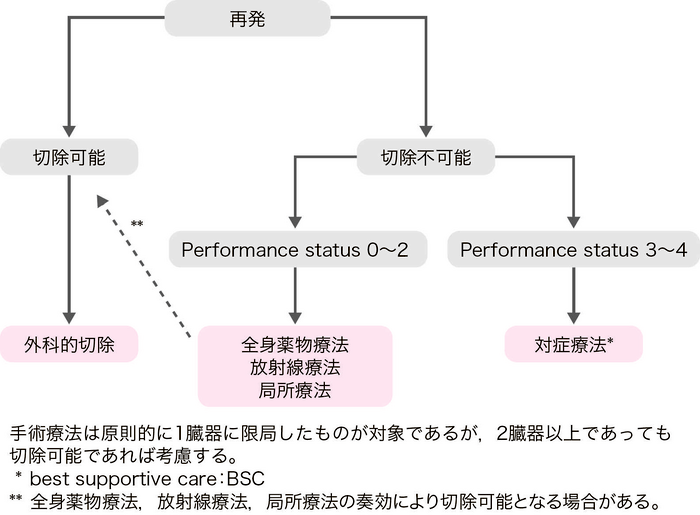
- 再発大腸癌の治療目的は,予後向上とQOLの改善である。
- 治療法としては,手術療法,全身薬物療法,放射線療法が中心である。熱凝固療法は,習熟した施設において許容される場合もある1)。(CQ 18)
- 期待される予後,合併症,治療後のQOLなどの様々な因子を考慮し,患者への十分なインフォームド・コンセントのもとに治療法を選択する。
- 再発臓器が1臓器の場合,手術にて再発巣の完全切除が可能であれば積極的に切除を考慮する。
- 再発臓器が2臓器以上の場合,それぞれが切除可能であれば切除を考慮してもよい2-4)。切除可能な肝肺転移に対しては有効性が示されており,切除することを推奨する。
- 切除可能な肝あるいは肺転移に対して不顕性転移を除外するために一定の観察期間を置いてから切除を行うという見解がある5,6)。
- 肝転移切除の場合,安全性や適応を考慮した上での腹腔鏡下手術が推奨される。(CQ 17)
- 切除不能と判断された肝転移や肺転移に対し,全身薬物療法が奏効して根治切除が可能になる症例が存在する7,8)。
- 切除可能な再発病変に対する術前化学療法の有効性・安全性は明らかでなく,適応は慎重に考慮すべきである。(CQ 19)
- 再発巣切除後の補助化学療法については,肝転移切除後の無再発生存期間を延長するという報告のほかは,明らかな有効性を示したデータはない。(CQ 20)
コメント
〔血行性再発(肝・肺・脳転移など)〕(「4.血行性転移の治療方針」を参照)。
〔リンパ節再発・腹膜再発〕- 一般に,原発巣治癒切除後のリンパ節再発あるいは腹膜再発は全身性疾患の一環として出現しているとみなすのが妥当であり,切除不能な進行再発大腸癌に対する薬物療法の項を参考に全身薬物療法を実施する(「2)切除不能進行・再発大腸癌に対する薬物療法」を参照)。
- 限局したリンパ節再発あるいは腹膜再発で病勢制御ができている場合に限り,切除を行う場合もあるが,その有効性は明らかでない。耐術能や術後のQOLを十分に考慮したうえで適応を決定すべきである9-13)。
- 限局したリンパ節再発では放射線療法が有効な症例もある14-16)。
- 腹膜再発に対する腫瘍減量手術(cytoreductive surgery)と腹腔内温熱化学療法(hyperthermic intraperitoneal chemotherapy:HIPEC)があるが17),海外でも限られた医療機関のみで実施されており,本邦においてはほとんど治療実績がなく一般の医療機関では実施できない。
- 卵巣転移については,根治切除可能なら切除し,切除不能遠隔転移を有していても増大による自覚症状がある場合は切除を考慮する。(CQ 22)
- 再発巣の進展範囲を画像診断にて評価し,再発形式や症状,身体的所見なども参考にして,完全切除が期待できる症例にのみ切除を推奨する。(CQ 14)
- 延命効果や症状緩和を目的とした姑息的切除の有効性については議論が多く,慎重に適応を検討すべきである18)。
- 切除不能の局所再発において,腫瘍縮小によりR0切除が可能になると期待される場合には,化学放射線療法が選択肢となる。一方,明らかにR0切除が望めない症例では,全身薬物療法のほか,高線量照射が可能な症例においては,局所療法(化学放射線療法や粒子線治療)が選択肢となる。(CQ 15)
文献
- Tinguely P, Laurell G, Enander A, et al.: Ablation versus resection for resectable colorectal liver metastases-Health care related cost and survival analyses from a quasi-randomised study. Eur J Surg Oncol 2023; 49: 416-425
- Murata S, Moriya Y, Akasu T, et al.: Resection of both hepatic and pulmonary metastases in patients with colorectal carcinoma. Cancer 1998; 83: 1086-1093
- Robinson BJ, Rice TW, Strong SA, et al.: Is resection of pulmonary and hepatic metastases warranted in patients with colorectal cancer? J Thorac Cardiovasc Surg 1999; 117: 66-75; discussion 75-76
- 森谷宜ひろ,山口高史,赤須孝之,他: 大腸癌の術後再発をめぐって 骨盤内局所再発癌に対する積極的外科治療.臨床外科2001; 56: 759-765
- Lambert LA, Colacchio TA, Barth RJ Jr.: Interval hepatic resection of colorectal metastases improves patient selection. Arch Surg 2000; 135: 473-479; discussion 479-80
- Yoshidome H, Kimura F, Shimizu H, et al.: Interval period tumor progression: does delayed hepatectomy detect occult metastases in synchronous colorectal liver metastases? J Gastrointest Surg 2008; 12: 1391-1398
- Adam R.: Developing strategies for liver metastases from colorectal cancer. Semin Oncol 2007; 34: S7-11
- Lam VW, Spiro C, Laurence JM, et al.: A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases. Ann Surg Oncol 2012; 19: 1292-1301
- Nakai N, Yamaguchi T, Kinugasa Y, et al.: Long-term outcomes after resection of para-aortic lymph node metastasis from left-sided colon and rectal cancer. Int J Colorectal Dis 2017; 32: 999-1007
- Arimoto A, Uehara K, Kato T, et al.: Clinical Significance of Para-Aortic Lymph Node Dissection for Advanced or Metastatic Colorectal Cancer in the Current Era of Modern Chemotherapy. Dig Surg 2015; 32: 439-444
- Min BS, Kim NK, Sohn SK, et al.: Isolated paraaortic lymph-node recurrence after the curative resection of colorectal carcinoma. J Surg Oncol 2008; 97: 136-140
- Wong JS, Tan GH, Teo MC: Management of para-aortic lymph node metastasis in colorectal patients: A systemic review. Surg Oncol 2016; 25: 411-418
- Nagata H, Ishihara S, Hata K, et al.: Survival and Prognostic Factors for Metachronous Peritoneal Metastasis in Patients with Colon Cancer. Ann Surg Oncol 2017; 24: 1269-1280
- Franzese C, Fogliata A, Comito T, et al.: Stereotactic/hypofractionated body radiation therapy as an effective treatment for lymph node metastases from colorectal cancer: an institutional retrospective analysis. Br J Radiol 2017; 90: 20170422
- Isozaki Y, Yamada S, Kawashiro S, et al.: Carbon-ion radiotherapy for isolated para-aortic lymph node recurrence from colorectal cancer. J Surg Oncol 2017; 116: 932-938
- Kim MS, Cho CK, Yang KM, et al.: Stereotactic body radiotherapy for isolated paraaortic lymph node recurrence from colorectal cancer. World J Gastroenterol 2009; 15: 6091-6095
- Goéré D, Malka D, Tzanis D, et al.: Is there a possibility of a cure in patients with colorectal peritoneal carcinomatosis amenable to complete cytoreductive surgery and intraperitoneal chemotherapy? Ann Surg 2013; 257: 1065-1071
- Tschmelitsch J, Kronberger P, Glaser K, et al.: Survival after surgical treatment of recurrent carcinoma of the rectum. J Am Coll Surg 1994; 179: 54-58
4 血行性転移の治療方針
〔血行性転移の治療方針〕
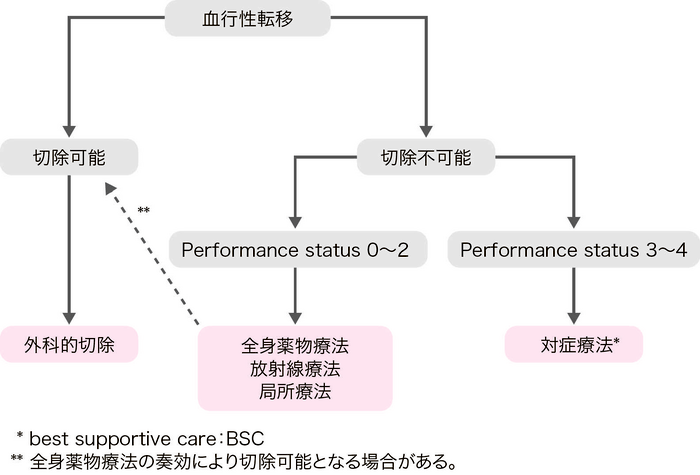
大腸癌の血行性転移臓器としては肝,肺,脳,骨などが代表的である。
全身薬物療法後に切除可能となった場合(conversion therapy)は,切除することで,薬物療法のみに比して,根治や予後の改善が期待される1,2)。
1)肝転移の治療方針
- 肝転移の治療は,肝切除,全身薬物療法,熱凝固療法,定位放射線治療,肝動注療法などがある。
- 根治切除可能な肝転移には肝切除が推奨される。
- 肝切除術は部分(非系統的)切除を基本とする。
肝切除の適応基準
- (1)
- 耐術可能。
- (2)
- 原発巣が制御されているか,制御可能。
- (3)
- 肝転移巣を遺残なく切除可能。
- (4)
- 肝外転移がないか,制御可能。
- (5)
- 十分な残肝機能。
- 切除不能な肝転移で全身状態が一定以上に保たれる場合(PS0~PS2)は,全身薬物療法を考慮する。
- 熱凝固療法にはマイクロ波凝固療法(microwave coagulation therapy:MCT)とラジオ波焼灼療法(radiofrequency ablation:RFA)がある。
- 全身状態が不良(PS≧3)あるいは有効な薬剤がない場合は対症療法(best supportive care:BSC)を行う。
コメント
〔肝切除〕- 肝切除は,コホート研究やランダム化比較試験から導き出された結論ではないが,選択された症例に対しては他の治療法では得られない良好な成績が示されている。
- 肝切除後の5年生存率は35~58%である3-6)。本邦で行われた多施設集計では,肝切除585例の3年生存率は52.8%,5年生存率は39.2%であった7)。
- 転移巣の数,大きさ,部位および予測残肝容量を総合的に評価し,転移巣の完全切除が可能か否かを判定する。
- 10 mm未満の病変に対する感度は,CTよりMRI(magnetic resonance imaging)が有意に高いことが報告されている8)。FDG-PET(positron emission tomography)の肝転移診断と治療に対する有効性はエビデンスが十分でなく確立されていない9)。化学療法後に消失した病変の描出には術中造影超音波検査も有効である。(CQ 16)
-
切除断端に癌が露出しない切除が重要である10-13)。
- 切除断端距離は,1 cm以上を推奨する報告と14,15),癌の露出がなければよいとする報告がある16-19)。
-
同時性肝転移では,原発巣の切除を先行し,原発巣の根治性を評価してから肝転移を切除してもよい。
- 同時性肝転移の切除時期については,明確な結論は得られていない20-22)。
-
肝門部リンパ節転移例の予後は不良であることから,肝門部リンパ節転移は肝切除の適応の除外因子としている報告がある23-25)。
- 本邦の集計では,肝門部リンパ節転移例で郭清した場合の5年生存率は12.5%であった7)。
- 切除可能な肝外転移(主に肺転移)を同時に有する肝転移例において,両者の切除により長期生存あるいは治癒が得られることがある26-33)。
- 残肝再発に対する再肝切除で21~52%の5年生存率が報告されている。残肝再発例に対しても前述の肝切除の適応基準に照らして切除を考慮する13,34-42)。
- 肝切除後の補助化学療法の有効性を明確に示すエビデンスは十分でないが,再発率が高いことを鑑みて,その実施が推奨される。(CQ 19,CQ 20)
- 切除可能な肝転移に対する術前化学療法の有効性は確立されていない。(CQ 19,CQ 20)
- 切除不能肝転移例には全身薬物療法を行う。
- 切除不能肝転移例に対して肝動注療法を行うことは,一般的には推奨されない。熱凝固療法は薬物療法や切除と併用することで選択肢のひとつとなる。(CQ 18)
2)肺転移の治療方針
- 肺転移の治療には,肺切除と全身薬物療法,放射線療法,アブレーション療法などがある。
- 肺転移巣の切除が可能であれば肺切除を考慮する。
- 肺切除には系統的切除と部分(非系統的)切除がある。
肺切除の適応基準
- (1)
- 耐術可能。
- (2)
- 原発巣が制御されているか,制御可能。
- (3)
- 肺転移巣を遺残なく切除可能。
- (4)
- 肺外転移がないか,制御可能。
- (5)
- 十分な残肺機能。
- 切除不能肺転移で全身状態が一定以上に保たれる場合は,全身薬物療法を考慮する。
- 耐術不能な場合でも,原発巣と肺外転移が制御されているか,制御可能で肺転移個数が3個以内であれば体幹部定位放射線治療(SBRT)も考慮する43)。(「6.放射線療法」を参照)
- 全身状態が不良な場合は適切なBSCを行う。
コメント
〔肺切除〕- コホート研究やランダム化比較試験から導き出された結論ではないが,適切に選択された症例に対する肺切除は他の治療法では得られない良好な成績が示されている29,44-56)。
- 肺切除後の5年生存率は53~68%である57-60)。
- 肺門・縦隔リンパ節郭清の意義は定まっていない61-63)。
- 切除可能な肺外転移例(主に肝転移)では,肺切除の有効性を示唆する報告がある27,29,51,56,64-66)。
- 残肺再発に対する再肺切除で20~52%の5年生存率が報告されている48,55,56,59,67,68)。肺切除後の残肺再発に対しても前述の肺切除の適応基準に準じて慎重に切除の適応を考慮する。
- これまで肺転移術後補助化学療法の効果を大規模に検討した報告はない。(CQ 21)
- 予後不良因子として,転移個数,両側肺転移,肺門・縦隔リンパ節転移,肺切除前血清CEA値,原発巣因子(T因子,N因子),無病期間(disease-free interval:DFI)などが報告されている48,50,51,53-56,58,61,63,66,69-72)これらの因子も考慮して手術の可否および集学的治療の適否を判断する73)。
体幹部定位照射に関するエビデンスは十分ではないが,切除不能や耐術能のない患者を対象とした国内外の報告が散見される74,75)。
〔アブレーション療法〕大腸癌肺転移に対するラジオ波焼灼治療(RFA)はその有効性を検証したエビデンスはないが治療選択の1つとして保険収載されている。キャンサーボードなどでその適応を慎重に検討し,日本IVR学会の「ラジオ波焼灼術(RFA)適応拡大の適正使用指針」を遵守することが必要である76)。
3)骨転移の治療方針
- 大腸癌における骨転移の治療は基本的に全身薬物療法であるが,疼痛緩和,骨折の治療および予防がQOLを維持する上で非常に重要である。
- 切迫した症状がない場合は,他の臓器転移と同様に全身薬物療法が優先される。
- 病的骨折や脊髄麻痺が生じた場合あるいは切迫した状態では,手術や放射線治療が検討される。
- 骨折予防に骨修飾薬を用いることを考慮する。
骨転移の治療法
- (1)
- 局所療法:放射線(通常照射,定位放射線治療),手術(固定,除圧,置換)
- (2)
- 薬物療法:標準的全身薬物療法,RANKL阻害剤およびビスフォスホネート製剤など骨修飾薬,鎮痛剤(麻薬性,非麻薬性)
コメント
- 遠隔転移がある大腸癌の骨転移の頻度は7.0~14.2%程度とされており,直腸癌,リンパ節転移,肺転移がリスクファクターとして報告されている77,78)。
- 本邦の剖検例を対象とした調査では,大腸癌の骨転移の頻度は23.7%にのぼるという報告もある79)。
- 放射線治療は,疼痛の軽減,骨折や脊髄麻痺の予防と治療を目的とする。
- 局所照射の疼痛緩和率は70~90%である80,81)。(「2)緩和的放射線療法」を参照)
- 脊髄麻痺を生じた場合,48時間以内の緊急手術の適応とされる。また,骨折も手術が必要な場合があるが,全身状態や予後を考慮し,多職種での治療方針の検討が重要である。
- 大腸癌における骨修飾薬のエビデンスは十分でないが,骨関連事象を低減させる目的で骨修飾薬を考慮する82)。
4)脳転移の治療方針
- 脳転移は全身疾患としての一分症として発見されることが少なくないが,高感受性の薬物がない現状から,治療効果(症状緩和と神経機能の維持もしくは生存期間延長)が期待される病変に対しては,手術療法あるいは放射線療法(定位放射線照射,全脳照射)を考慮する。
- 全身状態,他の転移巣の状況を考慮し,脳転移巣の大きさ,部位,脳転移個数を評価して最適な治療法を選択する。
- 切除不能例には放射線療法を考慮する。
脳腫瘍摘出術の適応基準83,84)
- (1)
- 耐術可能。
- (2)
- 原発巣が制御されているか,制御可能。
- (3)
- 数カ月以上の生命予後。
- (4)
- 切除により重大な神経症状をきたさない。
- (5)
- 他臓器の転移がないか,制御可能。
- 脳神経症状や頭蓋内圧亢進症状などの症状緩和と局所制御による延命を目的とする。
- 多発性脳転移例や外科切除の対象とならない孤立性脳転移例では全脳照射を考慮する。
- 脳転移個数がおよそ3~4個以内で3 cm以下であれば,定位放射線照射を考慮する。
コメント
〔手術療法〕- 脳転移の約90%の症例は他臓器に転移を伴い,切除術を施行しても予後は不良である83,85-89)。
- 孤立性脳転移に対する切除後の平均生存期間は30~40週と報告されているが83,84,86,87,90),十分な症例集積に基づく手術療法の有効性の評価は定まっていない。
- 脳転移切除後に全脳照射を追加する意義に関しては議論の分かれるところである83)。
- 症状改善率は60~80%である91,92)。
- 定位放射線照射では局所制御が80~90%に得られる93)。
- システマティックレビューによると定位放射線照射後,全脳照射後,BSC後の生存期間中央値は6.4カ月(5.1~9.5カ月),4.4カ月(2~9カ月),1.8カ月(0.5~2.5カ月)であった94-96)。
- 予後因子として,年齢,PS,脳転移個数,頭蓋外病変の制御の有無がある97-99)。
- 現時点では,数年の予後が期待できる場合には定位放射線照射を加えることを考慮する100,101)。定位放射線照射を行う場合には,QOLの高さから単独治療も治療選択肢として考慮されるが,全脳照射に比し頭蓋内再発率が高いため,適切な間隔での画像検査が必要である。
5)その他の血行性転移の治療方針
- 副腎,皮膚,脾などの血行性転移に対しても,切除可能な場合は切除を考慮する。しかし,これらの転移は他の臓器の転移を伴うことが多く,薬物療法あるいは放射線療法が適用されることが多い。
文献
- Adam R, Delvart V, Pascal G, et al.: Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long-term survival. Ann Surg 2004; 240: 644-657
- Nuzzo G, Giuliante F, Ardito F, et al.: Liver resection for primarily unresectable colorectal metastases downsized by chemotherapy. J Gastrointest Surg 2007; 11: 318-324
- Martin LW, Warren RS: Current management of colorectal liver metastases. Surg Oncol Clin N Am 2000; 9: 853-876
- Penna C, Nordlinger B: Colorectal metastasis(liver and lung). Surg Clin North Am 2002; 82: 1075-1090
- Abdalla EK, Vauthey JN, Ellis LM, et al.: Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Ann Surg 2004; 239: 818-825; discussion 825-827
- Nordlinger B, Sorbye H, Glimelius B, et al.; EORTC Gastro-Intestinal Tract Cancer Group et al.: Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer(EORTC 40983): long-term results of a randomised, controlled, phase 3 trial. Lancet Oncol 2013; 14: 1208-1215
- Kato T, Yasui K, Hirai T, et al.: Therapeutic results for hepatic metastasis of colorectal cancer with special reference to effectiveness of hepatectomy: analysis of prognostic factors for 763 cases recorded at 18 institutions. Dis Colon Rectum 2003; 46(Suppl): S22-S31
- Niekel MC, Bipat S, Stoker J: Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology 2010; 257: 674-684
- Moulton CA, Gu CS, Law CH, et al.: Effect of PET before liver resection on surgical management for colorectal adenocarcinoma metastases: a randomized clinical trial. JAMA 2014; 311: 1863-1869
- Fortner JG, Silva JS, Golbey RB, et al.: Multivariate analysis of hepatic metastases from colorectal cancer. I. Treatment by hepatic resection. Ann Surg 1984; 199: 306-316
- Hughes KS, Simon R, Songhorabodi S, et al.: Resection of the liver for colorectal carcinoma metastases: a multiinstitutional study of pattern of recurrence. Surgery 1986; 100: 278-284
- Ekberg H, Tranberg KG, Andersson R, et al.: Pattern of recurrence in liver resection for colorectal secondaries. World J Surg 1987; 11: 541-547
- Battula N, Tsapralis D, Mayer D, et al.: Repeat liver resection for recurrent colorectal metastases: a single-centre, 13-year experience. HPB(Oxford)2014; 16: 157-163
- Nordinger B, Jaeck D, Guiguet M, et al.: Surgical resection of hepatic metastases. Multicentric retrospective study by the French Association of Surgery. In: Nordinger B, Jaeck D(eds): Treatment of hepatic metastases of colorectal cancer. Paris Springer-Verlag, Paris, 1992: 129-146
- Cady B, Jenkins RL, Steele Jr GD, et al.: Surgical margin in hepatic resection for colorectal metastases: a critical and improvable determinant of outcome. Ann Surg 1998; 227: 566-571
- Yamamoto J, Sugihara K, Kosuge T, et al.: Pathologic support for limited hepatectomy in the treatment of liver metastases from colorectal cancer. Ann Surg 1995; 221: 74-78
- Elias D, Cavalcanti A, Sabourin JC, et al.: Results of 136 curative hepatectomies with a safety margin of less than 10 mm for colorectal metastases. J Surg Oncol 1998; 69: 88-93
- Fong Y, Cohen AM, Fortner JG, et al.: Liver resection for colorectal metastases. J Clin Oncol 1997; 15: 938-946
- Kokudo N, Miki Y, Sugai S, et al.: Genetic and histological assessment of surgical margins in resected liver metastases from colorectal carcinoma: minimum surgical margins for successful resection. Arch Surg 2002; 137: 833-840
- Bismuth H, Castaing D, Traynor O: Surgery for synchronous hepatic metastases of colorectal cancer. Scand J Gastroenterol Suppl 1988; 149: 144-149
- Scheele J: Hepatectomy for liver metastases. Br J Surg 1993; 80: 274-276
- Adam R, de Gramont A, Figueras J, et al.; of the EGOSLIM(Expert Group on OncoSurgery management of LIver Metastases)group: Managing synchronous liver metastases from colorectal cancer: a multidisciplinary international consensus. Cancer Treat Rev 2015; 41: 729-741
- Rodgers MS, McCall JL: Surgery for colorectal liver metastases with hepatic lymph-node involvement: a systematic review. Br J Surg 2000; 87: 1142-1155
- Beckurts KT, Hölscher AH, Thorban ST, et al.: Significance of lymph node imvolvement at the hepatic hilum in the resection of colorectal liver metastases. Br J Surg 1997; 84: 1081-1084
- Nakamura S, Suzuki S, Konno H: Resection of hepatic metastases of colorectal carcinoma: 20 years’ experience. J Hepatobiliary Pancreat Surg 1999; 6: 16-22
- Murata S, Moriya Y, Akasu T, et al.: Resection of both hepatic and pulmonary metastases in patients with colorectal carcinoma. Cancer 1998; 83: 1086-1093
- Kobayashi K, Kawamura M, Ishihara T: Surgical treatment for both pulmonary and hepatic metastases from colorectal cancer. J Thorac Cardiovasc Surg 1999; 118: 1090-1096
- Robinson BJ, Rice TW, Strong SA, et al.: Is resection of pulmonary and hepatic metastases warranted in patients with colorectal cancer? J Thorac Cardiovasc Surg 1999; 117: 66-76
- Regnard JF, Grunenwald D, Spaggiari L, et al.: Surgical treatment for hepatic and pulmonary metastases from colorectal cancers. Ann Thorac Surg 1998; 66: 214-218
- Carpizo DR, Are C, Jarnagin W, et al.: Liver resection for metastatic colorectal cancer in patients with concurrent extrahepatic disease: results in 127 patients treated at a single center. Ann Surg Oncol 2009; 16: 2138-2146
- Chua TC, Saxena A, Liauw W, et al.: Hepatectomy and resection of concomitant extrahepatic disease for colorectal liver metastases―a systematic review. Eur J Cancer 2012; 48: 1757-1765
- Ambiru S, Miyazaki M, Ito H, et al.: Resection of hepatic and pulmonary metastases in patients with colorectal carcinoma. Cancer 1998; 82: 274-278
- Shah SA, Haddad R, Al-Sukhni W, et al.: Surgical resection of hepatic and pulmonary metastases from colorectal carcinoma. J Am Coll Surg 2006; 202: 468-475
- Nordlinger B, Vaillant JC, Guiguet M, et al.: Survival benefit of repeat liver resections for recurrent colorectal metastases: 143 cases. Association Francaise de Chirurgie. J Clin Oncol 1994; 12: 1491-1496
- Yamamoto J, Kosuge T, Shimada K, et al.: Repeat liver resection for recurrent colorectal liver metastases. Am J Surg 1999; 178: 275-281
- Petrowsky H, Gonen M, Jarnagin W, et al.: Second liver resections are safe and effective treatment for recurrent hepatic metastases from colorectal cancer: a bi-institutional analysis. Ann Surg 2002; 235: 863-871
- Suzuki S, Sakaguchi T, Yokoi Y, et al.: Impact of repeat hepatectomy on recurrent colorectal liver metastases. Surgery 2001; 129: 421-428
- Nagakura S, Shirai Y, Suda T, et al.: Multiple repeat resections of intra- and extrahepatic recurrences in patients undergoing initial hepatectomy for colorectal carcinoma metastases. World J Surg 2002; 26: 141-147
- Tanaka K, Shimada H, Ohta M, et al.: Procedures of choice for resection of primary and recurrent liver metastases from colorectal cancer. World J Surg 2004; 28: 482-487
- Thelen A, Jonas S, Benckert C, et al.: Repeat liver resection for recurrent liver metastases from colorectal cancer. Eur J Surg Oncol 2007; 33: 324-328
- Pessaux P, Lermite E, Brehant O, et al.: Repeat hepatectomy for recurrent colorectal liver metastases. J Surg Oncol 2006; 93: 1-7
- Ishiguro S, Akasu T, Fujimoto Y, et al.: Second hepatectomy for recurrent colorectal liver metastasis: analysis of preoperative prognostic factors. Ann Surg Oncol 2006; 13: 1579-1587
- Tree AC, Khoo VS, Eeles RA, et al.: Stereotactic body radiotherapy for oligometastases. Lancet Oncol 2013; 14: e28-e37
- Goya T, Miyazawa N, Kondo H, et al.: Surgical resection of pulmonary metastases from colorectal cancer. 10-year follow-up. Cancer 1989; 64: 1418-1421
- McCormack PM, Burt ME, Bains MS, et al.: Lung resection of colorectal metastases. 10-year results. Arch Surg 1992; 127: 1403-1406
- Ike H, Shimada H, Ohki S, et al.: Results of aggressive resection of lung metastases from colorectal carcinoma detected by intensive follow-up. Dis Colon Rectum 2002; 45: 468-473; discussion 473-5
- Okumura S, Kondo H, Tsuboi M, et al.: Pulmonary resection for metastatic colorectal cancer: experiences with 159 patients. J Thorac Cardiovasc Surg 1996; 112: 867-874
- McAfee MK, Allen MS, Trastek VF, et al.: Colorectal lung metastases: results of surgical excision. Ann Thorac Surg 1992; 53: 780-785; discussion 785-6
- 緒方 裕,的野敬子,林 明宏,他: 大腸癌肺転移に対する肺切除の遠隔成績.日臨外会誌2001; 62: 2110-2115
- 丸田智章,須田武保,畠山勝義,他: 大腸癌肺転移に対する肺切除の検討.日消外会誌2002; 35: 1377-1383
- Saito Y, Omiya H, Kohno K, et al.: Pulmonary metastasectomy for 165 patients with colorectal carcinoma: A prognostic assessment. J Thorac Cardiovasc Surg 2002; 124: 1007-1013
- 金光幸秀,加藤知行,平井 孝: 大腸癌肺転移に対する治療の現況―第55回大腸癌研究会アンケート結果―.日本大腸肛門病会誌2004; 57: 121-131
- 斎藤 裕,高田宗尚,矢鋪憲功,他: 大腸癌肺転移の手術成績からみた手術適応.北陸外科学会雑誌2005; 24: 5-8
- 東山聖彦,高見康二,檜垣直純,他: 大腸癌肺転移に対する外科治療―手術適応,工夫と成績について―.臨床消化器内科2005; 20: 199-206
- Koga R, Yamamoto J, Saiura A, et al.: Surgical resection of pulmonary metastases from colorectal cancer: four favourable prognostic factors. Jpn J Clin Oncol 2006; 36: 643-648
- Iizasa T, Suzuki M, Yoshida S, et al.: Prediction of prognosis and surgical indications for pulmonary metastasectomy from colorectal cancer. Ann Thorac Surg 2006; 82: 254-260
- Iida T, Nomori H, Shiba M, et al.; Metastatic Lung Tumor Study Group of Japan: Prognostic factors after pulmonary metastasectomy for colorectal cancer and rationale for determining surgical indications: a retrospective analysis. Ann Surg 2013; 257: 1059-1064
- Okumura T, Boku N, Hishida T, et al.: Surgical Outcome and Prognostic Stratification for Pulmonary Metastasis From Colorectal Cancer. Ann Thorac Surg 2017; 104: 979-987
- van Dorp M, Wolfhagen N, Torensma B, et al.: Pulmonary metastasectomy and repeat metastasectomy for colorectal pulmonary metastases: outcomes from the Dutch Lung Cancer Audit for Surgery. BJS Open 2023; 7: zrad009
- Cho JH, Hamaji M, Allen MS, et al.: The prognosis of pulmonary metastasectomy depends on the location of the primary colorectal cancer. Ann Thorac Surg 2014; 98: 1231-1237
- Yang YH, Park SY, Kim HE, et al.: Effects of mediastinal lymph node dissection in colorectal cancer-related pulmonary metastasectomy. Thorac Cancer 2021; 12: 3248-3254
- Ichinose J, Hashimoto K, Matsuura Y, et al.: Optimal timing for lung metastasectomy in patients with colorectal cancer. Interact Cardiovasc Thorac Surg 2022; 35: ivac224
- van Dorp M, Bousema JE, Torensma B, et al.: Pulmonary metastasectomy with lymphadenectomy for colorectal pulmonary metastases: A systematic review. Eur J Surg Oncol 2022; 48: 253-260
- Miller G, Biernacki P, Kemeny NE, et al.: Outcomes after resection of synchronous or metachronous hepatic and pulmonary colorectal metastases. J Am Coll Surg 2007; 205: 231-238
- Andres A, Mentha G, Adam R, et al.: Surgical management of patients with colorectal cancer and simultaneous liver and lung metastases. Br J Surg 2015; 102: 691-699
- Horie T, Kanemitsu Y, Takamizawa Y, et al.: Prognostic differences between oligometastatic and polymetastatic disease after resection in patients with colorectal cancer and hepatic or lung metastases: Retrospective analysis of a large cohort at a single institution. Surgery 2023; 173: 328-334
- Kandioler D, Krömer E, Tüchler H, et al.: Long-term results after repeated surgical removal of pulmonary metas tases. Ann Thorac Surg 1998; 65: 909-912
- Kanzaki R, Higashiyama M, Oda K, et al.: Outcome of surgical resection for recurrent pulmonary metastasis from colorectal carcinoma. Am J Surg 2011; 202: 419-426
- Watanabe K, Nagai K, Kobayashi A, et al.: Factors influencing survival after complete resection of pulmonary metastases from colorectal cancer. Br J Surg 2009; 96: 1058-1065
- Hirosawa T, Itabashi M, Ohnuki T, et al.; Japanese Society for Cancer of the Colon and Rectum(JSCCR)Study Group for Pulmonary Metastases from Colorectal Cancer: Prognostic factors in patients undergoing complete resection of pulmonary metastases of colorectal cancer: a multi-institutional cumulative follow-up study. Surg Today 2013; 43: 494-499
- Gonzalez M, Poncet A, Combescure C, et al.: Risk factors for survival after lung metastasectomy in colorectal cancer patients: a systematic review and meta-analysis. Ann Surg Oncol 2013; 20: 572-579
- Cho JH, Kim S, Namgung M, et al.: The prognostic importance of the number of metastases in pulmonary metastasectomy of colorectal cancer. World J Surg Oncol 2015; 13: 222
- Ziranu P, Ferrari PA, Guerrera F, et al.: Clinical score for colorectal cancer patients with lung-limited metastases undergoing surgical resection: Met al.ung Score. Lung Cancer 2023; 184: 107342
- Jingu K, Matsushita H, Yamamoto T, et al.: Stereotactic Radiotherapy for Pulmonary Oligometastases From Colorectal Cancer: A Systematic Review and Meta-Analysis. Technol Cancer Res Treat 2018; 17: 1533033818794936
- Garcia-Exposito N, Ramos R, Navarro-Perez V, et al.: Stereotactic Body Radiotherapy versus Surgery for Lung Metastases from Colorectal Cancer: Single-Institution Results. Cancers(Basel)2023; 15: 1195
- 日本インターベンショナルラジオロジー学会: ラジオ波焼灼術(RFA)適応拡大の適正使用指針 https://www.jsir.or.jp/info/rfa/rfa_guideline/ (2024/5/14 accessed)
- Christensen TD, Jensen SG, Larsen FO, et al.: Systematic review: Incidence, risk factors, survival and treatment of bone metastases from colorectal cancer. J Bone Oncol 2018; 13: 97-105
- Sundermeyer ML, Meropol NJ, Rogatko A, et al.: Changing patterns of bone and brain metastases in patients with colorectal cancer. Clin Colorectal Cancer 2005; 5: 108-113
- Katoh M, Unakami M, Hara M, et al.: Bone metastasis from colorectal cancer in autopsy cases. J Gastroenterol 1995; 30: 615-618
- Nielsen OS, Munro AJ, Tannock IF: Bone metastases: pathophysiology and management policy. J Clin Oncol 1991; 9: 509-524
- Wu JS, Wong R, Johnston M, et al.; Cancer Care Ontario Practice Guidelines Initiative Supportive Care Group: Meta-analysis of dose-fractionation radiotherapy trials for the palliation of painful bone metastases. Int J Radiat Oncol Biol Phys 2003; 55: 594-605
- Santoni D, Tampellini M, Vincenzi B, et al.: Natural history of bone metastasis in colorectal cancer: final results of a large Italian bone metastases study. Ann Oncol 2012; 23: 2072-2077
- Patchell RA, Tibbs PA, Walsh JW, et al.: A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 1990; 322: 494-500
- Go PH, Klaassen Z, Meadows MC, et al.: Gastrointestinal cancer and brain metastasis: a rare and ominous sign. Cancer 2011; 117: 3630-3640
- Wroński M, Arbit E: Resection of brain metastases from colorectal carcinoma in 73 patients. Cancer 1999; 85: 1677-1685
- D’Andrea G, Isidori A, Caroli E, et al.: Single cerebral metastasis from colorectal adenocarcinoma. Neurosurg Rev 2004; 27: 55-57
- Farnell GF, Buckner JC, Cascino T: Brain metastases from colorectal carcinoma. Cancer 1996; 78: 711-716
- Jung M, Ahn JB, Chang JH, et al.: Brain metastases from colorectal carcinoma: prognostic factors and outcome. J Neurooncol 2011; 101: 49-55
- Aprile G, Zanon E, Tuniz F, et al.: Neurosurgical management and postoperative whole-brain radiotherapy for colorectal cancer patients with symptomatic brain metastases. J Cancer Res Clin Oncol 2009; 135: 451-457
- Noura S, Ohue M, Shingai T, et al.: Brain metastasis from colorectal cancer: prognostic factors and survival. J Surg Oncol 2012; 106: 144-148
- Borgelt B, Gelber R, Kramer S, et al.: The palliation of brain metastases: final results of the first two studies by the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 1980; 6: 1-9
- Kurtz JM, Gelber R, Brady LW, et al.: The palliation of brain metastases in a favorable patient population: a randomized clinical trial by the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 1981; 7: 891-895
- Flickinger JC, Kondziolka D, Lunsford LD, et al.: A multi-institutional experience with stereotactic radiosurgery for solitary brain metastasis. Int J Radiat Oncol Biol Phys 1994; 28: 797-802
- Silva IL, Iskandarani M, Hotouras A, et al.: A systematic review to assess the management of patients with cerebral metastases secondary to colorectal cancer. Tech Coloproctol 2017; 21: 847-852
- Mege D, Sans A, Ouaissi M, et al.: Brain metastases from colorectal cancer: characteristics and management. ANZ J Surg 2018; 88: 140-145
- Chang Y, Wong CE, Lee PH, et al.: Survival Outcome of Surgical Resection vs. Radiotherapy in Brain Metastasis From Colorectal Cancer: A Meta-Analysis. Front Med(Lausanne)2022; 9: 768896
- Gasper L, ScottC, Rotman M, et al.: Recursive partitioning analysis(RPA)of prognostic factors in three Radiation Therapy Oncology Group(RTOG)brain metastases trials. Int J Radiat Oncol Biol Phys 1997; 37: 745-751
- van Gijn W, Marijnen CA, Nagtegaal ID, et al.; Dutch Colorectal Cancer Group: Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011; 12: 575-582
- Sperduto PW, Kased N, Roberge D, et al.: Summary report on the graded prognostic assessment: an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol 2012; 30: 419-425
- Andrews DW, Scott CB, Sperduto PW, et al.: Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase Ⅲ results of the RTOG 9508 randomised trial. Lancet 2004; 363: 1665-1672
- Aoyama H, Shirato H, Tago M, et al.: Stereotactic radiosurgery plus whole-brain radiotherapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA 2006; 295: 2483-2491
5 薬物療法
- 薬物療法には,術後再発抑制を目的とした補助化学療法と,延命や症状緩和などを目的とした切除不能進行・再発大腸癌に対する薬物療法がある。
- 治療の実施やレジメンは,腫瘍因子(進行度,組織型,原発巣部位,バイオマーカーなど)から期待される効果だけでなく,治療因子(有害事象,QOL,治療コストなど),患者因子(年齢,併存疾患,想定される副作用に対する嗜好,治療意欲など)を考慮して,必要な情報を医療者と患者が共有した上で一緒に治療方針を決定する(shared decision making注1)。
-
本邦の保険診療として,大腸癌に対する適応が認められている標準治療に用いる薬剤には以下のものがある。
- 殺細胞性抗癌薬:
- fluorouracil(5-FU),5-FU+levofolinate calcium(l-LV),tegafur uracil(UFT),tegafur gimeracil oteracil potassium(S-1),UFT+calcium folinate(LV),capecitabine(Cape),irinotecan hydrochloride hydrate(IRI),oxaliplatin(OX),trifluridine/tipiracil hydrochloride(FTD/TPI)など
- 分子標的治療薬:
- bevacizumab(BEV),ramucirumab(RAM),aflibercept beta(AFL),cetuximab(CET),panitumumab(PANI),regorafenib hydrate(REG),encorafenib(ENCO),binimetinib(BINI),entrectinib(ENTR),larotrectinib(LARO),trastuzumab(TRA),pertuzumab(PER)
- 免疫チェックポイント阻害薬:
- pembrolizumab(Pembro),nivolumab(Nivo),ipilimumab(Ipi)
注1 shared decision making(共同意思決定)
医療者と患者が共同して,患者にとって最善の医療上の決定を下すに至るコミュニケーションのプロセスで,患者参加型医療の根幹をなす。従来のインフォームド・コンセントより,意思決定にあたり患者が主体的に関わり,患者の価値観をより重要視する。
1)補助化学療法
- 術後補助化学療法は,R0切除が行われた治癒切除例に対して,再発を抑制し予後を改善する目的で,術後に実施される全身薬物療法である。
適応の原則
- (1)
- R0 切除が行われたStage Ⅲ大腸癌(結腸癌・直腸癌)。
- (2)
- 術後合併症から回復している。
- (3)
- Performance status(PS)が0~1である。
- (4)
- 主要臓器機能が保たれている。
- (5)
- 重篤な術後合併症(感染症,縫合不全など)がない。
- Stage Ⅲ大腸癌には,術後補助化学療法が推奨される。(CQ 6)
- 再発リスクが高いStage Ⅱ大腸癌には,術後補助化学療法の適応を考慮する。(CQ 7)
- 高齢者での適応についてはCQ 8を参照。
- 遠隔転移巣切除後への補助化学療法の適応については,CQ 21,CQ 22を参照。
- 周術期薬物療法実施前のバイオマーカー検査については,CQ 9を参照。
レジメン
臨床試験において有用性が示され,本邦で保険診療として使用可能な術後補助化学療法レジメンは以下のとおりである。
| oxaliplatin(OX)併用療法 | CAPOX |
| FOLFOX | |
| フッ化ピリミジン(FP)単独療法 | capecitabine(Cape) |
| 5-FU+l-LV | |
| UFT+LV | |
| S-1 |
投与期間
- 投与期間6カ月を原則とする。
コメント
- 術後補助化学療法は,術後8週頃までに開始することが望ましい。
- Stage Ⅲ結腸癌を対象としたOX併用療法は,欧米で実施された3つのランダム化比較試験にて,5-FU+l-LVと比べて有意な再発抑制および予後改善効果が確認された1-3)ことから推奨される(推奨度1)。一方,UFT+LVおよびCapeは5-FU+l-LVに対する非劣性が示され4),S-1はUFT+LVに対する非劣性が示されている5)(推奨度2)。一方で,S-1のCapeに対する非劣性は示されなかった6)。(CQ 6)
- Stage Ⅲ結腸癌を対象とした術後補助化学療法における,OX併用療法の投与期間が,本邦のランダム化比較試験(ACHIEVE試験)を含む6つのランダム化比較試験の統合解析で比較された。3カ月投与群は,全対象では6カ月投与群に対する非劣性が示されなかったが(IDEA collaboration)7),CAPOX投与例では,特に再発低リスク例において6カ月投与群と同程度の再発抑制効果を示した。ACHIEVE試験でも,3カ月投与群と6カ月投与群の3年無病生存率は同程度であった8)。感覚性末梢神経障害の発現は3カ月投与群で有意に少なかった9)。(CQ 6)
- 直腸癌を対象としたupfront surgery後の補助化学療法は,結腸癌と比べてエビデンスが少ないものの,抗癌薬の効果は結腸癌と大きく異ならないと考えられることから,結腸癌のエビデンスも参考にして実施する。(CQ 6)
- Stage Ⅱ結腸癌を対象とした術後補助化学療法において,UFT単独投与(1年間)は手術単独と比べて有意な再発抑制効果は本邦のランダム化比較試験で示されなかった10)。UFT/LV療法の前向き観察研究では,T4病変,穿孔・穿通,低分化腺癌・粘液癌,郭清リンパ節個数12個未満のいずれかを満たす高リスクのstage Ⅱ結腸癌患者に対して,UFT/LVによる術後化学療法は,手術単独よりも生存率が高い可能性が示された11)。(CQ 7)
- Stage Ⅱ/Ⅲ結腸癌を対象とした術後補助化学療法において,5-FU+l-LVにIRIを併用した場合の上乗せ効果は示されておらず,IRIの併用は推奨されない。分子標的治療薬の有効性も示されておらず,分子標的治療薬の併用は推奨されない。
- 遠隔転移巣治癒切除例を対象とした補助化学療法の議論は続いている。肝転移治癒切除例を対象とした術後補助化学療法において,UFT+LVおよびFOLFOXは手術単独と比べて有意な再発抑制効果が本邦のランダム化比較試験で示された12,13)。しかし,いずれのレジメンも手術単独と比較し全生存期間の延長効果は示せなかった。(CQ 21,CQ 22)
- Stage Ⅱ/Ⅲ結腸癌を対象とした臨床試験のメタアナリシスにおいて,KRAS変異およびBRAF変異(MSS)は再発高リスク因子,MSI-H/dMMRは再発低リスク因子であることが報告されている14,15)。また,MSI-H/dMMR症例ではFP単独療法の有効性が乏しいことが報告されており,推奨されない16,17)。一方,KRAS変異やBRAF変異の有無に基づく術後補助化学療法の実施判断やレジメン選択の有用性については明確になっていない。大腸癌に対する補助化学療法前のRAS/BRAF検査,ミスマッチ修復機能欠損(MSI/MMR-IHC)検査は保険適用となっている。
2)切除不能進行・再発大腸癌に対する薬物療法
- 薬物療法を実施しない場合,切除不能と判断された進行・再発大腸癌の生存期間中央値(MST:median survival time)は約8カ月と報告されている18)。最近の薬物療法の進歩によってMSTは30カ月を越えるまで延長してきた19-22)が,いまだ治癒を望むことは難しい状況である。
- 薬物療法の目標は腫瘍の進行を遅延させ,延命と症状コントロールを行うことであるが,薬物療法が奏効し,転移巣が治癒切除された場合には,治癒が得られる場合もある。
- PS 0~2の患者を対象としたランダム化比較試験のメタアナリシスにおいて,薬物療法群は抗癌薬を用いない対症療法(BSC)群よりも有意に生存期間が延長することが示されている18)。
-
薬物療法を考慮する際には,最初にその適応可否について判断する。
- 薬物療法の適応となる(Fit)患者とは,全身状態が良好で,かつ主要臓器機能が保たれ,重篤な併存疾患がなく,一次治療のOX,IRIや分子標的治療薬の併用療法に対する忍容性に問題はない,と判断される患者である(「一次治療の方針を決定する際のプロセス」を参照)。
- 薬物療法の適応に問題がある(Vulnerable)患者とは,全身状態や,主要臓器機能,併存疾患などのため,一次治療のOX,IRIや分子標的治療薬の併用療法に対する忍容性に問題がある,と判断される患者である(「一次治療の方針を決定する際のプロセス」を参照)。
- 薬物療法の適応とならない(Frail)患者とは,全身状態が不良,または主要臓器機能が保たれていない,重篤な併存疾患を有するなどのため,薬物療法の適応がないと判断される患者である(「一次治療の方針を決定する際のプロセス」を参照)。
- 薬物療法が適応可能と判断される患者に対しては,一次治療開始前にRAS(KRAS/NRAS)遺伝子検査,BRAFV600E遺伝子検査,MSI/MMR-IHC検査を実施する。ただし,術後再発例ですでにこれらの検査結果が判明している場合はその結果を診療に用いる。
- CET,PANIはRAS(KRAS/NRAS)遺伝子野生型の患者にのみ適応される。
- PembroはDNAミスマッチ修復機能が欠損している患者(Microsatellite instability-high[MSI-H]/Mismatch repair deficient[dMMR]),または腫瘍遺伝子変異量が高い(Tumor mutation burden-High[TMB-H])患者にのみ適応される。Nivo,IpiはDNAミスマッチ修復機能が欠損している患者にのみ適応される(コメント③を参照)。
- ENCO,BINIはBRAFV600E遺伝子変異型の患者にのみ適応される。
- PER, TRAはHER2陽性の患者にのみ適応される。
- ENTR,LAROはNTRK融合遺伝子陽性の患者にのみ適応される。
適応の原則
- (1)
- 病理組織診断にて結腸または直腸の腺癌であることが確認されている。
- (2)
- 治癒切除不能と診断されている。
- (3)
- 全身状態や,主要臓器機能,重篤な併存疾患の有無により薬物療法の適応がある(Fit),または薬物療法の適応の問題がある(Vulnerable)と判断される(各薬剤の添付文書を参照)。
一次治療の方針を決定する際のプロセス
推奨されるレジメン以外の治療を選択することも可能である。推奨されるレジメンを含む選択可能なレジメンは,「臨床試験において有用性が示されており,かつ保険診療として国内で使用可能なレジメン」の項を参照。
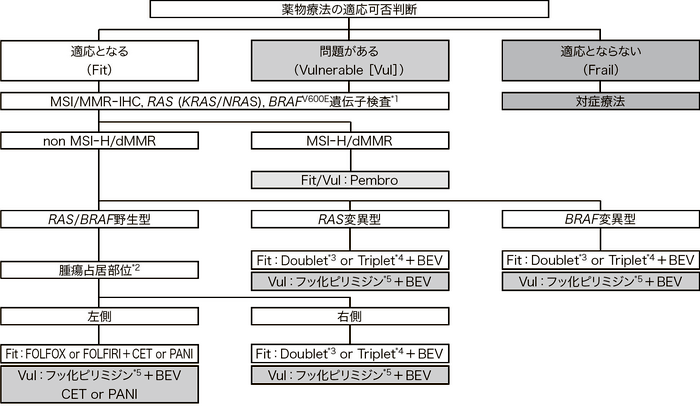
Pembro:pembrolizumab, BEV:bevacizumab, CET:cetuximab, PANI:panitumumab
*1:HER2検査を合わせて実施することも考慮される(コメント⑤を参照)
*2:腫瘍占居部位の左側とは下行結腸,S状結腸,直腸,右側とは盲腸,上行結腸,横行結腸を指す
*3:Doublet:FOLFOX, CAPOX, SOX, FOLFIRI, S-1+IRI
*4:Triplet:FOLFOXIRI
*5:フッ化ピリミジン:5-FU+l-LV,UFT+LV,S-1,Cape
切除不能進行・再発大腸癌に対する薬物療法のアルゴリズム
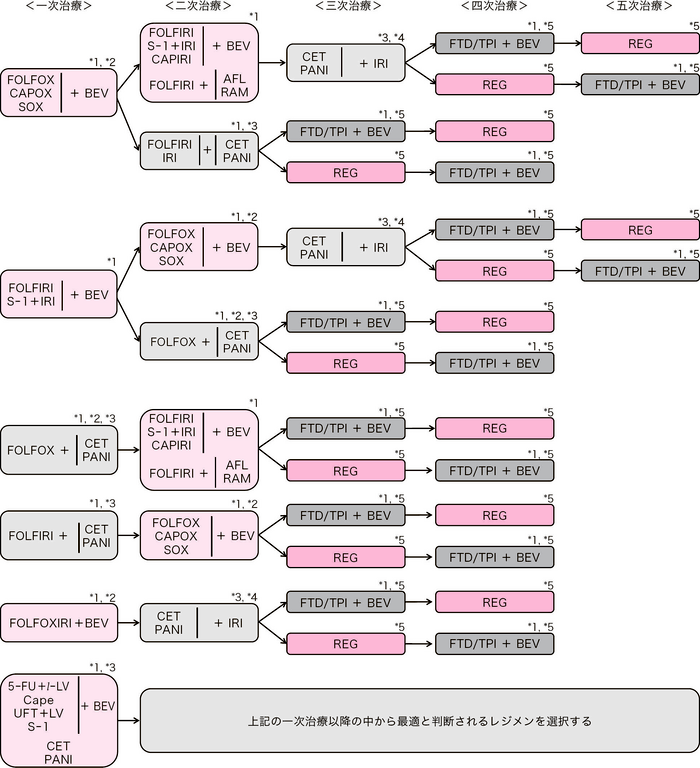
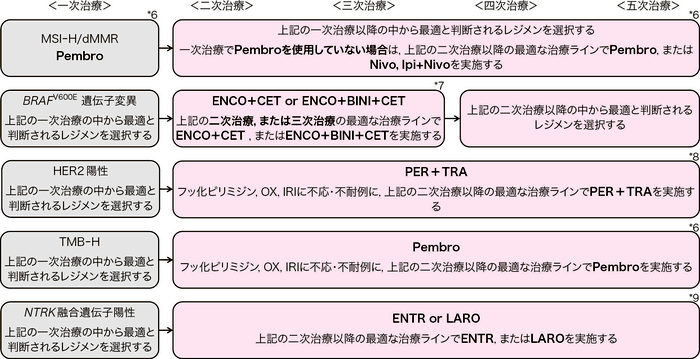
BEV:bevacizumab, RAM:ramucirumab, AFL:aflibercept beta, CET:cetuximab, PANI:panitumumab, REG:regorafenib, FTD/TPI:trifluridine/tipiracil hydrochloride, Pembro:pembrolizumab, Nivo:nivolumab, Ipi:ipilimumab, ENCO:encorafenib, BINI:binimetinib, ENTR:entrectinib, LARO:larotrectinib, PER:pertuzumab, TRA:trastuzumab
*1:BEV,RAM,AFL,CET,PANIなどの分子標的治療薬の併用が推奨されるが,適応とならない場合は化学療法単独を行う
*2:OX併用療法を導入療法として開始後,維持療法への移行も考慮される(CQ 25を参照)
*3:CET,PANIはRAS(KRAS/NRAS)野生型のみに適応(コメント②を参照)
*4:IRI不耐でなければIRIを併用するのが望ましい
*5:FTD/TPI+BEV, REGについてはCQ 24を参照
*6:PembroはMSI-H/dMMR,またはTMB-Hにのみ適応,Nivo, Ipi+NivoはMSI-Hにのみ適応(コメント③,⑥,CQ 23を参照)
*7:ENCO,BINIはBRAFV600E遺伝子変異型にのみ適応(コメント④を参照)
*8:PER,TRAはHER2陽性にのみ適応(コメント⑤を参照)
*9:ENTR,LAROはNTRK融合遺伝子陽性にのみ適応(コメント⑦を参照)
臨床試験において有用性が示されており,かつ保険診療として国内で使用可能なレジメン
一次治療(CQ 25)
- FOLFOX23-25)+BEV19,20,26)
- CAPOX27)+BEV26)
- SOX+BEV19)
- FOLFIRI25,28)+BEV20)
- S-1+IRI+BEV29)
- FOLFOX+CET/PANI22,30,31)(コメント②を参照)
- FOLFIRI+CET/PANI32,33)(コメント②を参照)
- FOLFOXIRI34)+BEV21,35,36)
- Infusional 5-FU+l-LV37,38)+BEV39,40)
- Cape41,42)+BEV43)
- UFT+LV44-46)+BEV47)
- S-1+BEV48)
- CET/PANI49-51)
- Pembro(コメント③,CQ 23を参照)52,53)
二次治療
- (a)
-
OX を含むレジメンに不応・不耐となった場合
- FOLFIRI25)+BEV54,55)
- CAPIRI+BEV56)
- FOLFIRI+RAM57,58)
- FOLFIRI+AFL59)
- S-1+IRI60)+BEV
- IRI61)+BEV62)
- FOLFIRI+CET/PANI63,64)
- CET/PANI+IRI65,66)
- Pembro67)(コメント③,CQ 23を参照)
- Nivo68)(コメント③,CQ 23を参照)
- Ipi+Nivo69)(コメント③,CQ 23を参照)
- ENCO+CET70)(コメント④を参照)
- ENCO+BINI+CET70)(コメント④を参照)
- ENTR71)(コメント⑦を参照)
- LARO72)(コメント⑦を参照)
- (b)
- IRIを含むレジメンに不応・不耐となった場合
- (c)
- OX,IRIの両方を含むレジメンに不応・不耐となった場合
三次治療以降
- CET/PANI76-80)+IRI81,82)(CQ 24 を参照)
- FTD/TPI+BEV注1,83-86)(CQ 24 を参照)
- FTD/TPI87,88)(CQ 24 を参照)
- REG89)
- Pembro67,92)(コメント③,⑥,CQ 23 を参照)
- Nivo68)(コメント③,CQ 23 を参照)
- Ipi+Nivo69)(コメント③,CQ 23 を参照)
- ENCO+CET70)(コメント④を参照)
- ENCO+BINI+CET70)(コメント④を参照)
- PER+TRA注2,90,91)(コメント⑤を参照)
- ENTR71)(コメント⑦を参照)
- LARO72)(コメント⑦を参照)
注1 FTD/TPI+BEV
FTD/TPI 35mg/m2/回 1日2回内服 5日内服2日休薬を2回繰り返し,その後2週休薬 4週毎に繰り返す;BEV 5mg/kg静注 2週毎に繰り返す。
注2 PER+TRA
PER 初回840mg/body 静注,2回目以降420mg/body 静注;TRA 初回8mg/kg 静注,2回目以降6mg/kg 静注 3週毎に繰り返す。または,PER・TRA・ボルヒアルロニダーゼ アルファ配合剤を初回各々1200mg・600mg・30000U/body 皮下注,2回目以降各々600mg・600mg・20000U/body 皮下注 3週毎に繰り返す。
コメント
-
治療実施上の注意点
- 全身状態が不良,または主要臓器機能が保たれていない,重篤な併存疾患を有する(Frail)患者は原則的には薬物療法の適応はない。これらの要因により,標準治療を受けることは難しいが,何らかの薬物療法を受けることはできる(Vulnerable)と判断される場合には,一次治療としてフッ化ピリミジン+BEV併用療法,またはフッ化ピリミジン単独療法,抗EGFR抗体薬単独療法が考慮される。ただし,MSI-H/dMMRの患者にはリスクベネフィットの観点からPembroが考慮される(「一次治療の方針を決定する際のプロセス」を参照)。
- 治療前には,PS,バイタルサイン,体重,自覚症状などの身体所見,血液検査結果,尿検査所見などを確認し,投与不可と判断される異常を認めた場合は治療の延期を考慮する。
- 治療継続時には,前項のほか,前回投与時後の治療関連有害事象などを検討して薬物療法継続の可否を判断し,また適宜減量などを考慮する。
- 治療コースを繰り返す場合には,蓄積性の有害事象(末梢神経障害,食欲不振,倦怠感,下痢,皮膚障害,味覚障害など)に注意する。必要であれば全ての治療,あるいは原因となる薬を休止して回復を待つ。
- 有害事象の評価には有害事象共通用語規準(CTCAE:Common Terminology Criteria for Adverse Events;https://jcog.jp/assets/CTCAEv5J_20250901_v28_1.pdf)を用いることが望ましい。
- 治療効果は,CT,MRIなどの適切な画像診断を用いて判定する。腫瘍縮小効果の判定には,RECIST(Response Evaluation Criteria In Solid Tumors;https://jcog.jp/assets/RECISTv11J_20100810.pdf)ガイドラインを用いることが望ましい。
- RECISTもしくは臨床的に治療効果が認められなくなった場合(不応),有害事象により治療継続が困難と判断される場合(不耐),患者の拒否などの場合には,治療を中止し,可能であれば次治療への移行を検討する。
- RAS(KRAS/NRAS)遺伝子変異は切除不能大腸癌患者の約50%に認められ,これらの変異を有する患者に対して抗EGFR抗体薬(CET,PANI)の効果が期待できないことが報告されている。さらに最近では,原発巣占居部位が左側(下行結腸,S状結腸,直腸)の患者に対しては一次治療における抗EGFR抗体薬の効果が高いが,右側(盲腸,上行結腸,横行結腸)の患者に対する効果は乏しいことが報告されている22,93)。したがって,薬物療法の実施が可能な患者においては,一次治療前にRAS(KRAS/NRAS)遺伝子検査を行うことが推奨される。
- DNAミスマッチ修復(MMR)機能欠損(MSI-H/dMMR)は,切除不能大腸癌の約4%に認められる94)。切除不能大腸癌一次治療におけるPembroの有効性と安全性は,ランダム化第Ⅲ相臨床試験であるKEYNOTE-177試験で検証され52,53),フッ化ピリミジン系薬剤とOXまたはIRIによる前治療歴がある症例に対するPembro, Nivo/Ipi+Nivoの有効性と安全性は各々非ランダム化第Ⅱ相臨床試験であるKEYNOTE-164, Checkmate-142試験で評価された67-69)。
したがって薬物療法の適応に問題のない患者においては,一次治療前にMMR機能欠損検査を行うことが推奨される。MMR機能欠損検査にはMSI検査とMMR-IHC検査があるが,現時点でMMR-IHC検査はNivo,Ipi+Nivoのコンパニオン診断薬とはなっていない(CQ 23参照)。 - 本邦において,BRAFV600E遺伝子変異は切除不能大腸癌患者の約5%に認められ,これらの変異を有する患者は薬物療法の効果が乏しく予後が極めて不良である95-97)。BRAFV600E遺伝子変異型の切除不能大腸癌二次治療例および三次治療例におけるENCO+CET,ENCO+BINI+CETの有効性と安全性は,ランダム化第Ⅲ相臨床試験であるBEACON試験で検証された70)。
したがって薬物療法の適応に問題のない患者においては,一次治療前にBRAFV600E遺伝子検査を行うことが推奨される。また,BRAFV600E遺伝子検査はリンチ症候群の補助診断としても有用であり,MMR機能欠損を有しリンチ症候群が疑われる患者に対して同検査を行うことが推奨される。なおBRAFV600E遺伝子検査の基本的要件についてはJSMO「大腸がん診療における遺伝子関連検査等のガイダンス 第5版」(日本臨床腫瘍学会)を参照。 -
HER2陽性大腸癌は切除不能大腸癌患者の2~3%に認められ,抗EGFR抗体薬の効果が乏しい可能性が報告されている98-100)。
HER2陽性の切除不能大腸癌既治療例に対するPER+TRAの有効性と安全性は非ランダム化第Ⅱ相臨床試験であるTRIUMPH試験で評価された90)。本試験ではフッ化ピリミジン,OX,IRIおよび抗EGFR抗体薬に不応・不耐となったRAS遺伝子野生型かつHER2陽性の患者が対象となっており,それ以外の患者に対する有効性,安全性は確認されていない。しかし,前述した通りHER2陽性大腸癌では抗EGFR抗体薬の効果が乏しいことが報告されていることから,抗EGFR抗体薬の治療歴がない患者に対してもPER+TRA療法は推奨される。
HER2検査は治療開始前の適切なタイミングで実施することが推奨されるが,複数回の薄切による腫瘍検体の損失や検査担当者の負担を考慮し,一次治療開始前にMMR機能欠損検査やRAS/BRAF遺伝子検査と合わせて実施することも妥当と考える。また,HER2検査のコンパニオン診断として「ベンタナultraViewパスウェーHER2(4B5)」(IHC)および「パスビジョンHER-2 DNAプローブキット」(FISH),「ヒストラHER2 FISHキット」(FISH),「Guadant360® CDxがん遺伝子パネル」が使用可能であるが,包括的がんゲノムプロファイル検査にてHER2増幅が認められた場合も,エキスパートパネルがHER2陽性と判断しPER+TRAを提案することは妥当と考える。 -
大腸癌におけるTMB-Hの多くはMMR機能欠損を有しており,non MSI-HかつTMB-Hは約6%と推定される101)。
標準治療に不応・不耐なTMB-Hの固形癌に対するPembroの有効性と安全性は,非ランダム化第Ⅱ相臨床試験であるKEYNOTE-158試験で評価された92)。本試験には大腸癌が含まれておらず,TMB-Hかつnon MSI-Hの大腸癌に対するPembroの有効性は明らかではないが,標準治療に不応・不耐となった状況においてTMB-Hを有する場合には,Pembroを治療選択肢として考慮することは妥当と考える(CQ 23参照)。本邦ではTMB-Hのコンパニオン診断としてFoundationOne® CDxがんゲノムプロファイルが保険償還されている。 -
NTRK融合遺伝子は切除不能大腸癌患者の0.21%(95%信頼区間0.16-0.28)に認められ102),これらの変異を有する患者は予後不良な可能性が報告されている103)。
NTRK融合遺伝子陽性の大腸癌を含む固形癌に対するENTR,LAROの有効性と安全性は,各々進行中の3つの国際共同第Ⅰ/Ⅱ相試験のデータセットを用いて評価された71,72)。本邦ではNTRK融合遺伝子のコンパニオン診断としてFoundationOne® CDx,がんゲノムプロファイル(ENTR,LARO),FoundationOne® Liquid CDxがんゲノムプロファイル(ENTR)が保険償還されている。
文献
- André T, Boni C, Mounedji-Boudiaf L, et al.; Multicenter International Study of Oxaliplatin/5-Fluorouracil/Leucovorin in the Adjuvant Treatment of Colon Cancer(MOSAIC)Investigators: Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med 2004; 350: 2343-2351
- Haller DG, Tabernero J, Maroun J, et al.: Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage Ⅲ colon cancer. J Clin Oncol 2011; 29: 1465-1471
- Kuebler JP, Wieand HS, O’Connell MJ, et al.: Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage Ⅱ and Ⅲ colon cancer: results from NSABP C-07. J Clin Oncol 2007; 25: 2198-2204
- Shimada Y, Hamaguchi T, Mizusawa J, et al.: Randomised phase Ⅲ trial of adjuvant chemotherapy with oral uracil and tegafur plus leucovorin versus intravenous fluorouracil and levofolinate in patients with stage Ⅲ colorectal cancer who have undergone Japanese D2/D3 lymph node dissection: final results of JCOG0205. Eur J Cancer 2014; 50: 2231-2240
- Yoshida M, Ishiguro M, Ikejiri K, et al.: S-1 as adjuvant chemotherapy for stage Ⅲ colon cancer: a randomized phase Ⅲ study(ACTS-CC trial). Ann Oncol 2014; 25: 1743-1749
- Hamaguchi T, Shimada Y, Mizusawa J, et al.: Capecitabine versus S-1 as adjuvant chemotherapy for patients with stage Ⅲ colorectal cancer(JCOG0910): an open-label, non-inferiority, randomised, phase 3, multicentre trial. Lancet Gastroenterol Hepatol 2018; 3: 47-56
- Grothey A, Sobrero AF, Shields AF, et al.: Duration of adjuvant chemotherapy for stage Ⅲ colon cancer. N Engl J Med 2018; 378: 1177-1188
- Yoshino T, Yamanaka T, Kotaka M, et al.: Efficacy of 3 versus 6 months of oxaliplatin-based adjuvant chemotherapy for stage Ⅲ colon cancer(CC): Results from phase Ⅲ ACHIEVE trial as part of the International Duration Evaluation of Adjuvant therapy(IDEA)Collaboration. An Oncol 2017; 28(Suppl 5): V614
- Kotaka M, Yamanaka T, Yoshino T, et al.: Safety data from the phase Ⅲ Japanese ACHIEVE trial: part of an international, prospective, planned pooled analysis of six phase Ⅲ trials comparing 3 versus 6 months of oxaliplatin- based adjuvant chemotherapy for stage Ⅲ colon cancer. ESMO Open 2018; 3: e000354
- Matsuda C, Ishiguro M, Teramukai S, et al.; SACURA Study Group. A randomised-controlled trial of 1-year adjuvant chemotherapy with oral tegafur-uracil versus surgery alone in stage Ⅱ colon cancer: SACURA trial. Eur J Cancer. 2018; 96: 54-63
- Sadahiro S, Sakamoto K, Tsuchiya T, et al.: Prospective observational study of the efficacy of oral uracil and tegafur plus leucovorin for stage Ⅱ colon cancer with risk factors for recurrence using propensity score matching(JFMC46-1201). BMC Cancer 2022; 22: 170
- Hasegawa K, Saiura A, Takayama T, et al.: Adjuvant oral uracil-tegafur with leucovorin for colorectal cancer liver metastases: a randomized controlled trial. PLoS One 2016; 11: e0162400
- Kanemitsu Y, Shimizu Y, Mizusawa J, et al.: Hepatectomy Followed by mFOLFOX6 Versus Hepatectomy Alone for Liver-Only Metastatic Colorectal Cancer(JCOG0603): A Phase Ⅱ or Ⅲ Randomized Controlled Trial. J Clin Oncol 2021; 39: 3789-3799
- Formica V, Sera F, Cremolini C, et al.: KRAS and BRAF Mutations in Stage Ⅱ/Ⅲ Colon Cancer: A Systematic Review and Meta-Analysis. J Natl Cancer Inst 2022; 114: 517-527
- Böckelman C, Engelmann BE, Kaprio T, et al.: Risk of recurrence in patients with colon cancer stage Ⅱ and Ⅲ: a systematic review and meta-analysis of recent literature. Acta Oncol 2015; 54: 5-16
- Sargent DJ, Marsoni S, Monges G, et al.: Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol 2010; 28: 3219-3226
- Cohen R, Taieb J, Fiskum J, et al.: Microsatellite Instability in Patients With Stage Ⅲ Colon Cancer Receiving Fluoropyrimidine With or Without Oxaliplatin: An ACCENT Pooled Analysis of 12 Adjuvant Trials. J Clin Oncol 2021; 39: 642-651
- Simmonds PC; Colorectal Cancer Collaborative Group: Palliative chemotherapy for advanced colorectal cancer: systematic review and meta-analysis. BMJ 2000; 321: 531-535
- Yamada Y, Takahari D, Matsumoto H, et al.: Leucovorin, fluorouracil, and oxaliplatin plus bevacizumab versus S-1 and oxaliplatin plus bevacizumab in patients with metastatic colorectal cancer(SOFT): an open-label, non-inferiority, randomised phase 3 trial. Lancet Oncol 2013; 14: 1278-1286
- Yamazaki K, Nagase M, Tamagawa H et al.: Randomized phase Ⅲ study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer(WJOG4407G). Ann Oncol 2016; 27: 1539-1546
- Loupakis F, Cremolini C, Masi G, et al.: Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014; 371: 1609-1618
- Watanabe J, Muro K, Shitara K et al.: Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. Jama 2023; 329: 1271-1282
- de Gramont A, Figer A, Seymour M, et al.: Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 2000; 18: 2938-2947
- Goldberg RM, Sargent DJ, Morton RF, et al.: A randomized controlled trial of fluorouracil plus leucovorin, irinotecan, and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2004; 22: 23-30
- Tournigand C, André T, Achille E, et al.: FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: A Randomized GERCOR Study. J Clin Oncol 2004; 22: 229-237
- Saltz LB, Clarke S, Díaz-Rubio E, et al.: Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: A randomized phase Ⅲ study. J Clin Oncol 2008; 26: 2013-2019
- Cassidy J, Clarke S, Díaz-Rubio E, et al.: Randomized phase Ⅲ study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol 2008; 26: 2006-2012
- Douillard JY, Cunningham D, Roth AD, et al.: Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 2000; 355: 1041-1047
- Yamada Y, Denda T, Gamoh M, et al.: S-1 and irinotecan plus bevacizumab versus mFOLFOX6 or CapeOX plus bevacizumab as first-line treatment in patients with metastatic colorectal cancer(TRICOLORE): a randomized, open-label, phase Ⅲ, noninferiority trial. Ann Oncol 2018; 29: 624-631
- Bokemeyer C, Bondarenko I, Makhson A, et al.: Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009; 27: 663-671
- Douillard JY, Siena S, Cassidy J, et al.: Randomized, phase Ⅲ trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin(FOLFOX4)versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 2010; 28: 4697-4705
- Van Cutsem E, Köhne CH, Hitre E, et al.: Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009; 360: 1408-1417
- Köhne CH, Hofheinz R, Mineur L, et al.: First-line panitumumab plus irinotecan/5-fluorouracil/leucovorin treatment in patients with metastatic colorectal cancer. J Cancer Res Clin Oncol 2012; 138: 65-72
- Falcone A, Ricci S, Brunetti I, et al.; Gruppo Oncologico Nord Ovest: Phase Ⅲ trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan(FOLFOXIRI)compared with infusional fluorouracil, leucovorin, and irinotecan(FOLFIRI)as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007; 25: 1670-1676
- Cremolini C, Antoniotti C, Rossini D et al.: Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer(TRIBE2): a multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol 2020; 21: 497-507
- Cremolini C, Antoniotti C, Stein A et al.: Individual Patient Data Meta-Analysis of FOLFOXIRI Plus Bevacizumab Versus Doublets Plus Bevacizumab as Initial Therapy of Unresectable Metastatic Colorectal Cancer. J Clin Oncol 2020: JCO2001225
- Petrelli N, Herrera L, Rustum Y, et al.: A prospective randomized trial of 5-fluorouracil versus 5-fluorouracil and high-dose leucovorin versus 5-fluorouracil and methotrexate in previously untreated patients with advanced colorectal carcinoma. J Clin Oncol 1987; 5: 1559-1565
- de Gramont A, Bosset JF, Milan C, et al.: Randomized trial comparing monthly low-dose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer: a French intergroup study. J Clin Oncol 1997; 15: 808-815
- Hurwitz HI, Fehrenbacher L, Hainsworth JD, et al.: Bevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J Clin Oncol 2005; 23: 3502-3508
- Kabbinavar F, Hurwitz HI, Fehrenbacher L, et al.: Phase Ⅱ, randomized trial comparing Bevacizumab plus fluorouracil(FU)/leucovorin(LV)with FU/LV alone in patients with metastatic colorectal cancer. J Clin Oncol 2003; 21: 60-65
- Hoff PM, Ansari R, Batist G, et al.: Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase Ⅲ study. J Clin Oncol 2001; 19: 2282-2292
- Van Cutsem E, Twelves C, Cassidy J, et al.; Xeloda Colorectal Cancer Study Group: Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase Ⅲ study. J Clin Oncol 2001; 19: 4097-4106
- Tebbutt NC, Wilson K, Gebski VJ, et al.: Capecitabine, bevacizumab, and mitomycin in first-line treatment of metastatic colorectal cancer: results of the Australasian Gastrointestinal Trials Group Randomized Phase Ⅲ MAX Study. J Clin Oncol 2010; 28: 3191-3198
- Shirao K, Hoff PM, Ohtsu A, et al.: Comparison of the efficacy, toxicity, and pharmacokinetics of a uracil/tegafur(UFT)plus oral leucovorin(LV)regimen between Japanese and American patients with advanced colorectal cancer: joint United States and Japan study of UFT/LV. J Clin Oncol 2004; 22: 3466-3474
- Douillard JY, Hoff PM, Skillings JR, et al.: Multicenter phase Ⅲ study of uracil/tegafur and oral leucovorin versus fluorouracil and leucovorin in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2002; 20: 3605-3616
- Carmichael J, Popiela T, Radstone D, et al.: Randomized comparative study of tegafur/uracil and oral leucovorin versus parenteral fluorouracil and leucovorin in patients with previously untreated metastatic colorectal cancer. J Clin Oncol 2002; 20: 3617-3627
- Nishina T, Moriwaki T, Shimada M, et al.: Uracil-Tegafur and Oral Leucovorin Combined With Bevacizumab in Elderly Patients(Aged≥75 Years)With Metastatic Colorectal Cancer: A Multicenter, Phase Ⅱ Trial(Joint Study of Bevacizumab, Oral Leucovorin, and Uracil-Tegafur in Elderly Patients[J-BLUE]Study). Clin Colorectal Cancer 2016; 15: 236-242
- Yoshida M, Muro K, Tsuji A, et al.: Combination chemotherapy with bevacizumab and S-1 for elderly patients with metastatic colorectal cancer(BASIC trial). Eur J Cancer. 2015 May; 51: 935-941
- Pierantonio F, Cremolini C, Aprile G, et al.: Single-Agent Panitumumab in Frail Elderly Patients With Advanced RAS and BRAF Wild-Type Colorectal Cancer: Challenging Drug Label to Light Up New Hope. Onoclogist 2015; 20: 1261-1265
- Sastre J, Massuti B, Pulido G, et al.: First-line singl-agent panitumumab in frail elderly patients with wild-type KRAS metastatic colorectal cancer and poor prognostic factors: A phase Ⅱ study of the Spanish Cooperative Group for the Treatment of Digestive Tumours. Eur J Cancer 2015; 51: 1371-1380
- Terazawa T, Kato T, Goto M et al.: Phase Ⅱ Study of Panitumumab Monotherapy in Chemotherapy-Naïve Frail or Elderly Patients with Unresectable RAS Wild-Type Colorectal Cancer: OGSG 1602. Oncologist 2021; 26: 17-e47
- André T, Shiu KK, Kim TW et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 2020; 383: 2207-2218
- Diaz LA Jr, Shiu KK, Kim TW, et al.: Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer(KEYNOTE-177): final analysis of a randomized, open-label, phase 3 study. Lancet Oncol 2022; 23: 659-670
- Bennouna J, Sastre J, Arnold D, et al.; ML18147 Study Investigators. Continuation of bevacizumab after first progression in metastatic colorectal cancer(ML18147): a randomised phase 3 trial. Lancet Oncol 2013; 14: 29-37
- Iwamoto S, Takahashi T, Tamagawa H, et al.: FOLFIRI plus bevacizumab as second-line therapy in patients with metastatic colorectal cancer after first-line bevacizumab plus oxaliplatin-based therapy: the randomized phase Ⅲ EAGLE study. Ann Oncol 2015; 26: 1427-1433
- Xu RH, Muro K, Morita S, et al.: Modified XELIRI(capecitabine plus irinotecan)versus FOLFIRI(leucovorin, fluorouracil, and irinotecan), both either with or without bevacizumab, as second-line therapy for metastatic colorectal cancer(AXEPT): a multicentre, open-label, randomised, non-inferiority, phase 3 trial. Lancet Oncol 2018; 19: 660-671
- Tabernero J, Yoshino T, Cohn AL, et al.; RAISE Study Investigators: Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine(RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 2015; 16: 499-508
- Yasui H, Okita Y, Nakamura M et al.: Ramucirumab plus FOLFIRI as second-line treatment for patients with RAS wild-type metastatic colorectal cancer previously treated with anti-EGFR antibody: JACCRO CC-16. ESMO Open 2023; 8: 101636
- Van Cutsem E, Tabernero J, Lakomy R, et al.: Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase Ⅲ randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012; 30: 3499-3506
- Muro K, Boku N, Shimada Y, et al.: Irinotecan plus S-1(IRIS)versus fluorouracil and folinic acid plus irinotecan(FOLFIRI)as second-line chemotherapy for metastatic colorectal cancer: a randomised phase 2/3 non-inferiority study(FIRIS study). Lancet Oncol 2010; 11: 853-860
- Rougier P, Van Custem E, Bajetta E et al.: Randomised trial of irinotecan versus fluorouracil by continuous infusion after fluorouracil failure in patients with metastatic colorectal cancer. Lancet 1998; 352: 1407-1412
- Kuramochi H, Ando M, Itabashi M, et al.: Phase Ⅱ study of bevacizumab and irinotecan as second-line therapy for patients with metastatic colorectal cancer previously treated with fluoropyrimidines, oxaliplatin, and bevacizumab. Cancer Chemother Pharmacol 2017; 79: 579-585
- Peeters M, Price TJ, Cervantes A, et al.: Randomized phase Ⅲ study of panitumumab with fluorouracil, leucovorin, and irinotecan(FOLFIRI)compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 2010; 28: 4706-4713
- Shitara K, Yonesaka K, Denda T, et al.: Randomized study of FOLFIRI plus either panitumumab or bevacizumab for wild-type KRAS colorectal cancer-WJOG 6210 G. Cancer Sci 2016; 107: 1843-1850
- Sobrero AF, Maurel J, Fehrenbacher L, et al.: EPIC: phase Ⅲ trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 2311-2319
- Seymour MT, Brown SR, Middleton G, et al.: Panitumumab and irinotecan versus irinotecan alone for patients with KRAS wild-type, fluorouracil-resistant advanced colorectal cancer(PICCOLO): a prospectively stratified randomised trial. Lancet Oncol 2013; 14: 749-759
- Le DT, Kim TW, Van Cutsem E et al.: Phase Ⅱ Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164. J Clin Oncol 2020; 38: 11-19
- Overman MJ, McDermott R, Leach JL et al.: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer(CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017; 18: 1182-1191
- Overman MJ, Lonardi S, Wong KYM et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 2018; 36: 773-779
- Kopetz S, Grothey A, Yaeger R et al.: Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med 2019; 381: 1632-1643
- Doebele RC, Drilon A, Paz-Ares L et al.: Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020; 21: 271-282
- Hong DS, DuBois SG, Kummar S et al.: Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 2020; 21: 531-540
- Rothenberg ML, Oza AM, Bigelow RH, et al.: Superiority of oxaliplatin and fluorouracil-leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil-leucovorin: interim results of a phase Ⅲ trial. J Clin Oncol 2003; 21: 2059-2069
- Giantonio BJ, Catalano PJ, Meropol NJ, et al.: Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin(FOLFOX4)for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007; 25: 1539-1544
- Rothenberg ML, Cox JV, Butts C, et al.: Capecitabine plus oxaliplatin(XELOX)versus 5-fluorouracil/folinic acid plus oxaliplatin(FOLFOX-4)as second-line therapy in metastatic colorectal cancer: a randomized phase Ⅲ noninferiority study. Ann Oncol 2008; 19: 1720-1726
- Jonker DJ, O’Callaghan CJ, Karapetis CS, et al.: Cetuximab for the treatment of colorectal cancer. N Engl J Med 2007; 357: 2040-2048
- Karapetis CS, Khambata-Ford S, Jonker DJ, et al.: K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359: 1757-1765
- Van Cutsem E, Peeters M, Siena S, et al.: Open-label phase Ⅲ trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007; 25: 1658-1664
- Amado RG, Wolf M, Peeters M, et al.: Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 1626-1634
- Price TJ, Peeters M, Ruff P et al.: ASPECCT: panitumumab versus cetuximab for colorectal cancer―authors’reply. Lancet Oncol 2014; 15: e303
- Cunningham D, Humblet Y, Siena S, et al.: Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351: 337-345
- Sakai D, Taniguchi H, Sugimoto N et al.: Randomised phase Ⅱ study of panitumumab plus irinotecan versus cetuximab plus irinotecan in patients with KRAS wild-type metastatic colorectal cancer refractory to fluoropyrimidine, irinotecan and oxaliplatin(WJOG 6510 G). Eur J Cancer 2020; 135: 11-21
- Prager GW, Taieb J, Fakih M et al.: Trifluridine-Tipiracil and Bevacizumab in Refractory Metastatic Colorectal Cancer. N Engl J Med 2023; 388: 1657-1667
- Kuboki Y, Nishina T, Shinozaki E et al.: TAS-102 plus bevacizumab for patients with metastatic colorectal cancer refractory to standard therapies(C-TASK FORCE): an investigator-initiated, open-label, single-arm, multicentre, phase 1/2 study. Lancet Oncol 2017; 18: 1172-1181
- Yoshida Y, Yamada T, Kamiyama H et al.: Combination of TAS-102 and bevacizumab as third-line treatment for metastatic colorectal cancer: TAS-CC3 study. Int J Clin Oncol 2021; 26: 111-117
- Takahashi T, Yamazaki K, Oki E et al.: Phase Ⅱ study of trifluridine/tipiracil plus bevacizumab by RAS mutation status in patients with metastatic colorectal cancer refractory to standard therapies: JFMC51-1702-C7. ESMO Open 2021; 6: 100093
- Yoshino T, Mizunuma N, Yamazaki K, et al.: TAS-102 monotherapy for pretreated metastatic colorectal cancer: a double-blind, randomised, placebo-controlled phase 2 trial. Lancet Oncol 2012; 13: 993-1001
- Mayer RJ, Van Cutsem E, Falcone A, et al.; RECOURSE Study Group: Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 2015; 372: 1909-1919
- Grothey A, Van Cutsem E, Sobrero A, et al.; CORRECT Study Group: Regorafenib monotherapy for previously treated metastatic colorectal cancer(CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381: 303-312
- Nakamura Y, Okamoto W, Kato T et al.: Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer: a phase 2 trial. Nat med 2021; 27: 1899-1903
- Meric-Bernstam F, Hurwitz H, Raghav KPS et al.: Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer(MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol 2019; 20: 518-530
- Marabelle A, Fakih M, Lopez J, et al.: Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study. Lancet Oncol 2020; 21: 1353-1365
- Arnold D, Lueza B, Douillard JY, et al.: Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials. Ann Oncol 2017; 28: 1713-1729
- Akagi K, Oki E, Taniguchi H et al.: Real-world data on microsatellite instability status in various unresectable or metastatic solid tumors. Cancer Sci 2021; 112: 1105-1113
- Venderbosch S, Nagtegaal ID, Maughan TS, et al.: Mismatch repair status and BRAF mutation status in metastatic colorectal cancer patients: a pooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies. Clin Cancer Res 2014; 20: 5322-5330
- Yokota T, Ura T, Shibata N, et al.: BRAF mutation is a powerful prognostic factor in advanced and recurrent colorectal cancer. Br J Cancer 2011; 104: 856-862
- Kawazoe A, Shitara K, Fukuoka S, et al.: A retrospective observational study of clinicopathological features of KRAS, NRAS, BRAF and PIK3CA mutations in Japanese patients with metastatic colorectal cancer. BMC Cancer 2015; 15: 258
- Richman SD, Southward K, Chambers P, et al.: HER2 overexpression and amplification as a potential therapeutic target in colorectal cancer: analysis of 3256 patients enrolled in the QUASAR, FOCUS and PICCOLO colorectal cancer trials. J Pathol 2016; 238: 562-570
- Ingold Heppner B, Behrens HM, Balschun K, et al.: HER2/neu testing in primary colorectal carcinoma. Br J Cancer 2014; 111: 1977-1984
- Sartore-Bianchi A, Trusolino L, Martino C, et al.: Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer(HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17: 738-746
- Yoshino T, Pentheroudakis G, Mishima S et al.: JSCO-ESMO-ASCO-JSMO-TOS: international expert consensus recommendations for tumour-agnostic treatments in patients with solid tumours with microsatellite instability or NTRK fusions. Ann Oncol 2020; 31: 861-872
- Yoshino T, Tukachinsky H, Kim JL, et al.: Genomic immunotherapy(IO)biomarkers detected on comprehensive genomic profiling(CGP)of tissue and circulating tumor DNA(ctDNA). J Clin Oncol 2021; 39: 15_suppl: 2541
- Pietrantonio F, Di Nicolantonio F, Schrock AB et al.: ALK, ROS1, and NTRK Rearrangements in Metastatic Colorectal Cancer. J Natl Cancer Inst 2017; 109
6 放射線療法
- 放射線療法には,直腸癌の術後の再発抑制や術前の腫瘍量減量,肛門温存を目的とした補助放射線療法と切除不能進行再発大腸癌の症状緩和や延命を目的とした緩和的放射線療法がある。
1)補助放射線療法
- 補助放射線療法には,術前照射,術中照射,術後照射がある。
- 補助放射線療法の目的は直腸癌の局所制御率の向上である。術前照射では,さらに肛門括約筋温存率と切除率の向上が得られることが示唆されている。しかし,生存率の改善に関しては,現時点で補助放射線療法の目的とするだけのエビデンスは存在しない。
- 術前照射は「cT3以深またはcN陽性」,術後照射は「pT3以深またはpN陽性,外科剝離面陽性(RM1)または外科剝離面への癌浸潤の有無が不明(RMX)」,術中照射は「外科剝離面陽性(RM1)または外科剝離面への癌浸潤の有無が不明(RMX)」を対象とする。
- 照射方法により外部照射と術中照射に分けられる。
コメント
-
術前照射(CQ 11)
- (1)
- 術前照射の利点は,手術時の播種の予防,腫瘍への血流が保たれていて腫瘍細胞に放射線感受性細胞の割合が多いこと,小腸が骨盤腔内に固定していないため消化管への障害が少ないこと,腫瘍縮小によるR0切除率の向上,肛門括約筋温存が期待できることである1)。術前照射の欠点は,早期症例への過剰治療の危険性があること,術後合併症の増加の危険性があることである。
- (2)
- 術前照射(化学療法なし)に関する12件のランダム化比較試験が報告され2),このうち5件では術前照射が手術単独に比べ局所制御率が有意に良好であった。ただし,生存率の向上を認めたのは1件のみであった3)。また,2つのメタアナリシスでは,手術単独に比し,術前照射併用にて局所制御率の向上を認め,30Gy以上の群では生存率の改善を認めた。しかし,生存率の改善に関しては議論の余地がある4,5)。
- (3)
- 1回線量5Gyによる短期照射の試験が欧州を中心に行われた3,6)。放射線の晩期障害は1 回線量の大きさに影響を受けることから,肛門機能,腸管障害などを含めた晩期障害を長期的に経過観察していく必要がある。TMEに短期照射を加える意義について,術前照射(25Gy/5回)+TMEとTME単独を比較したDutch CKVO 95‒04 試験では,5年および10年局所制御率は併用群で有意に良好であったが,5年および10年生存率は両群で差はなかった6-8)。また,手術単独群に比し,術前照射併用群では,性機能低下,腸管障害の頻度が高かった9,10)。
- (4)
- 術前照射の原発巣に対する縮小効果により括約筋温存が可能になることがある。術前照射の目的が括約筋温存である場合,腫瘍縮小のための適切な期間(放射線治療終了後6~8週)をおいて手術を行うことが望ましい11)。
- (5)
- 術前照射に化学療法併用が有用かどうかを比較するランダム化比較試験が欧州などで4つ施行され,術前化学放射線療法は,術前放射線療法単独に比し,急性期有害事象の頻度が有意に高いものの,pCR割合が有意に高い結果であった。局所再発率は短期照射の試験を除いた2つの試験において術前化学放射線療法群で有意に低い結果であり,括約筋温存,生存率に関しては両群に差を認めなかった12-15)。併用化学療法としての5-FUとCapecitabineのランダム化比較試験で,両者の有効性と安全性は同等であることが示された16,17)。また,フッ化ピリミジンに対するOXの上乗せ効果を検討したランダム化比較試験のうち3つの試験ではOXは有害事象を増加させるがpCR割合,局所制御率,生存率に対する効果は示されず16,18-20),1つの試験では有害事象に差はなく,pCR割合,無病生存率を有意に上昇させた21)。NCCNガイドラインでは併用化学療法として,5-FUまたはCape単剤を推奨している。
- (6)
- 術前化学放射線療法(chemoradiotherapy:CRT)にかわる治療戦略として全身薬物療法を術前治療に組み込んだTotal Neoadjuvant Therapy(TNT)の開発が行われ,複数の第Ⅲ相試験の結果が報告された。しかし,至適治療レジメンは確立されておらず,本邦における前向き試験の報告も乏しいため,安全性や有効性に関する今後の検証は必要である。(CQ 12)
- (7)
- 術前治療後に臨床的完全奏効(cCR)が達成された場合に手術を行わずに待機的な治療を行う非手術的管理(Non-Operative Management;NOM,積極的経過観察,Watch and Wait療法)については,現時点では推奨されない。(CQ 13)
-
術後照射
- (1)
- 術後照射の利点は,pT3以深またはpN陽性などの局所再発の高リスク群を選択して照射することができることである。術後照射の欠点は,術中の腫瘍細胞の散布を防止できないこと,骨盤底に癒着した小腸に照射され消化管の有害事象の頻度が高くなることである。また,術後は局所の血流は少なくなり,放射線感受性は低くなることである。
- (2)
- 術後照射は術後6~8週までに開始することが望ましい。
- (3)
- 術後照射により局所再発は減少するが,生存率の改善をもたらさないことが報告された22)。また,化学療法との併用では局所再発率は低下するものの急性期有害事象が増加し,GITSG23)およびMayo/NCCTG79-47-51試験24)は,Grade3以上の有害事象が25~50%に発生した。
- (4)
- 術前化学放射線療法と術後化学放射線療法を比較するランダム化比較試験では,5年生存率に差はなかったが,術前照射群で局所再発率が有意に低く,Grade 3以上の有害事象の頻度も有意に低かった。登録時に(腹会陰式)直腸切断術が必要と判断された症例のうち,括約筋温存が可能であった割合は術前照射群で有意に高かった25)。したがって,NCCNガイドラインをはじめとする欧米のガイドラインでは術前化学放射線療法を推奨している。
- (5)
- 補助放射線療法または化学放射線療法による腸管障害の症状として,頻便,便意切迫,排便困難感,便失禁,肛門の感覚異常などがある26,27)。
-
術中照射
局所再発の原因となる不十分な外科剝離面(RM),側方リンパ節などに対して腸管などの周囲正常組織を避けて重点的に腫瘍床に高線量を照射できる。 -
照射法
- a.
-
外部照射法
適応の原則は骨盤内に放射線治療歴がないことである。
〔治療計画〕- 標的体積には原発巣と転移リンパ節(術後は腫瘍床)に所属リンパ節領域を含めることが一般的である。所属リンパ節領域として,直腸間膜(直腸傍リンパ節含む),内腸骨リンパ節領域,閉鎖リンパ節領域,仙骨前リンパ節領域とし,腹側の臓器(膀胱,前立線,子宮,腟)に浸潤する場合には外腸骨リンパ節領域も含めることがある。肛門管腺癌または,肛門管に腫瘍が及ぶ直腸癌において,鼠径リンパ節を含めた照射野設定の妥当性は示されていない。
- 腹臥位での治療体位やベリーボードの使用を考慮するなどして,小腸を可及的に照射体積から避けるように努める。
- 小腸・膀胱の有害事象の発生を回避する観点から3門照射(後方および両側方)または4門照射(前後および両側方)が推奨される。
- 少なくとも6MV以上のX線発生装置で治療することが望ましい。また,側方からの照射は10MV以上での治療が推奨される。
- 術前化学放射線療法における強度変調放射線治療の有用性は認められていない28)。
- 1回1.8~2.0Gy,週5回の通常分割照射法が一般的である。
- 総線量は,術前照射の場合40~50.4Gy/20~28回,術後照射の場合50~50.4Gy/25~28回が一般的である。
- 切除不能な肉眼的病変が残存し,小腸などが照射体積内に含まれない場合には55~60Gy程度まで線量を増加することを考慮する。
- 術前照射,術後照射とも,化学療法との同時併用が標準的であり,併用化学療法は5-FU注1またはCape注2が標準である16,17,29-31)。
- b.
-
術中照射法
外科剝離面が陽性または剝離面に腫瘍が近接する場合に局所制御の向上を目的とする。
〔治療方法〕- 照射範囲は断端面,近接部位に対して設定する。
- 電子線照射を施行することが多いが,高線量率小線源を用いることもある32,33)。
- 使用する電子線のエネルギーは腫瘍の深さに応じておおむね9~15MeVなどを選択する。
- 外科剝離面が近接または顕微鏡的に陽性の場合は10~15Gy,肉眼的に陽性の場合は15~20Gy照射する。
注1 5-FU
225 mg/m2/日 持続静注 週5日または7日(放射線治療期間中)
注2 Cape
825 mg/m2/回 1日2回内服 週5日または7日(放射線治療期間中)
2)緩和的放射線療法
- a.
-
骨盤内病変
- 骨盤内腫瘍による疼痛,出血,便通障害などの症状緩和を目的とする。
- 1回1.8~2.0 Gy,総線量45~50 Gyを照射する。
- 全身状態,症状の程度によっては1回線量を多くして短期間で照射を終了することもある。
- b.
-
骨盤外病変
- (1)
-
骨転移
- 疼痛の軽減,病的骨折の予防,脊髄麻痺の予防と治療を目的とする。
- 通常照射では30 Gy/10回,20 Gy/5回,8 Gy/1回などの線量分割を用いることが多く,単回照射と分割照射で疼痛の奏効割合や消失率に差はないが,単回照射の方が疼痛再燃時の再照射率が高い傾向にある34)。定位放射線治療では,35 Gy/5回,24 Gy/2回などの線量分割が用いられる。
- (2)
-
肝転移
〔線量と分割法〕- 体幹部定位放射線治療では様々な線量分割が用いられるが,40~60 Gy/5回を適用することが多い。
- (3)
-
肺転移
〔線量と分割法〕- Ⅰ期非小細胞肺癌に対する定位放射線治療で用いられる線量分割を適用することが多く,末梢性の病変では40~55 Gy/3-5回,中枢性の病変では,60 Gy/8回や75 Gy/25回などの線量分割が主に用いられる。
- 肺転移による出血や気管支狭窄などの症状に対して,症状緩和を目的とした放射線治療は検討される。20~24 Gy/4~5回,30 Gy/10回,40~50 Gy/20~25回などの線量分割を用いることが多く,全身状態や予後を考慮して選択する。
- (4)
-
脳転移
- 「4.血行性転移」の項を参照。
- 全脳照射では30 Gy/10回が標準的であるが,全身状態や予後に応じて線量分割や総線量を決定する。
- 定位放射線治療は,脳転移の腫瘍径に応じ,線量分割を検討する。小さな脳転移には,標的体積辺縁で18~25 Gy/1回とし,3 cmを超え4~5 cm程度までの脳転移に対しては,分割定位放射線治療の適応となり,27~35 Gy/3~5回が用いられることが多い23)。
コメント
-
骨盤内病変
- 疼痛,出血などの自覚症状,QOLの改善を目的とした放射線治療は有効である。
- 遠隔転移を有さない切除不能直腸癌局所再発において,縮小してもR0切除が不可能な場合には,根治的放射線治療が行われることがある。(CQ 15)
- 45 Gy以上照射された群での症状緩和率は疼痛89%,出血79%,神経性症状52%,腫瘍の圧排による症状71%,滲出液50%,泌尿器科的症状22%,その他の症状42%であった35)。
- 症状緩和持続期間は3~10カ月である。
-
骨盤外病変
- 肝転移や肺転移,脳転移に対する定位放射線治療は,腫瘍縮小や消失,またはそれによる生存効果の改善を期待して行う。
- (1)
-
肝転移
- 5 cm以内,肝転移個数が3個以内の場合に,体幹部定位放射線治療の適応を考慮する。
- (2)
-
肺転移
- 5 cm以内,肺転移個数が3個以内の場合に,体幹部定位放射線治療の適応を考慮する。
- (3)
-
その他の部位
- 頸部リンパ節,傍大動脈リンパ節,鼠径リンパ節,縦隔・肺門リンパ節などのリンパ節転移に対する症状緩和を目的とした放射線治療が考慮されることがある。
文献
- Skibber JM, Hoff PM, Minsky BD, et al.: Cancer of the rectum. In: Devita VT, Hellman S, Rosenberg SA(eds). Cancer: principles and practice of oncology(6th ed). Philadelphia, Lippincott, Williams and Wilkins 2001; 1271-1318
- Yoshino T, Pentheroudakis G, Mishima S, et al.: JSCO-ESMO-ASCO-JSMO-TOS: international expert consensus recommendations for tumour-agnostic treatments in patients with solid tumours with microsatellite instability or NTRK fusions. Ann Oncol 2020; 31: 861-872
- Swedish Rectal Cancer Trial; Cedermark B, Dahlberg M, et al.: Improved survival with preoperative radiotherapy in resectable rectal cancer. N Engl J Med 1997; 336: 980-987
- Camma C, Giunta M, Fiorica F, et al.: Preoperative radiotherapy for resectable rectal cancer: A meta-analysis. JAMA 2000; 284: 1008-1015
- Colorectal Cancer Collaborative Group: Adjuvant radiotherapy for rectal cancer: a systematic overview of 8,507 patients from 22 randomised trials. Lancet 2001; 358: 1291-1304
- Kapiteijn E, Marijnen CA, Nagtegaal ID, et al.; Dutch Colorectal Cancer Group: Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001; 345: 638-646
- van Gijn W, Marijnen CA, Nagtegaal ID, et al.: Dutch Colorectal Cancer Group: Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol 2011; 12: 575-582
- Peeters KC, Marijnen CA, Nagtegaal ID, et al.; Dutch Colorectal Cancer Group: The TME trial after a median follow-up of 6 years: increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma. Ann Surg 2007; 246: 693-701
- Marijnen CA, van de Velde CJ, Putter H, et al.: Impact of short-term preoperative radiotherapy on health-related quality of life and sexual functioning in primary rectal cancer: report of a multicenter randomized trial. J Clin Oncol 2005; 23: 1847-1858
- Peeters KC, van de Velde CJ, Leer JW, et al.: Late side effects of short-course preoperative radiotherapy combined with total mesorectal excision for rectal cancer: increased bowel dysfunction in irradiated patients―a Dutch colorectal cancer group study. J Clin Oncol 2005; 23: 6199-6206
- Francois Y, Nemoz CJ, Baulieux J, et al.: Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: The Lyon R90-01 randomized trial. J Clin Oncol 1999; 17: 2396
- Bosset JF, Collette L, Calais G, et al.; EORTC Radiotherapy Group Trial 22921: Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med 2006; 355: 1114-1123
- Gérard JP, Conroy T, Bonnetain F, et al.: Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203. J Clin Oncol 2006; 24: 4620-4625
- Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al.: Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 2006; 93: 1215-1223
- Ngan SY, Burmeister B, Fisher RJ, et al.: Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol 2012; 30: 3827-3833
- Hofheinz RD, Wenz F, Post S, et al.: Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol 2012; 13: 579-588
- Allegra CJ, Yothers G, O’Connell MJ, et al.: Neoadjuvant 5-FU or capecitabine plus radiation with or without oxaliplatin in rectal cancer patients: A phase Ⅲ randomized clinical trial. J Natl Cancer Inst 2015; 107: djv248
- Aschele C, Cionini L, Lonardi S, et al.: Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase Ⅲ trial. J Clin Oncol 2011; 29: 2773-2780
- Gérard JP, Azria D, Gourgou-Bourgade S, et al.: Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase Ⅲ trial ACCORD 12/0405-Prodige 2. J Clin Oncol 2010; 28: 1638-1644
- Gérard JP, Azria D, Gourgou-Bourgade S, et al.: Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer. J Clin Oncol 2012; 30: 4558-4565
- Rödel C, Graeven U, Fietkau R, et al.; German Rectal Cancer Study Group: Oxaliplatin added to fluorouracil-based preoperative chemoradiotherapy and postoperative chemotherapy of locally advanced rectal cancer(the German CAO/ARO/AIO-04 study): final results of the multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2015; 16: 979-989
- Wolmark N, Wieand HS, Hyams DM, et al.: Randomized trial of postoperative adjuvant chemotherapy with or without radiotherapy for carcinoma of the rectum: National Surgical Adjuvant Breast and Bowel Project protocol R-02. J Natl Cancer Inst 2000; 92: 388-396
- Douglass HO, Moertel CG, Mayer RJ, et al.: Survival after postoperative combination treatment of rectal cancer. N Engl J Med 1986; 315: 1294-1295
- Krook JE, Moertel CG, Gunderson LL, et al.: Effective surgical adjuvant therapy for high-risk rectal carcinoma. N Engl J Med 1991; 324: 709-715
- Sauer R, Becker H, Hohenberger W, et al.; German Rectal Cancer Study Group: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351: 1731-1740
- Gervaz PA, Wexner SD, Pemberton JH: Pelvic radiation and anorectal function: introducing the concept of sphincter- preserving radiation therapy. J Am Coll Surg 2002; 195: 387-394
- Temple LK, Wong WD, Minsky B: The impact of radiation on functional outcomes in patients with rectal cancer and sphincter preservation. Semin Radiat Oncol 2003; 13: 469-477
- Hong TS, Moughan J, Garofalo MC, et al.: NRG Oncology Radiation Therapy Oncology Group 0822: A phase 2 study of preoperative chemoradiation therapy using intensity modulated radiation therapy in combination with capecitabine and oxaliplatin for patients with locally advanced rectal cancer. Int J Radiat Oncol Biol Phys 2015; 93: 29-36
- NIH consensus conferenc: Adjuvant therapy for patients with colon and rectal cancer. JAMA 1990; 264: 1444-1450
- O’Connell MJ, Martenson JA, Wieand HS, et al.: Improving adjuvant therapy for rectal cancer by combining protracted- infusion fluorouracil with radiation therapy after curative surgery. N Engl J Med 1994; 331: 502-507
- Smalley SR, Benedetti JK, Williamson SK, et al.: Phase Ⅲ trial of fluorouracil-based chemotherapy regimens plus radiotherapy in postoperative adjuvant rectal cancer: GI INT 0144. J Clin Oncol 2006; 24: 3542-3547
- Nakfoor BM, Willett CG, Shellito PC, et al.: The impact of 5-fluorouracil and intraoperative electron beam radiation therapy on the outcome of patients with locally advanced primary rectal and rectosigmoid cancer. Ann Surg 1998; 228: 194-200
- Strassmann G, Walter S, Kolotas C, et al.: Reconstruction and navigation system for intraoperative brachytherapy using the flab technique for colorectal tumor bed irradiation. Int J Radiat Oncol Biol Phys 2000; 47: 1323-1329
- Rich SE, Chow R, Raman S, et al.: Update of the systematic review of palliative radiation therapy fractionation for bone metastases. Radiother Oncol 2018; 126: 547-557
- Wong CS, Cummings BJ, Brierley JD, et al.: Treatment of locally recurrent rectal carcinoma―results and prognostic factors. Int J Radiat Oncol Biol Phys 1998; 40: 427-435
7 緩和医療・ケア
- 緩和医療・ケアとは,患者のQOLの維持,向上を目的としたケアの総称である。
- 緩和医療・ケアは,がんの診断がついた時点から終末期までを包括する医療であり,病期や症状により,実施すべき内容が異なる。
- がん治療は症状緩和が図られた状態で行うことが原則であり1),外科治療や薬物療法の当初から緩和医療を導入するのが望ましい。
-
大腸癌終末期におけるQOL向上のための緩和医療には以下のものが含まれる。
- (1)
- 疼痛緩和
- (2)
- 外科治療
- (3)
- 薬物療法
- (4)
- 放射線療法
- (5)
- 精神症状に対するカウンセリング
コメント
- 疼痛緩和のための薬物療法は,WHOがん疼痛ガイドライン2)および日本緩和医療学会の『がん疼痛の薬物療法に関するガイドライン』3)に基づいて行うことが望ましい。
- 骨盤内再発における癌性疼痛(臀部痛など)には神経ブロック4)が有効なことがある。
- 骨盤内再発や骨転移などによる疼痛には放射線照射5-7)が有効なことがある。(「2)緩和的放射線療法」を参照)
- 疼痛の責任病巣(原発巣や皮下転移,リンパ節転移など)に対する姑息的切除,責任病巣のバイパス手術8)・人工肛門造設9)などの外科治療が有効なことがある。
- 腸管閉塞による経口摂取不能状態の改善や出血のコントロールを目的として,姑息的切除術,バイパス手術,人工肛門造設術を考慮する。外科治療が不可能で薬物治療の予定のない腸管閉塞に対しては経肛門的なステント留置10,11)が推奨される(CQ 4)。随伴する嘔気・嘔吐などの消化器症状の緩和には酢酸オクトレオチド12,13)投与が有効なことがある。
- 尿管閉塞に対して,尿管ステント留置や腎瘻造設術などを考慮する。
- 疾病や予後に対する不安に対してはカウンセリングが有用である14)。精神症状には,適切な薬物療法による症状緩和を行う。
- 大腸癌における緩和医療の生命予後への寄与度は明らかでないが,緩和ケアの早期導入により肺癌患者のQOLが向上し,生存期間が有意に延長したとの報告がある15)。
- 緩和医療のアウトカム計測のためのQOL評価法の確立が課題である。大腸癌術後のQOL評価法にはEORTC-QLQ-CR3816)があり,疼痛緩和における代表的なQOL評価法にはBrief Pain Inventory(BPI)17)がある。当面は,これらの評価法を利用しながらQOLを評価し,データを集積していくことが望ましい。
文献
- Chow E, Harris K, Fan G, et al.: Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol 2007; 25: 1423-1436
- WHO Guidelines for the pharmacological and radiotherapeutic management of cancer pain in adults and adolescents. 2019 https://www.who.int/publications/i/item/9789241550390(2024/5/14 accessed)
- 日本緩和医療学会緩和医療ガイドライン委員会編: がん疼痛の薬物療法に関するガイドライン2020年版 第3版,金原出版,東京,2020
- Foley KM: The treatment of cancer pain. N Engl J Med 1985; 313: 84-95
- Suzuki K, Gunderson LL, Devine RM, et al.: Intraoperative irradiation after palliative surgery for locally recurrent rectal cancer. Cancer 1995; 75: 939-952
- Nymann T, Jess P, Christiansen J: Rate and treatment of pelvic recurrence after abdominoperineal resection and low anterior resection for rectal cancer. Dis Colon Rectum 1995; 38: 799-802
- Tong D, Gillick L, Hendrickson FR: The palliation of symptomatic osseous metastases. Final results of the study by the radiation therapy oncology group. Cancer 1982; 50: 893-899
- Helyer LK, Law CH, Butler M, et al.: Surgery as a bridge to palliative chemotherapy in patients with malignant bowel obstruction from colorectal cancer. Ann Surg Oncol 2007; 14: 1264-1271
- 中田 健,冨田尚裕,岡村 修,他: 切除不能進行癌・再発癌に対する緩和的人工肛門造設術の検討.外科治療2007; 96: 101-105
- Law WL, Choi HK, Lee YM, et al.: Palliation for advanced malignant colorectal obstruction by self-expanding met al.lic stents; prospective evaluation of outcomes. Dis Colon Rectum 2004; 47: 39-43
- Khot UP, Lang AW, Murali K, et al.: Systemic review of the efficacy and safety of colorectal stents. Br J Surg 2002; 89: 1096-1102
- Baines M, Oliver DJ, Carter RL, et al.: Medical management of intestinal obstruction in patients with advanced malignant disease. A clinical and pathological study. Lancet 1985; 2: 990-993
- Ripamonti C, Twycross R, Baines M, et al.; Working Group of the European Association for Palliative Care: Clinical-practice recommendations for the management of bowel obstruction in patients with end-stage cancer. Support Care Cancer 2001; 9: 223-233
- Maguire P, Walsh S, Jeacock J, et al.: Physical and psychological needs of patients dying from colo-rectal cancer. Palliative Medicine 1999; 13: 45-50
- Temel JS, Greer JA, Muzikansky A, et al.: Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010; 363: 733-742
- Sprangers MA, te Verde A, Aaronson NK: The construction and testing of the EORTC colorectal cancer-specific quality of life questionnaire module(QLQ-CR38). European Organization for Research and Treatment of Cancer Study Group on Quality of Life. Eur J Cancer 1999; 35: 238-247
- Uki J, Mendoza T, Charles MS, et al.: A brief cancer pain assessment tool in Japanese: The utility of the Japanese Brief Pain Inventory-BPI-J. J Pain Symptom Manage 1998; 16: 364-373
8 大腸癌手術後のサーベイランス
1)大腸癌根治度A切除後の再発に関するサーベイランス
- (1)
- pStage 0(pTis癌)は,切除断端や吻合部の再発を対象とした定期的な内視鏡検査を考慮する。他臓器の再発を対象としたサーベイランスは不要である。
- (2)
-
pStage Ⅰ~pStage Ⅲは,肝,肺,局所,吻合部,リンパ節,腹膜などの再発をサーベイランスする。以下の点に留意する。
- サーベイランス期間は術後5年間を目安とし,術後3年以内はサーベイランス間隔を短めに設定する。
- 直腸癌では肺転移再発と局所再発の頻度が高いことに留意する。
- 再発の好発部位,発生頻度,治療効果や,本邦での臨床実状を総合的に判断して導き出された,pStage Ⅰ~pStage Ⅲ大腸癌の治癒切除後に推奨されるサーベイランススケジュールの一例を示す。
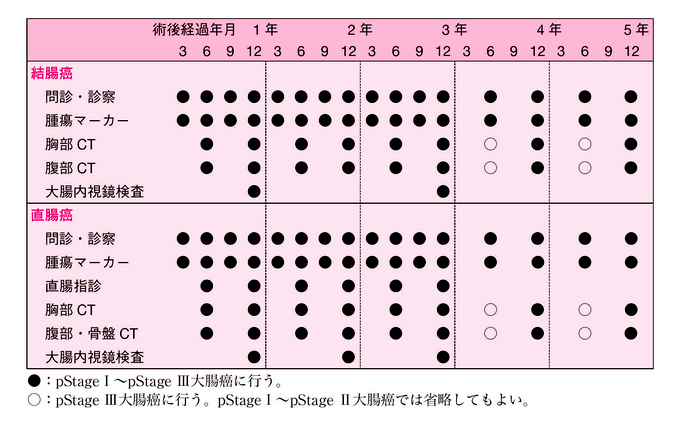
2)大腸癌根治度B切除後および再発巣切除後のサーベイランス
- (1)
- pStage Ⅳ症例のR0切除後(根治度B)と再発巣切除症例のサーベイランスは,Stage Ⅲの内容に準ずるが,転移・再発の切除臓器に再発・再々発が多いこと,5年以降の再発頻度も比較的高いことに留意する。
- (2)
- R1切除のために根治度Bとなった症例は,遺残が疑われる臓器を標的とした綿密なサーベイランスを計画する。
3)異時性多重がんのサーベイランス
- 異時性多発癌のサーベイランスを目的として大腸内視鏡検査を行う。
コメント
-
サーベイランスの目的と対象
- 再発を早期に発見し治療することで予後を改善することを目的とする1)。したがって,再発が発見された際に治療が可能な患者に対してサーベイランスを行う2)。
-
再発率,再発時期,再発臓器
- (1)
-
再発期間と再発臓器ごとの再発率(図2,表7,表9~10 参照)。
- 再発は術後3年以内に約87%以上,術後5年以内に97%以上が出現した。
- 術後5年を超えてからの再発は全症例の0.5%以下であった。
- 肝転移に比較して,肺再発の出現時期は遅い傾向があった。
- 肺再発と局所再発,吻合部再発は直腸癌に多く,腹膜転移再発は結腸癌に多かった。
- (2)
-
pStage別特徴(図1,表7~8参照)
-
1.pStage Ⅰ
- 結腸癌,直腸癌の再発率はそれぞれ3.0%,7.2%であり,直腸癌に高かった。
- pT1癌の再発率は3.8%で,pT2癌の再発率は5.9%であった。
- pStage Ⅱ,pStage Ⅲ症例と比較して再発の出現時期がやや遅く,再発症例の約5%が5年を超えて出現した。一方,これらの症例の全症例に対する割合は約0.2%であった。
-
2.pStage Ⅱ,pStage Ⅲ
- pStage Ⅱ,pStage Ⅲの再発率はそれぞれ14.2%,28.7%であった。
- 両ステージ共に術後3年以内に再発の85%以上が出現した。
- 全症例に占める5年を超えてからの再発症例の割合は,pStage Ⅱで約0.4%,pStage Ⅲでは0.7%であった。
-
1.pStage Ⅰ
-
再発巣検索法
- (1)
-
問診・診察
- 患者の訴えを聴取し,身体所見をとる(腹部所見,直腸指診など)。
- 直腸指診は,低位前方切除術後の吻合部再発や直腸子宮窩,直腸膀胱窩の再発の診断に有用である。
- (2)
-
腫瘍マーカー
- 血清CEAと血清CA19-9を測定する。
- (3)
-
胸部CT
- 胸部CTにて肺転移,縦隔や頸部のリンパ節転移を検索する。
- 胸部CTを省略して胸部単純X線検査を行う方法もあるが3),単純X線検査は空間分解能が低く,切除可能な肺転移を見逃す危険性があることに留意する4)。
- (4)
-
腹部CT
- 腹部CTにて肝転移などの腹部再発巣を検索する。疑診例には腹部MRIを行う。
- 腹部CTを省略して腹部超音波検査を行う方法もあるが3),超音波検査の診断精度は検者の技量や検査臓器周囲の腸管の存在に影響される。造影超音波検査も行われるが5),リンパ節転移の検索も同時に行うことができるCTが推奨される6-8)。
- (5)
-
骨盤CT
- 直腸癌の局所(骨盤内)再発を検索する。
- 再発巣と術後の瘢痕との鑑別は困難である。そのため,基準となる骨盤CTを術後早期に行う方法もある9)。
- 骨盤内再発疑診例には骨盤MRI,endoluminal ultrasonography,PET/CTを考慮する10-12)。
- (6)
-
MRI
- 肝転移巣や骨盤内再発巣の確認にMRIを考慮する。
- (7)
-
PET/CT
- 再発疑診例における再発部位の検索と確定に有用であるが13),ランダム化比較試験においても,定期的なPET/CTの施行は切除可能な再発巣検出の増加に寄与しないことが示されており14),サーベイランスを目的とした検査法としては推奨されない7)。
- (8)
-
大腸内視鏡検査
- 吻合部再発を検索する。経肛門的局所切除,低位前方切除などの局所再発のリスクが高い術式を施行した症例においては吻合部の評価を術後早期(術後3~6カ月後15,16),術後6~12カ月後17))に行うことを推奨するガイドラインもある。
- 異時性多発癌病巣の発見にも有効である(「⑦異時性多重がんのサーベイランス」参照)。
- (9)
-
CT colonography
- 吻合部再発の検索や異時性多発癌病巣の発見に有効であるとの報告もあるが18,19),その精度に関する評価は十分に検証されておらず15),6 mm以上の腺腫の発見率は大腸内視鏡検査に劣ることが示されている20)。
-
サーベイランスの有効性
- 欧米で行われたランダム化比較試験の複数のメタアナリシスにおいて,大腸癌治癒切除術後のサーベイランスが再発巣の切除率向上と予後の改善に寄与することが示されている21-27)。一方,近年の研究においてもintensiveなサーベイランスによる再発切除率の向上は示されているが28,29),全生存率の改善には否定的な結果も報告されている29-31)。至適サーベイランスの確立に向けて,サーベイランスがもたらすQOL低下や精神的負担,検査の合併症,医療経済への影響を含めた包括的な研究が望まれる32,33)。
-
大腸癌根治度A切除後のサーベイランス
- サーベイランススケジュールは,Stageごとの再発頻度,再発の好発部位や発生時期に加え,本邦におけるサーベイランスの現況などを考慮して作成したものである。
- ガイドラインごとに診断モダリティやスケジュールの疎密度に差があるが,欧米の代表的なガイドライン(NCCN7),ESMO6),ASCO2),ASCRS8))と比較すると本邦における現状のサーベイランス方法は概してintensiveである。
- 再発後の治療効果に関して,Stageによる差はないことが示されている34)。したがって進行度の低い癌に対してもサーベイランスによるsurvival benefitは期待できるが,早期発見に関わる費用対効果はより進行度の高い癌に劣る。現在のところ予後への寄与度が高く,医療経済学的に効率的なことが科学的に検証されたサーベイランスプロトコールは存在しない。
-
大腸癌根治度B切除後と再発巣切除後のサーベイランス
- 肝切除後の残肝,肺切除後の残肺など,切除した転移巣や再発巣と同一部位に再発,再々発することが多い。
- 術後2年間は転移・再発巣の切除臓器のサーベイランスをよりintensive(3~6カ月毎)に行う方法もある7,35)。
- 推奨すべきサーベイランス期間は定まっていない1,36)。本邦22施設における18,841例の根治切除症例の後方視的解析では,術後5年無再発生存の患者がそれ以降に再発する頻度はStage Ⅳにおいて比較的高率であり(Stage Ⅰ 0.7%,Ⅱ 1.1%,Ⅲ 2.2%,Ⅳ 7.0%),Stage Ⅳ(根治度B)症例に対する5年以降のサーベイランスの必要性も提唱されている37)。
-
異時性多重がんのサーベイランス(CQ 27)
- Stageにかかわらず大腸癌の罹患歴は,異時性大腸癌発生のリスク要因である38,39)。
- 推奨される大腸内視鏡検査間隔は報告によって異なるが,異時性大腸癌の発見率は術後3年までに高く40),術後1年時に初回の検査を行うことが推奨される6-8)。一方,狭窄などのために,術前に全大腸を十分に検索できなかった場合は,術後6カ月以内に残存大腸の検査を行うことが望ましい7,8,15)。
- 多重がんを標的としたサーベイランスの要否に関しては,遺伝性大腸癌を鑑別することが重要である41)。散発性大腸癌の手術後に他臓器がん(重複がん)の精査を定期的に行う根拠は乏しい。
文献
- van der Stok EP, Spaander MCW, Gru¨nhagen DJ, et al.: Surveillance after curative treatment for colorectal cancer. Nat Rev Clin Oncol 2017; 14: 297-315
- Meyerhardt JA, Mangu PB, Flynn PJ, et al.; American Society of Clinical Oncology: Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 2013; 31: 4465-4470
- Costas-Chavarri A, Nandakumar G, Temin S, et al.: Treatment of Patients With Early-Stage Colorectal Cancer: ASCO Resource-Stratified Guideline. J Glob Oncol 2019: 5: 1-19
- Desch CE, Benson AB 3rd, Somerfield MR, et al.; American Society of Clinical Oncology: Colorectal cancer surveillance: 2005 update of an American Society of Clinical Oncology practice guideline. J Clin Oncol 2005; 23: 8512-8519
- Labianca R, Nordlinger B, Beretta GD, et al.; ESMO Guidelines Working Group: Early colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24 Suppl 6: vi64-vi72
- Argilés G, Tabernero J, Labianca R, et al.; ESMO Guidelines Committee.: Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020; 31: 1291-1305
- National Comprehensive Cancer Network: NCCN clinical practice guidelines in oncology-colon cancer, version 3, 2023 http://www.nccn.org/professionals/physician_gls/pdf/colon.pdf(accessed 5 October 2023)
- Hardiman KM, Felder SI, Friedman G, et al.; Prepared on behalf of the Clinical Practice Guidelines Committee of the American Society of Colon and Rectal Surgeons: The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Surveillance and Survivorship Care of Patients After Curative Treatment of Colon and Rectal Cancer. Dis Colon Rectum 2021; 64: 517-533
- 渡辺 正,豊田美知子,伊藤勝基,他: 直腸癌局所再発診断における経時的骨盤部CT撮影の意義.日本大腸肛門病会誌1989; 42: 1031-1038
- Ramirez JM, Mortensen NJM, Takeuchi N, et al.: Endoluminal ultrasonography in the follow-up of patients with rectal cancer. Br J Surg 1994; 81: 692-694
- Löhnert MSS, Doniec JM, Henne-Bruns D: Effectiveness of endoluminal sonography in the identification of occult local rectal cancer recurrences. Dis Colon Rectum 2000; 43: 483-491
- Moore HG, Akhurst T, Larson SM, et al.: A case-controlled study of 18-fluorodeoxyglucose positron emission tomography in the detection of pelvic recurrence in previously irradiated rectal cancer patients. J Am Coll Surg 2003; 197: 22-28
- Flanagan FL, Dehdashti F, Ogunbiyi OA, et al.: Utility of FDG-PET for investigating unexplained plasma CEA elevation in patients with colorectal cancer. Ann Surg 1998; 227: 319-323
- Monteil J, Le Brun-Ly V, Cachin F, et al.: Comparison of 18FDG-PET/CT and conventional follow-up methods in colorectal cancer: A randomized prospective study. Dig Liver Dis 2021; 53: 231-237
- Kahi CJ, Boland CR, Dominitz JA, et al.: Colonoscopy Surveillance After Colorectal Cancer Resection: Recommendations of the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2016; 150: 758-768
- Rusiecki J, Cifu AS: Colonoscopy surveillance after colorectal cancer resection. JAMA 2017; 318: 2346-2347
- Steele SR, Chang GJ, Hendren S, et al.; Clinical Practice Guidelines Committee of the American Society of Colon and Rectal Surgeons: Practice Guideline for the Surveillance of Patients After Curative Treatment of Colon and Rectal Cancer. Dis Colon Rectum 2015; 58: 713-725
- Pickhardt PJ, Edwards K, Bruining DH, et al.: Prospective Trial Evaluating the Surgical Anastomosis at One-Year Colorectal Cancer Surveillance: CT Colonography Versus Optical Colonoscopy and Implications for Patient Care. Dis Colon Rectum 2017; 60: 1162-1167
- Porté F, Uppara M, Malietzis G, et al.: CT colonography for surveillance of patients with colorectal cancer: Systematic review and meta-analysis of diagnostic efficacy. Eur Radiol 2017; 27: 51-60
- Weinberg DS, Pickhardt PJ, Bruining DH, et al.: Computed Tomography Colonography vs Colonoscopy for Colorectal Cancer Surveillance After Surgery. Gastroenterology 2018; 154: 927-934. e4
- Renehan AG, Egger M, Saunders MP, et al.: Impact on survival of intensive follow up after curative resection for colorectal cancer: systematic review and meta-analysis of randomised trial. BMJ 2002; 324: 813
- Figueredo A, Rumble RB, Maroun J, et al.; Gastrointestinal Cancer Disease Site Group of Cancer Care Ontario’s Program in Evidence-based Care: Follow-up of patients with curatively resected colorectal cancer: a practice guideline. BMC Cancer 2003; 6: 26
- Renehan AG, Egger M, Saunders MP, et al.: Mechanisms of improved survival from intensive followup in colorectal cancer: a hypothesis. Br J Cancer 2005; 92: 430-433
- Jeffery M, Hickey BE, Hider PN: Follow-up strategies for patients treated for non-metastatic colorectal cancer. Cochrane Database Syst Rev 2007; 24: CD002200
- Tjandra JJ, Chan MK: Follow-up after curative resection of colorectal cancer: a meta-analysis. Dis Colon Rectum 2007; 50: 1783-1799
- Pita-Fernández S, Alhayek-Aí M, González-Martín C, et al.: Intensive follow-up strategies improve outcomes in nonmetastatic colorectal cancer patients after curative surgery: a systematic review and meta-analysis. Ann Oncol 2015; 26: 644-656
- Zhao Y, Yi C, Zhang Y, et al.: Intensive follow-up strategies after radical surgery for nonmetastatic colorectal cancer: A systematic review and meta-analysis of randomized controlled trials. PLoS One 2019; 14: e0220533
- Primrose JN, Perera R, Gray A, et al.; FACS Trial Investigators: Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer: the FACS randomized clinical trial. JAMA 2014; 311: 263-270
- Jeffery M, Hickey BE, Hider PN. Follow-up strategies for patients treated for non-metastatic colorectal cancer. Cochrane Database Syst Rev 2019; 9: CD002200
- Mokhles S, Macbeth F, Farewell V, et al.: Meta-analysis of colorectal cancer follow-up after potentially curative resection. Br J Surg 2016; 103: 1259-1268
- Wille-Jørgensen P, Syk I, Smedh K, et al.; COLOFOL Study Group: Effect of More vs Less Frequent Follow-up Testing on Overall and Colorectal Cancer-Specific Mortality in Patients With Stage Ⅱ or Ⅲ Colorectal Cancer: The COLOFOL Randomized Clinical Trial. JAMA 2018; 319: 2095-2103
- Kuntz KM, Popp J, Beck JR, et al.: Cost-effectiveness of surveillance with CT colonography after resection of colorectal cancer. BMJ Open Gastro 2020; 7: e000450
- Allaire B, Skinner R, King G, et al.: An economic evaluation of reducing colorectal cancer surveillance intensity. J Comp Eff Res 2022; 11: 99-107
- Tsikitis VL, Malireddy K, Green EA, et al.: Postoperative surveillance recommendations for early stage colon cancer based on results from the clinical outcomes of surgical therapy trial. J Clin Oncol 2009; 27: 3671-3676
- Metcalfe MS, Mullin EJ, Maddern GJ: Choice of surveillance after hepatectomy for colorectal metastases. Arch Surg 2004; 139: 749-754
- Hyder O, Dodson RM, Mayo SC, et al.: Post-treatment surveillance of patients with colorectal cancer with surgically treated liver metastases. Surgery 2013; 154: 256-265
- Okamura R, Hida K, Nishizaki D, et al.: Proposal of a stage-specific surveillance strategy for colorectal cancer patients: A retrospective analysis of Japanese large cohort. Eur J Surg Oncol 2018; 44: 449-455
- Green RJ, Metlay JP, Propert K, et al.: Surveillance for second primary colorectal cancer after adjuvant chemotherapy: an analysis of Intergroup 0089. Ann Intern Med 2002; 136: 261-269
- 石黒めぐみ,望月英隆,杉原健一,他: 大腸癌に合併する多発癌・重複がんに関するフォローアップについて.日本大腸肛門病会誌2006; 59: 863-868
- Fuccio L, Rex D, Ponchon T, et al.: New and Recurrent Colorectal Cancers After Resection: a Systematic Review and Meta-analysis of Endoscopic Surveillance Studies. Gastroenterology 2019; 156: 1309-1323.e3
- 大腸癌研究会編: 遺伝性大腸癌診療ガイドライン2024年版,金原出版,東京,2024年









