
各論
Ⅲ.リンチ症候群(Lynch syndrome)
Ⅲ-1 概要
- リンチ症候群は,DNAミスマッチ修復(mismatch repair:MMR)遺伝子の生殖細胞系列病的バリアントを主な原因とする常染色体顕性遺伝(優性遺伝)性疾患である(サイドメモⅢ-1:Germline epimutation)。MMR機構の破綻による特徴的な病理組織学的所見を示す大腸癌と子宮内膜癌を主徴とする。患者・血縁者内にさまざまな関連腫瘍が発生するため,サーベイランスや治療が必要となる。なお,診断は遺伝学的検査によってのみ実施されるが,2024年1月現在,本邦では保険適用外である。
サイドメモⅢ-1
■Germline epimutation
リンチ症候群の一部で,腫瘍発生にエピミューテーション(epimutation)が関与していることが明らかにされた。エピミューテーションとは,塩基配列には変化がないが,DNAのメチル化異常など遺伝子発現に関わる分子の修飾により遺伝子発現に変化をもたらす現象である。まれではあるが,生殖細胞系列のMLH1プロモーター領域異常メチル化がリンチ症候群の原因になることが報告されている1)。
Ⅲ-1-1 臨床的特徴
- リンチ症候群患者に発生する大腸癌は散発性の大腸癌に比べ,1)若年発症,2)多発性(同時性,異時性)で,3)右側結腸に好発し,4)低分化腺癌の頻度が高い。また,腫瘍内リンパ球浸潤,髄様増殖,粘液癌・印環細胞癌様分化,Crohn様リンパ球反応などの病理組織学的特徴がある2-5)(Ⅲ-2-1-2:ミスマッチ修復(MMR)異常を示す大腸癌に特徴的な病理組織学的所見)。
- また,大腸癌以外に,子宮内膜癌をはじめ,さまざまな関連腫瘍が発生する(Ⅲ-1-3:関連腫瘍)。
Ⅲ-1-2 原因遺伝子とがん化のメカニズム
Ⅲ-1-2-1 原因遺伝子と遺伝形式
- 第2番染色体上のMSH2(2p21-p16),MSH6(2p16.3),EPCAM(2p21)
- 第3番染色体上のMLH1(3p22.2)
- 第7番染色体上のPMS2(7p22.1)
- 常染色体顕性遺伝(優性遺伝)
- これらの原因遺伝子のいずれかに生殖細胞系列病的バリアントが同定された場合にリンチ症候群と診断される。
Ⅲ-1-2-2 がん化のメカニズム
- リンチ症候群では,MMR遺伝子の片方のアレルに生殖細胞系列の病的バリアントを有しており,後天的にもう片方の野生型アレルに変異(あるいはプロモーター領域のメチル化)が加わるとMMR機構が損なわれる。その結果,ゲノムの単純な反復配列であるマイクロサテライト領域に反復回数の異常(不安定性)が好発するようになる。腫瘍抑制(TGFBR2など),細胞増殖,DNA修復(MSH3,MSH6など)やアポトーシス(BAXなど)などに関わる遺伝子産物(蛋白質)をコードする領域には反復配列が含まれており,これらの領域に変異が起こりやすい。これらのMMR遺伝子がコードする同名の蛋白質はそれぞれ特異的なMMR蛋白質とヘテロダイマー(ヘテロ二量体)を形成し,DNA複製時におけるDNAポリメラーゼの校正機能をすり抜けた一塩基置換や数塩基までの挿入や欠失(ミスマッチ)を認識する。
- EPCAMは,MSH2の上流に隣接する遺伝子で,この遺伝子の3’側(後半部分,転写を終結するのに必要な配列)の欠失がリンチ症候群の原因となる。この欠失によりMSH2のプロモーター領域に異常メチル化が起こり,MSH2蛋白質の発現が消失する。
- リンチ症候群における大腸癌においても,散発性の大腸癌と同様に腺腫からがん化する経路の存在が示唆されている。詳細は不明な点も多い(図Ⅰ-3:FAPとリンチ症候群の代表的ながん化のメカニズム)。
Ⅲ-1-3 関連腫瘍
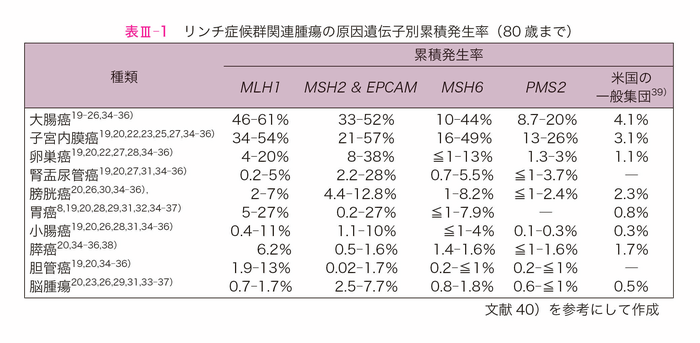
- リンチ症候群では大腸癌以外に,子宮内膜癌,卵巣癌,胃癌,小腸癌,胆道癌,膵癌,腎盂・尿管癌,脳腫瘍,皮膚腫瘍(サイドメモⅢ-2:Muir-Torre症候群)など多彩な悪性腫瘍(関連腫瘍)が発生する。乳癌,膀胱癌6),前立腺癌7)についてもリンチ症候群関連腫瘍の可能性が報告されている8)。リンチ症候群における関連腫瘍の発生リスクは,大腸癌と子宮内膜癌が高いが,原因遺伝子の種類や病的バリアントのタイプ,環境因子などにより異なる。また病的バリアント保持者(以下「バリアント保持者」とする)に関連腫瘍が必ず発生するとは限らない3,9-15)(表Ⅲ-1)。
- EPCAMに限局した欠失例では,MSH2に病的バリアントを有するリンチ症候群と比べて,悪性腫瘍の発生リスクリスクはそれほど変わらないが,MSH2に比べて子宮内膜癌のリスクは低い16)。EPCAMからMSH2の5’側を包む欠失例では,MSH2に病的バリアントを有するリンチ症候群と変わらない悪性腫瘍の発生リスクを示す17)。EPCAM欠失は,リンチ症候群の1~3%の原因となることが報告されている18)。
サイドメモⅢ-2
■Muir-Torre症候群/Muir-Torre syndrome
大腸癌をはじめとする種々のリンチ症候群関連腫瘍に皮脂腺腫瘍(皮脂腺腫,皮脂腺上皮腫,皮脂腺癌)や角化棘細胞腫などを合併する疾患。主にMSH2の生殖細胞系列病的バリアントが認められると報告される41)。
Ⅲ-1-4 疫学的特徴
- 海外からの報告によると,リンチ症候群の頻度は一般集団で279~654人に1人42-44),全大腸癌の2.4~3.7%を占めると推定されている45,46)。一方,本邦では全大腸癌0.7~1.01%と報告されている47,48)。
Ⅲ-2 診断
Ⅲ-2-1 診断の流れ
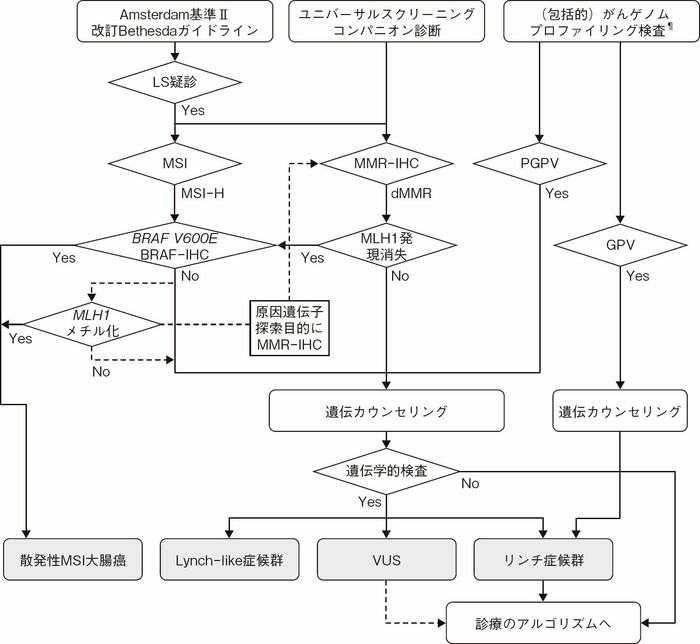
- 粘膜内癌を除く大腸癌患者(浸潤癌)を診療する場合に,リンチ症候群は以下のSTEPにしたがって診断する(図Ⅲ-1)。また,診断の補助となる臨床病理学的所見や検査方法を挙げる。
| STEP 1: | 以下 1)~5)で該当するカテゴリーを確認する
| ||||||||
| STEP 2: | 腫瘍組織のMSI検査,あるいはMMR-IHC検査を行い,MSI-HighまたはMMR蛋白質の消失を確認する。(サイドメモⅢ-3:MSI検査の方法と結果の評価)
| ||||||||
| STEP 3: | 確定診断として,MMR遺伝子の生殖細胞系列における病的バリアントを同定する(保険収載されていない)。腫瘍組織と非腫瘍組織の両方を用いたCGP検査で生殖細胞系列病的バリアントが直接的に同定された場合でかつ,生殖細胞系列所見の開示希望がある場合は,遺伝カウンセリングと共に結果を開示する。 |
図Ⅲ-1 リンチ症候群の診断手順
LS:リンチ症候群,MMR:ミスマッチ修復,IHC:免疫組織化学,MSI:マイクロサテライト不安定性,MSI—H:高頻度マイクロサテライト不安定性,PGPV:生殖細胞系列病的バリアント疑い,GPV:生殖細胞系列病的バリアント,VUS:意義不明バリアント
¶:エクソン単位の異常などはがんゲノムプロファイリング検査で検出されないことがある
臨床病理学的所見に基づく基準

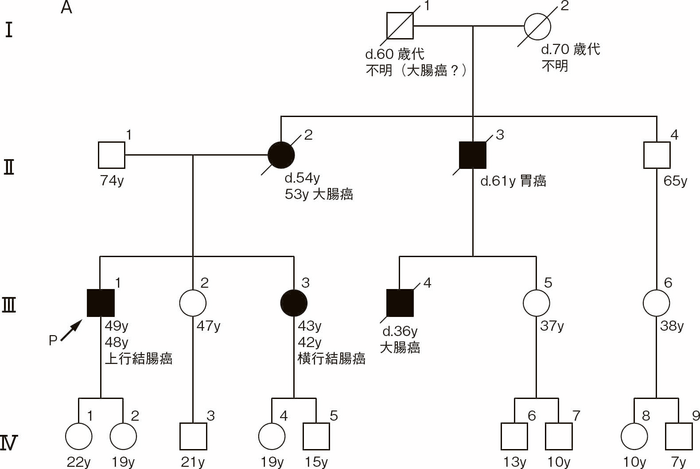
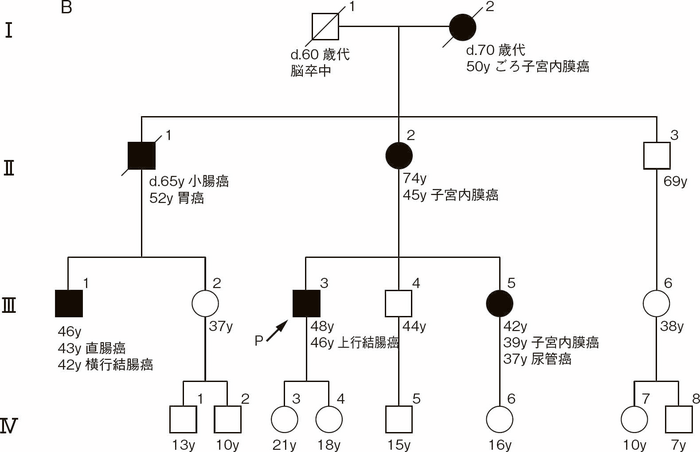
図Ⅲ-2 Amsterdam基準Ⅱ49)に合致する家族歴(付録:家系図の記載法参照)
A:大腸癌の多発家系
B:大腸癌以外の関連腫瘍多発家系

Ⅲ-2-1-1 ユニバーサルスクリーニング
- 欧米では全て(あるいは70歳以下)の大腸癌に対し,MSI検査やMMR-IHC検査を行うユニバーサルスクリーニングがリンチ症候群の診断に関し,感度と費用対効果の高い方法として推奨されている(CQ6)。
- MSI検査,MMR-IHC検査,および両者の併用によるスクリーニング感度は,プール解析においてそれぞれ0.93(95%信頼区間 0.87-0.96),0.91(95%信頼区間 0.85-0.95), 0.97(95%信頼区間 0.90-0.99)と,いずれも高い感度が示されている52)。
- ユニバーサルスクリーニングから得られた大腸癌患者に占めるリンチ症候群の頻度は,海外から2.4~3.7%45,46),本邦から0.7~1.01%との報告されており,本邦におけるユニバーサルスクリーニングの効率は海外と比較して低い可能性がある。
- 高齢の大腸癌患者では,リンチ症候群患者が含まれる割合が相対的に低い一方,散発性MMR異常大腸癌の頻度が高い傾向がある48,53,54)。このため,スクリーニングの効率と費用対効果を考慮し,大腸癌患者全例ではなく,70歳未満など,一定の年齢以下の患者を対象としてスクリーニングを行うことも提唱されている。
- リンチ症候群の家系のなかで,Amsterdam基準Ⅱ49)を満たす家系は15~27%53,55),改訂Bethesdaガイドライン50)を満たす家系は68~89%と報告されている53)。
- 大腸癌研究会のプロジェクト研究では,Amsterdam基準Ⅱを満たす症例は全大腸癌患者の1.2%であった56)。一方で,大腸癌患者の約1/4が改訂Bethesdaガイドラインを満たすと報告されている57)。すなわち,リンチ症候群のスクリーニングにおいて,改訂Bethesdaガイドラインは感度が高い一方,比較的特異度の低い基準であるのに対し,Amsterdam基準Ⅱはより感度に劣るものの特異度の高い基準である。
- なお,ユニバーサルスクリーニングの対象として,全ての子宮内膜癌患者も,MSI検査やMMR-IHC検査を行うことが推奨されている。
Ⅲ-2-1-2 ミスマッチ修復(MMR)異常を示す大腸癌に特徴的な病理組織学的所見
- MMR異常を示す大腸癌ではその他の大腸癌と比べ,いくつかの組織学的特徴が,より高頻度に認められる。改訂Bethesdaガイドライン28においては,①腫瘍内リンパ球浸潤 (tumor infiltrating lymphocytes:TIL),②髄様増殖,③粘液癌・印環細胞癌様分化,④Crohn様リンパ球反応(Crohn’s-like lymphocytic reaction)の4項目が挙げられている(図Ⅲ-3)。ただし,これらの病理組織学的特徴は必ずしもリンチ症候群に特有のものではなく,散発性MMR異常大腸癌にも共通して認められる58)。
- リンチ症候群の大腸腫瘍の免疫組織化学検査によるMMR欠損の組織学的検査では,異型度にかかわらず79%(68/89個)で欠損を認め,MMR欠損が腺腫の形成に先行すると示唆された59)。
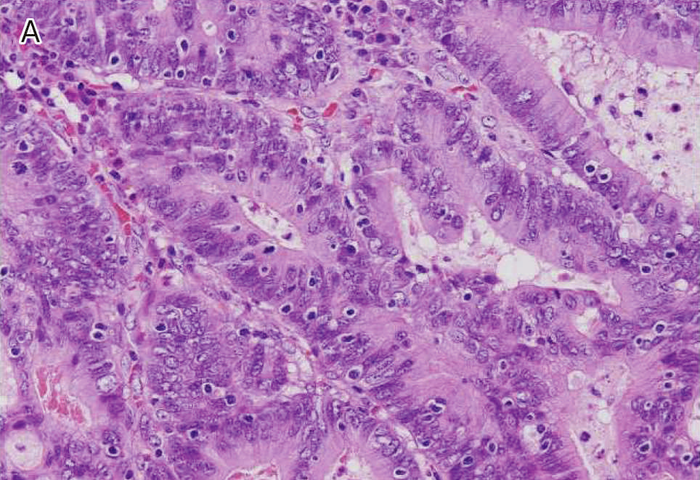
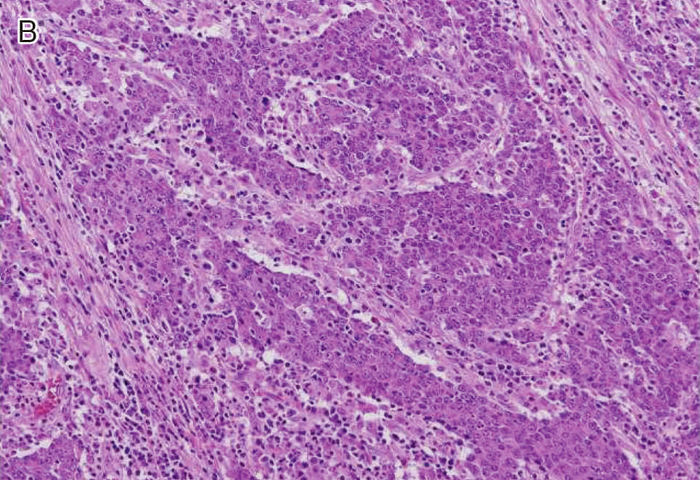
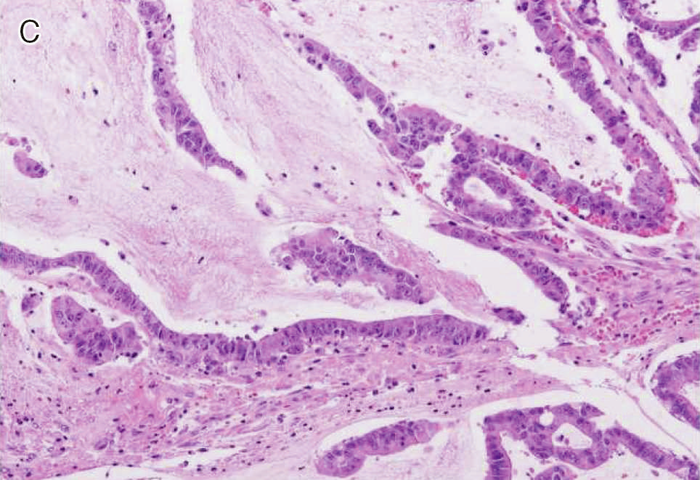
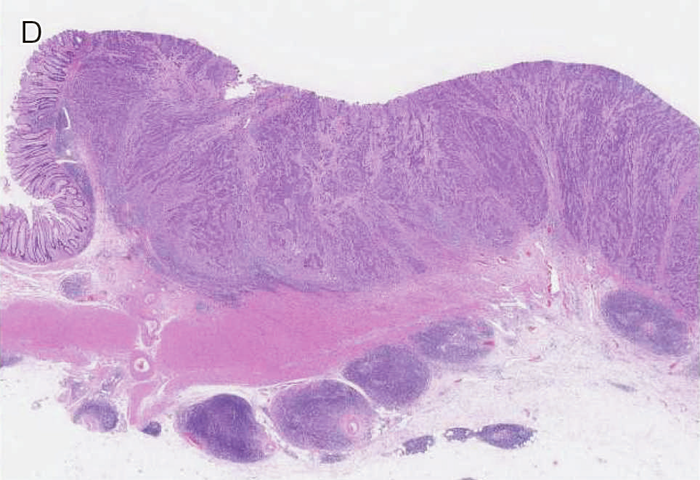
図Ⅲ-3 MSI-High大腸癌の病理組織学的特徴
| A: | 腫瘍内リンパ球浸潤。腫瘍上皮内にhaloを伴ったリンパ球浸潤を認める。 |
| B: | 髄様増殖。腫瘍細胞は腺管を形成せず,充実性胞巣状の増殖を示す。 |
| C: | 粘液癌。多量の細胞外粘液を伴う。 |
| D: | Crohn様リンパ球反応。腫瘍周囲に多数のリンパ球の集簇巣を認める。 |
Ⅲ-2-1-3 リンチ症候群のスクリーニングに用いられる検査
Ⅲ-2-1-3-1 MSI検査
- MMR異常がある腫瘍細胞では,ゲノムの中に存在する1~数塩基の繰り返し配列であるマイクロサテライトの反復回数の変化を示しやすくなる。この現象をマイクロサイト不安定性(MSI)という。
- リンチ症候群に伴う大腸癌の90%以上はMSI-Highを示す60)。一方,大腸癌全体に対するMSI-Highの割合は,欧米の報告では12~16%60-62),本邦の報告では6~7%である63,64)。そのため,MSI検査はリンチ症候群を疑う症例を絞り込むスクリーニング検査として有用である(サイドメモⅢ-3:MSI検査の方法と結果の評価)。
サイドメモⅢ-3
■MSI検査の方法と結果の評価
MSI検査は主にホルマリン固定パラフィン包埋標本を用いて行われる。現在広く用いられている方法では,抽出したDNAから,5種類の1塩基繰り返しマーカー(プロメガパネル:BAT-25,BAT-26,NR-21,NR-24,MONO-27)を用いて,腫瘍組織のマイクロサテライト不安定性を判定する(図Ⅲ-4)。マイクロサテライトの長さが変化している場合をMSIと判定し,2つ以上のマーカーがMSIを示す場合をMSI-High(high-frequency MSI),1つのマーカーがMSIを示す場合をMSI-Low(low-frequency MSI),いずれのマーカーもMSIを示さない場合をMSS(microsatellite stable)とする(図Ⅲ-4)。MSI-Highを示す腫瘍の大半はMMR異常を有するが,MSI-Low, MSSの場合はMMR異常がほぼ見られない。このため,MSI-Low, MSSは陰性として報告される。
現在,MSI検査で広く用いられている1塩基繰り返しマーカーは多型がほとんど認められないため(quasi-monomorphic mononucleotide),腫瘍組織のみで判定可能である。
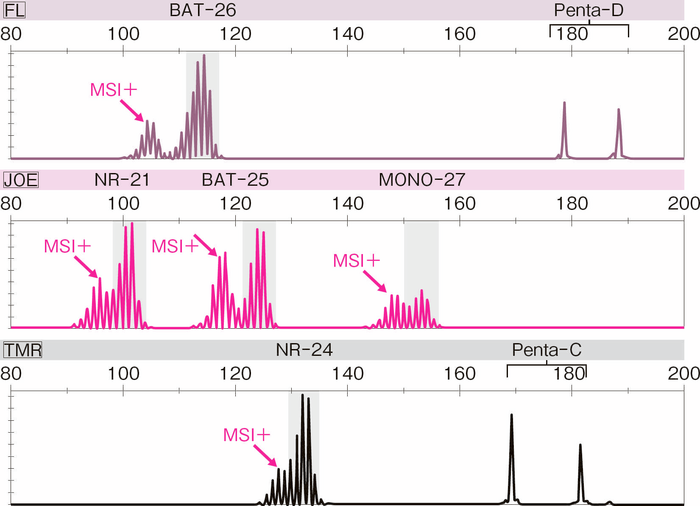
図Ⅲ-4 プロメガパネルを用いたMSIの解析例
5種類の1塩基繰り返しマーカーの全て(BAT-25,BAT-26,NR-21,NR-24,MONO-27)で,腫瘍組織のマイクロサテライト長が基準となり,MSI-Highと判定される。
Ⅲ-2-1-3-2 MMR‒IHC検査
- リンチ症候群関連腫瘍の大半で,MMR遺伝子であるMLH1,MSH2,MSH6,PMS2のいずれかの遺伝子の両アレルに不活化が起きており,その大部分の症例で対応する蛋白質の発現が消失する(サイドメモⅢ-4:発現パターンと評価,サイドメモⅢ-5:例外的なMMR-IHC検査結果)。
- MSI-HighはMMR機能の異常を原因とするため,MSI検査とMMR-IHC検査の一致率は高く近年のデータでは大腸癌組織で98.8%という一致率が報告されている65)。
- MSI検査に対するMMR-IHC検査の利点は,原因遺伝子を推定できることである。ただし,これらの検査と特異度は同等であり,施設の検査体制も加味して総合的に判断し,どちらか一方の検査を選択すればよい。なお,偽陰性はいずれの検査でも稀であるが,臨床的に偽陰性の可能性が考慮される場合は,もう一方の検査を行うことでMMR異常検出の感度を高めることが可能である。現在,悪性腫瘍におけるMMR異常検出の検査としてMSI検査およびMMR-IHC検査が保険診療で利用可能であり,適応は,(1)免疫チェックポイント阻害剤の効果予測,(2)リンチ症候群の診断の補助,(3)大腸癌の術後化学療法の選択の3つである。
サイドメモⅢ-4
■発現パターンと評価
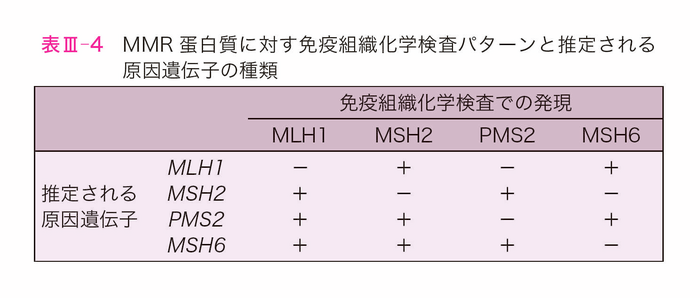
MMR異常のない腫瘍では4種類の蛋白質全てが発現している。一方,MMR異常を呈する腫瘍では異常のあるMMR遺伝子を反映した蛋白質の発現消失を呈する(表Ⅲ-4,図Ⅲ-5)。ただし,一部のMMR異常のある腫瘍において非定型的な発現パターンを示す症例が見られる(サイドメモⅢ-5:例外的なMMR-IHC検査結果)。浸潤がんの場合,原則として発現消失はびまん性であるため,生検標本を用いた検索も手術標本と同等の感度で検索が可能である。
MMR蛋白質に対する免疫染色パターンで原因遺伝子の種類が推定できる。MLH1バリアントを有する腫瘍はMLH1蛋白質に加えてPMS2蛋白質,MSH2バリアントを有する腫瘍はMSH2蛋白質に加えてMSH6蛋白質の発現消失を伴う(表Ⅲ-4)。
サイドメモⅢ-5
■例外的なMMR-IHC検査結果
ミスセンスバリアントなどによる異常蛋白質の発現
ミスセンスバリアントの場合,機能が保たれていない蛋白質が発現することがある。MLH1バリアントを伴うリンチ症候群に比較的多いことが知られており,これらの症例の大半はPMS2蛋白質の単独発現消失を呈する66)。ただし,MMR-IHCで異常が全く指摘できない例が稀に存在する。免疫染色で異常が認められなくても臨床的にリンチ症候群が強く疑われる場合は,MSI検査を追加することでスクリーニングが可能となることがある。
マイクロサテライト不安定性によるMMR遺伝子の2次的バリアント
MMR遺伝子のいくつかには繰り返し配列を持つものがあり,2次的なバリアントを起こすことがある。MLH1バリアント(MLH1/PMS2蛋白質発現消失)例では,びまん性または領域性にMSH6蛋白質の発現消失をきたすことがある67)。
術前化学放射線療法によるMSH6蛋白質の発現消失
術前化学放射線療法を行った場合,生殖細胞系列のMSH6に異常がなくてもMSH6蛋白質の発現消失を示すことが報告されている67)。
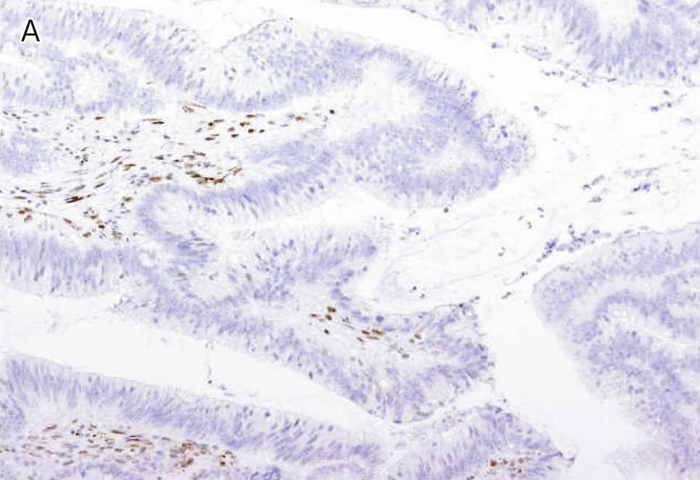
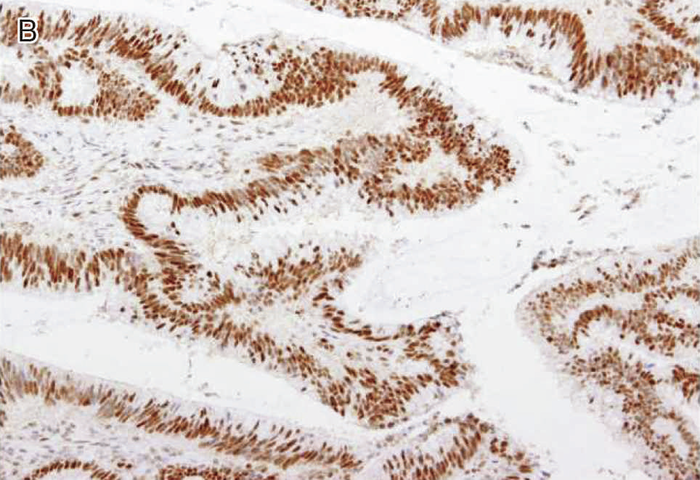
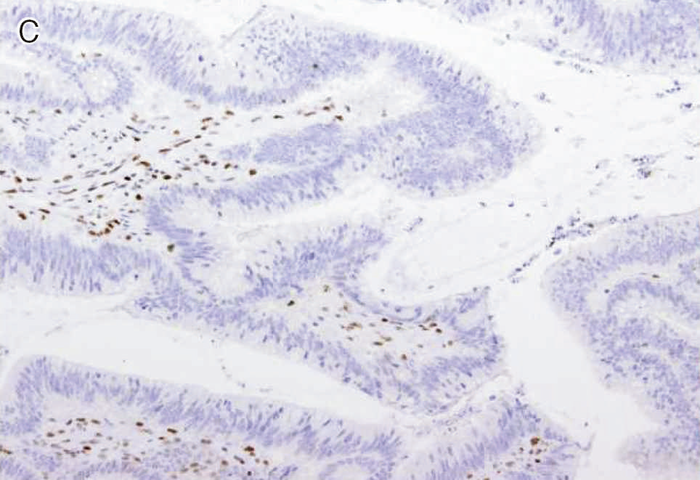
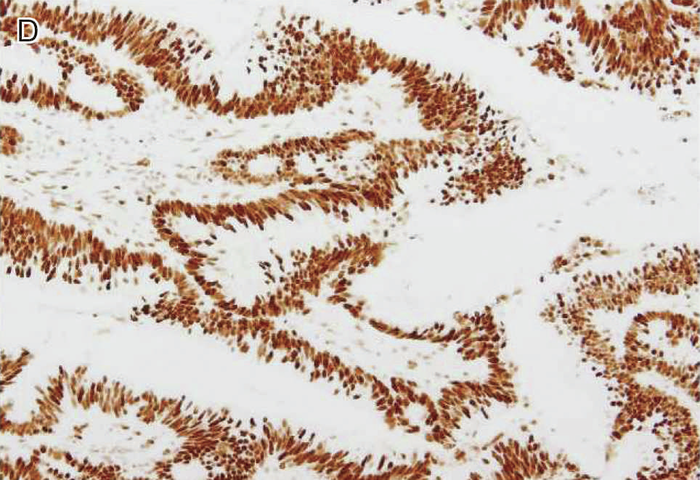
図Ⅲ-5 MLH1に生殖細胞系列病的バリアントを有するリンチ症候群に伴う大腸癌におけるMMR-IHC検査例
MLH1蛋白質(A),PMS2蛋白質(C)の発現消失を認める。MSH2蛋白質(B),MSH6蛋白質(D)の発現は保たれている。いずれの染色においても内部陰性対照となる間質細胞の陽性所見が認められる。
Ⅲ-2-1-3-3 BRAF V600Eバリアント検査
- MMR異常を示す散発性大腸癌の大半はMLH1プロモーター異常メチル化によるMLH1発現抑制を原因としており,これらの腫瘍は高頻度にBRAF V600Eバリアントを有していることが知られている。一方,MLH1の生殖細胞系列病的バリアントを原因とするリンチ症候群に伴う大腸癌ではBRAF V600Eバリアントは極めて稀である51)。したがって,MMR-IHC検査でMLH1蛋白質,PMS2蛋白質の発現消失を示す症例では,腫瘍組織のBRAF V600Eバリアントが陽性であればリンチ症候群は,ほぼ否定的と考えられる68)。
- MLH1, MSH2, MSH6の病的バリアントを原因とするリンチ症候群に伴う大腸癌ではBRAF V600Eバリアントは極めて稀であるが,PMS2に生殖細胞系列病的バリアントがあるリンチ症候群の大腸癌では9.3%にBRAF V600Eを認めたことが報告されており,注意が必要である51)。
- BRAF V600Eバリアントを用いた散発性腫瘍の同定は大腸癌のみに有効であり,子宮内膜癌など,他癌種では用いることができない。
- BRAF V600Eバリアントの検出には現在,悪性腫瘍におけるBRAF V600Eバリアント検出の検査として,RAS・RAF遺伝子変異解析として行われる変異検査および,BRAF V600Eバリアント蛋白質に対する免疫組織化学検査が保険診療で利用可能である。RAS・RAF遺伝子変異解析の適応は,(1)早期大腸癌におけるリンチ症候群の除外,(2)切除不能な進行・再発の大腸癌患者における治療方針の決定,BRAF V600Eバリアント蛋白に対する免疫組織化学検査の適応は,(1)大腸癌におけるリンチ症候群の診断の補助,(2)大腸癌における抗悪性腫瘍剤による治療法の選択の補助のそれぞれ2つである。
Ⅲ-2-1-3-4 MLH1プロモーターメチル化検査
- MMR異常を示す散発性大腸癌の大半はMLH1プロモーター異常メチル化によるMLH1蛋白質発現抑制を原因としている。したがって,MLH1プロモーター異常メチル化の有無を検索することで,散発性大腸癌を効率よく同定し,遺伝学的検査の対象から除外することが可能である40,69-73)。
- ただし,現在のところ,MLH1プロモーターメチル化検査は保険収載されておらず,国内では受託検査としても提供されていないため,通常診療での利用は困難である。
Ⅲ-2-1-4 確定診断のための検査
Ⅲ-2-1-4-1 MMR遺伝子などの遺伝学的検査
- リンチ症候群の確定診断には,MMR遺伝子不活化の原因となる生殖細胞系列病的バリアントの同定が必須である。主に患者の血液を用いて,MMR遺伝子とEPCAMの生殖細胞系列における病的バリアント(EPCAMではMSH2蛋白質発現抑制の原因となる3’側の欠失のみ)の有無を検査する。検査にはSanger法または次世代シークエンサーによるシークエンシング,multiplex ligation-dependent probe amplification(MLPA)法が主に用いられている。腫瘍組織を用いたMMR蛋白質に対するMMR-IHC検査が行われている場合は,その結果に基づいて検査対象とする遺伝子を絞り込むことも可能である。リンチ症候群の遺伝学的検査は本邦では保険収載されておらず,全額自己負担もしくは研究として実施しているのが現状である(遺伝学的検査は検査会社に依頼可能)。現在,保険収載に向けて議論が重ねられている。本検査の前後には必ず遺伝カウンセリングを行う。(Ⅰ-3:遺伝カウンセリング)
- それぞれの検査法ごとに検出困難なバリアントが存在するため,MMR遺伝子に対する遺伝学的検査の結果,病的バリアントが検出されなかった場合でも,リンチ症候群を完全に否定することは困難である。例として,Sanger法による検索では構造異常の検出は困難である。次世代シークエンサーによる検索でも検査方法により検出困難なバリアントがある。したがってCGP検査でも生殖細胞系列病的バリアントが同定されない場合もあるので注意する必要がある。
Ⅲ-2-1-4-2 リンチ症候群診断に関わる検査における患者同意
- 欧米では一般にリンチ症候群のスクリーニング検査としてのMSI検査,MMR-IHC検査の施行には患者の個別同意は必要ないと考えられている。一方,国内ではこれらの検査をリンチ症候群の診断の補助を目的として用いる場合,事前にリンチ症候群に関する十分な説明を行い,同意を得ることが望ましいとされてきた。しかし,これらの検査を免疫チェックポイント阻害剤使用や術後化学療法の選択を目的として行う場合でも,その結果はリンチ症候群診断のきっかけとなりうる。すなわち,実際の診療においてはMSI検査やMMR-IHC検査は直接の目的にかかわらず,リンチ症候群のスクリーニングを兼ねている。また,リンチ症候群に伴う腫瘍が悪性腫瘍全体に占める割合は高くなく,悪性腫瘍罹患者におけるリンチ症候群の割合は1%程度と報告されている。したがって,臨床所見などからリンチ症候群が積極的に疑われない場合,MSI検査やMMR-IHC検査を行うにあたり,リンチ症候群に関する詳細な理解を求められることは患者にとって過剰な負担とも考えられる。さらに,リンチ症候群の確定診断を目的とした遺伝学的検査を行う場合は,それまでのリンチ症候群に関する説明や関連する検査に対する同意の有無に関わらず,改めて遺伝カウンセリングの機会が提供される。したがって,実際の診療においては直接の目的に関わらず,MSI検査,MMR-IHC検査の施行には,一般的な検査と同様に通常の医療行為として検査の必要性を説明し,診療録へその説明内容を記載するのみにとどめ,遺伝学的検査前に求められる患者の個別同意までは必要ない。MSI検査,MMR-IHC検査によるスクリーニング検査でリンチ症候群が疑われる場合は遺伝診療が可能な施設へ患者を紹介する。日本遺伝性腫瘍学会ホームページのリンク先(https://jsht-info.jp/wp/wp-content/uploads/2023/09/28e3da4a24e0e3a04aab229839adf7c2.pdf)に参考資料が公開されている。
Ⅲ-2-2 鑑別を要する疾患・病態
Ⅲ-2-2-1 MLH1プロモーター異常メチル化を伴う散発性MSI‒High大腸癌
- MSI-Highを示す散発性大腸癌は,高齢女性,低分化腺癌,右側結腸優位,などの臨床病理学的特徴を認める。散発性大腸癌がMSI-Highを示す主な原因はMLH1プロモーター領域の後天的な異常メチル化である74)。このような腫瘍ではMMR-IHCでMLH1蛋白質およびPMS2蛋白質の発現消失を認める。上述のように,MLH1プロモーター異常メチル化を示す大腸癌の1/2から2/3はBRAF V600Eバリアントを有する48,75)。
Ⅲ-2-2-2 ポリメラーゼ校正関連ポリポーシス(polymerase proofreading‒associated polyposis:PPAP)
- PPAP76-78)は,FAP(AFAP)やリンチ症候群に類似した病態を示すことがあり,鑑別を要する(Ⅱ-2-2:鑑別を要する疾患)。子宮内膜癌を発症することも多く,PPAPがリンチ症候群の鑑別疾患に挙がる。POLEを原因遺伝子とするPPAPの大腸癌ではMSI-Highを示すことがある。
Ⅲ-2-2-3 Lynch‒like syndrome
- MMR異常(MSI-HighまたはMMR蛋白質の発現消失)を示す大腸癌の中でMLH1プロモーター異常メチル化を認めず,かつ遺伝学的検査でリンチ症候群と診断されない症例は,Lynch-like syndromeと呼ばれている。その主な原因はMMR遺伝子の両アレルに生じた体細胞バリアントであるが,これ以外に同定困難な生殖細胞系列のMMR遺伝子バリアントや,MMR遺伝子以外の生殖細胞系列バリアントに起因する症例が含まれていると考えられる79,80)。
Ⅲ-2-2-4 先天性ミスマッチ修復欠損(Constitutional mismatch repair deficiency: CMMRD)症候群
- CMMRD症候群は,MMR遺伝子にホモ接合性あるいは両アレルでの生殖細胞系列病的バリアントに起因する,小児期より同時性・異時性に大腸がんを含む複数の関連腫瘍が好発する疾患である81)。常染色体潜性遺伝(劣性遺伝)形式をとる。原因遺伝子はPMS2,MSH6が多い。非腫瘍性病変として,高頻度に神経線維腫症1型(neurofibromatosis type 1:NF1)類似のカフェ・オ・レ斑(Café au lait spots)を認める81,82)。PMS2の病的バリアント例では免疫グロブリンのクラススイッチ異常によるIgGとIgAの低下,IgMの増加による異常な抗体反応を特徴とする免疫不全症を合併し,小児慢性特定疾病に指定されている83)。海外の前向きレジストリによると,初発のがん診断年齢の中央値は9.2歳(1.7~39.5歳),関連腫瘍のスペクトラムは広く,脳腫瘍が最も多く,大腸癌,血液腫瘍がそれに次ぐ84)。大腸には多発性腺腫を認め,臨床的所見はFAPと類似する。MRI(脳,全身),腹部超音波,消化管内視鏡検査,血液検査を組み合わせたサーベイランスプロトコールが提案され85),フルサーベイランスコホートでは生命予後の改善が示唆される84)。かつてはTurcot症候群type 1と呼ばれていたのは,現在ではCMMRD症候群であることがわかっている。
Ⅲ-2-2-5 家族性大腸癌タイプ X(Familial colorectal cancer type X:FCCTX)
- Amsterdam基準 Ⅰ86)注3を満たすが,ミスマッチ修復遺伝子の生殖細胞系列バリアントを認めず,大腸癌のミスマッチ修復機構が保たれている場合,家族性大腸癌タイプX87)の名称が提唱されている。家族性大腸癌タイプXは,(1)偶然の散発性大腸癌の集積,(2)生活習慣を要因とする集積,(3)未知のものを含むリンチ症候群以外の遺伝性腫瘍,などの複数の疾患群からなると推測され,追従する研究でも大腸癌以外のリンチ症候群関連腫瘍のリスクは有意に低いことが確認されている88)。
注3:Amsterdam基準 Ⅰ
Amsterdam基準Ⅱは大腸癌,子宮内膜癌,腎盂・尿管癌,小腸癌を関連腫瘍とするが,Amsterdam基準Ⅰ86)では大腸癌のみを関連腫瘍とする。
Ⅲ-3 サーベイランスと治療
Ⅲ-3-1 大腸腺腫・癌
Ⅲ-3-1-1 特徴・分類
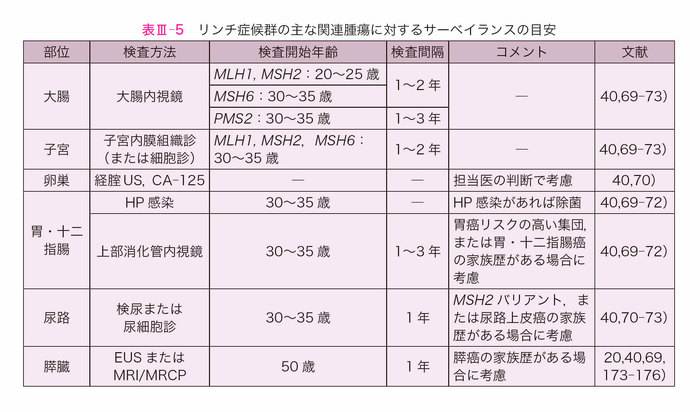
- 大腸腺腫の特徴は,通常の腺腫より小さくても異型度が高く89),癌化までの期間が短いなどが挙げられていた90-93)。リンチ症候群における発がんメカニズムについては,後天的な腺腫-癌過程に加えて,腺腫発生時からのMMR欠損の関与やMMR欠損クリプトからの癌過程の経路も想定されているが59,94),大腸内視鏡検査時に区別することは困難であるため,腫瘍性病変の発見時には大きさに関わらず積極的な内視鏡的治療の対象とする89)。また,本疾患を特徴づける大腸外関連腫瘍の合併に注意した問診が必要である40,91)(表Ⅲ-5)。
- 大腸外関連腫瘍における全身的なサーベイランスについて,一般集団と異なる認識が必要であり,大腸内視鏡サーベイランスと共に各臓器に推奨される定期検査を行う。
Ⅲ-3-1-2 サーベイランスと発がん予防
Ⅲ-3-1-2-1 大腸内視鏡検査
- 大腸癌未発症のリンチ症候群の大腸内視鏡サーベイランスの開始年齢は,MLH1とMSH2では20~25歳,MSH6とPSM2では30~35歳とする見解が多い21,40,95,96)。また,リンチ症候群の大腸癌の術後には,異時性多発癌の発生に留意し,生涯にわたるサーベイランスの継続が必要である。大腸内視鏡の検査間隔については,前向き研究で,3年間隔の内視鏡サーベイランスにより大腸癌による死亡が65%抑制されることが報告されたが97),いくつかの観察研究で3年ごとの内視鏡検査の間に進行癌の発生が確認されたことから,検査間隔を1年に短縮することも提唱されてきた69,87,98)。しかし,欧州3カ国(ドイツ,オランダ,フィンランド)において1年~3年までの検査間隔で比較したところ,大腸癌の発生率やその病期に有意差を認めなかったとする報告もあり,至適間隔におけるコンセンサスは得られておらず99,100),原因遺伝子に加えて,大腸癌既往歴によるリスク層別化が試みられている(CQ7)。本邦では原則1~2年を推奨しており69,70,72,73),欧米のガイドラインでは2年間隔とするものが多い40,96)。高解像度の内視鏡を用いた質の高い大腸内視鏡検査もサーベイランスと併せて重要であり,大腸内視鏡検査の質を評価するQuality Indicators(腸管洗浄度,盲腸到達率,腺腫発見率,観察時間など)の評価も重要である95,101)。
Ⅲ-3-1-2-2 生活習慣の改善
- リンチ症候群の場合,大腸癌のリスクを低下させるには,適正体重の維持,禁煙の他に,食生活,飲酒,運動に関わるリスク因子がいくつか示されている。Body mass index(BMI)高値は,腺腫や大腸癌の発症リスクを増大させることが示され,平均体重の範囲内で留めることが推奨されている70)。後方視的観察研究で特に,BMI>25kg/m2の男性では大腸癌のリスクが増加することが示されている102)。さらに,ランダム化比較試験で肥満はMLH1バリアントを有する場合,大腸癌リスクが3.72倍となるが,アスピリン(600mg/1日)を服用している場合やMSH2またはMSH6バリアントを有する場合にはリスク増加はみられないことが報告されている(CQ8)103,104)。症例対照研究や後方視的観察研究で喫煙は大腸癌リスクを増加させるため70,105,106),禁煙が推奨されている。特に過去ではなく現在喫煙している方が大腸腺腫のリスクを高くすることが示されている107)。その他,後方視的観察研究でマルチビタミンとカルシウムのサプリメントの摂取が大腸癌のリスクを低下させること108),症例対照研究や前方視的観察研究で果物の摂取量を増やすと大腸癌リスクが減少すること109,110),アルコール摂取による大腸癌リスクの増加や若年発症化がみられること110-112),後方視的観察研究で身体活動が増えると大腸癌リスクの減少が示唆されること113),などが報告されている。
Ⅲ-3-1-2-3 化学予防
- リンチ症候群患者に対するアスピリンを用いた化学予防試験が行われているが,その有用性は明らかではない(CQ8)。
Ⅲ-3-1-3 治療
Ⅲ-3-1-3-1 手術
- リンチ症候群の大腸癌に対する大腸の切除範囲(術式)として,以下の選択肢がある。
- 散発性大腸癌と同等の切除範囲
- 拡大手術(結腸全摘術,大腸全摘術)
- リンチ症候群の大腸癌に対する切除範囲は散発性大腸癌と同等の切除範囲で行われている。リンチ症候群に対する術式を検討する上で,初発癌の部位や原因遺伝子,大腸腫瘍の発症頻度とその時期などのリスク因子別の認識は重要であり,現時点での多発大腸癌のリスク層別化は不十分であるため体系的に強く推奨されるものはない。本邦での初発癌および異時多発癌に対する術式においては,患者の年齢や併存疾患の状態などのバランスを考慮し,術後のQOLおよびサーベイランスの必要性とその限界を十分説明した上で,患者の希望を確認しながら個別対応されている(サイドメモⅢ-6:リンチ症候群の大腸癌に対する拡大手術)96,114)。
- 欧米海外ではMLH1・MSH2バリアント保持者の大腸癌に対し,結腸癌に対する結腸全摘術,直腸癌に対する大腸全摘術などの拡大手術が推奨されている。一方,MSH6・PSM2変異例の大腸癌においては,腫瘍学的有益性を示すエビデンスは不十分との理由で拡大手術は勧められていない95,96)。
- 予防的大腸切除については,リンチ症候群の大腸癌の生涯発生リスクは男性で54~74%,女性で30~52%であり,生涯を通じて大腸癌を発生しないバリアント保持者が少なからず存在することから,未発症者に対する有用性についてコンセンサスはなく,予防的大腸切除を勧めることはできない。
サイドメモⅢ-6
■リンチ症候群の大腸癌に対する拡大手術
リンチ症候群のMLH1・MSH2の初発大腸癌は84%が近位結腸で,結腸癌術後の異時性大腸癌の発症リスクは40歳~70歳までで36%と報告される115)。海外からの報告では,拡大手術と散発性大腸癌の術式である大腸部分切除と比較した後方視的観察研究のメタアナリシスにおいて大腸部分切除で22.4~22.8%,拡大手術で4.7~6.8%に異時性大腸癌が発生し,大腸部分切除は異時性大腸癌発生の危険性を有意に増加させると報告されている116,117)。一方で,死亡率に関しては両手術間に差を認めない〔大腸部分切除の相対リスク1.65(95%信頼区間 0.90-3.02)〕117)。また,リンチ症候群の初発大腸癌の15%程度が直腸癌であるが,直腸切除(切断)術を施行された症例における異時性大腸癌の多くが右側結腸癌で,平均14カ月間隔で内視鏡サーベイランスを行った場合の異時性多発大腸癌の累積発生率は,10年:19%,20年:47%,30年:69%とする後方視的観察研究がある118)。本邦からの初発大腸癌の術式に関連する報告は少ないが,大腸内視鏡検査の精度管理指標(Quality indicator:QI)と至適サーベイランスを遵守し,腺腫を含む前がん病変の内視鏡的摘除を行えば,散発性大腸癌と同等の切除範囲でも良好な予後が報告されている119,120)。
Ⅲ-3-1-3-2 術後補助療法
- リンチ症候群の大腸癌のみを対象とした術後補助化学療法のエビデンスはほとんどないため,散発性MSI-High大腸癌に準じて考えられる場合が多い。ただし,リンチ症候群の大腸癌と散発性MSI-High大腸癌にはBRAF V600Eバリアントの頻度やメチル化の状態など,既知の相違点があることを認識しておく必要がある。実際,5-FUベースの術後補助化学療法が,散発性MSI-High大腸癌には有用性がないが,リンチ症候群が疑われる50歳未満のMSI-High大腸癌においては有用性があるとする報告もあり121),散発性MSI-High大腸癌とリンチ症候群の大腸癌を別に考える必要性も示唆されている。なお,リンチ症候群および散発性MSI-High直腸癌に対する術後補助化学療法に関する有用なデータはほとんどない。
- Stage Ⅱ/Ⅲの散発性大腸癌を対象に,MSIの状態と5-FUベースの術後補助化学療法の有効性について行われたメタアナリシスでは,MSI-High大腸癌はMSS大腸癌より予後は良いが,術後補助化学療法により生存期間および無再発生存期間の改善が認められなかった122,123)。しかし,第Ⅲ相試験であるNSABP-C07試験,MOSAIC試験において,術後補助化学療法におけるオキサリプラチンの上乗せ効果はMSI-High,MSS結腸癌のいずれにも認められた124)。また,12の臨床試験に基づくACCENTデータベースの解析では,Stage Ⅲの結腸癌に対し,MSIの状態に関わらず,フッ化ピリミジン単独群よりもオキサリプラチン併用群の方がPFSもOSも良好であることが示された。MSS/pMMRの結腸癌に比べ,MSI-High/dMMRの結腸癌ではN1では予後良好であるが,N2では予後は同等であった125)。現状ではStage Ⅲ結腸癌においてMSIの状態により術後補助化学療法の適応を判断することは推奨されない。Stage Ⅱ大腸癌における術後補助療法の有用性は確立されておらず,特にMSI-Highの場合は予後良好であるため,その有用性は低いと考えられている。
Ⅲ-3-1-3-3 切除不能進行・再発癌に対する薬物療法
- Stage Ⅳの散発性大腸癌においてはStage Ⅱ/Ⅲに比べてMSI-Highを示す頻度が低いことが示されている126,127)。MSI-Highの進行・再発大腸癌に特異的な化学療法に関して十分な検討が行われているが,リンチ症候群に限定した検討は十分行われていない。MSI-High/dMMR注4大腸癌,MSI-High/dMMRの大腸癌以外の固形癌,MSS大腸癌を対象とし三次治療以降におけるペムブロリズマブの有効性を解析した第Ⅱ相試験(KEYNOTE-016)では,奏効割合はそれぞれ40%,71%,0%でありMSI-High/dMMR固形癌に対する抗PD-1抗体の有効性が示された128)。12種類の癌腫に対象を広げた全86例のMSI-High/dMMR固形癌に関する続報において奏効割合53%(大腸癌52%,大腸癌以外54%)と良好な結果であった。また,そのうちリンチ症候群に関連する癌での奏効割合は46%,関連しない癌では59%であり,同等の結果であった129,130)。
- 三次治療以降のMSI-High/dMMR大腸癌,既治療の非大腸癌を対象とした第Ⅱ相試験(KEYNOTE-164,-158)でも有効性が示され,MSI-High/dMMR固形癌に対する二次治療以降でのペムブロリズマブが臓器横断的に保険適用となった130,131)。
- MSI-High/dMMR大腸癌を対象とし二次治療以降におけるニボルマブ単剤あるいはニボルマブ+イピリムマブ併用の有効性を検討した第Ⅱ相試験(CheckMate-142)においては,ニボルマブ単剤の奏効割合は31%であり,ニボルマブ+イピリムマブ併用の奏効割合は55%であった。Grade3/4の治療関連有害事象はそれぞれ20%および32%であった132,133)。このうち臨床データからリンチ症候群に関連する癌はそれぞれ36%,29%含まれており,奏効割合は33%,71%と全体の結果と同等であった。
- MSI-High/dMMR大腸癌を対象とし一次治療におけるペムブロリズマブ療法と化学療法の有効性・安全性を比較した第Ⅲ相試験(KEYNOTE-177)においては,PFSは有意差をもってペムブロリズマブ群で延長した134)。また,リンチ症候群の大腸癌は約90%がMSI-High/dMMRを呈することが知られている。したがって,リンチ症候群では進行・再発大腸癌に対し免疫チェックポイント阻害剤の治療を行うことを強く推奨する。なお,薬物療法においては,大腸癌治療ガイドラインを参照すること。
注4:dMMR
免疫組織化学検査でMMR蛋白質の発現消失を含むMMR機能欠損
Ⅲ-3-2 婦人科腫瘍
Ⅲ-3-2-1 特徴・分類
- リンチ症候群に関連する婦人科癌としては子宮内膜癌と卵巣癌が挙げられる。リンチ症候群の女性に発症する癌として,子宮内膜癌は大腸癌に次いで好発し,浸透率は最大約60%とされている40,135-137)。また大腸癌に先行して発症する症例が少なくなく,リンチ症候群の女性において子宮内膜癌はセンチネル癌と位置付けられている。大腸癌と同様に,全ての子宮内膜癌を対象にMSI検査やMMR-IHC検査を行うユニバーサルスクリーニングがリンチ症候群の診断に関し,感度と費用対効果の高い方法として推奨されている。
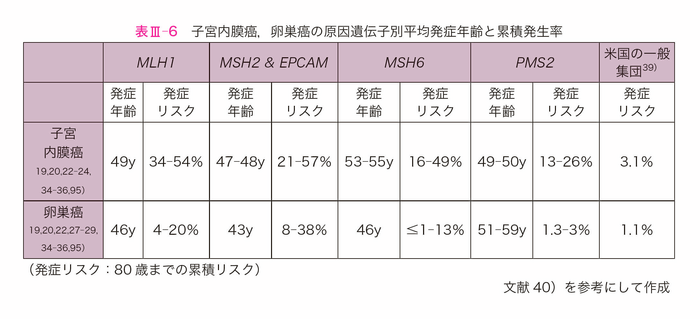
- 表Ⅲ-6にリンチ症候群の女性における子宮内膜癌および卵巣癌の発症年齢および累積罹患リスクを示す。MMR遺伝子の種類により異なることに留意が必要である40,70,138)。
- MSH6に病的バリアントを有する場合,子宮内膜癌の発症年齢はMLH1,MSH2と比べて高齢であるが,発症リスクはMLH1,MSH2の同等またはそれ以上であるとされている21,70,115)。PMS2に病的バリアントを持つ場合,卵巣癌リスクが上昇するかのエビデンスは乏しい。
- 本邦ではリンチ症候群の子宮内膜癌は予後良好な類内膜癌の臨床進行期Ⅰ期が多いとの報告や,罹患年齢が若く,非肥満で,高血圧や脂質異常症の合併率が低いなどの特徴があるとの報告がある139,140)。その一方で漿液性癌や明細胞癌,癌肉腫など,いわゆるType Ⅱ子宮内膜癌が散見されるとの海外からの報告もある。さらに,子宮体部下部領域に限局して発症する子宮峡部(lower uterine segment:LUS)癌の頻度が高いとされている141,142)。予後に関しては,リンチ症候群の子宮内膜癌は,MSI-Highの特徴を持ち,散発癌と比較し予後良好な傾向にあること,免疫チェックポイント阻害剤が有効であることが示されている128,143)。なお,リンチ症候群の卵巣癌に関しては,類内膜癌や明細胞癌などの非漿液性癌で進行期Ⅰ期が多いとされ,進行した高異型度漿液性癌が多い遺伝性乳癌卵巣癌(Hereditary breast and ovarian cancer:HBOC)とは対照的である。また散発癌と比べて予後良好であること,子宮内膜癌との重複症例が多いことが,特徴的である144,145)。
Ⅲ-3-2-2 サーベイランス
- 子宮内膜癌に対するサーベイランス法としては,子宮内膜組織診が感度と特異度が高く,主たるサーベイランス法となりうる40,138)。子宮内膜細胞診は正診率が高くないことから,一般的に内膜組織診に代わるものではないが,生検と比較して検査時の侵襲が少ないため,担当医の裁量で考慮してもよい。経腟超音波検査の感度は34%程度と報告されており,内膜組織診の57%と比べ高くない138)。特に閉経前女性では月経周期に応じて子宮内膜厚が大きく変動するため,経腟超音波検査によるサーベイランスは推奨されない40,70)。また,子宮内膜癌は比較的予後良好な癌腫であり,自覚症状を呈してから診断された場合と比較しサーベイランスががん死低減効果を示すというエビデンスに乏しい。検査開始年齢および検査間隔についてのエビデンスは乏しいが,30~35歳頃からの,あるいは家系内で最年少のがん発症年齢より5歳若い年齢からの1~2年ごとの検査を考慮する。なお,原因遺伝子ごとに発症年齢や累積罹患率が異なることから,海外ではMLH1やMSH2に関しては35歳,MSH6では40歳からのサーベイランスの開始を検討するとの報告もある70,146)。またサーベイランスに加えて,子宮内膜癌の主な自覚症状である不正性器出血を認めた場合には,婦人科受診を薦めるなどの啓発も重要である。
- 一般に卵巣癌には有効なサーベイランス法や間隔は提唱されてないが,経腟超音波断層法と血清CA-125は担当医の判断で考慮してもよい40,70)。しかし,前回の診察では陰性と判定されたにもかかわらず,次に予定された診察の前に自覚症状が出現してがんが発見される,いわゆるinterval cancerに留意が必要である70)。また卵巣癌は初期の自覚症状には乏しいが,下腹痛,腹部膨満感,腹囲増加,摂食困難,頻尿,尿意切迫などの症状を認めた場合には,腫瘍の増大に伴う症状の可能性があるため,婦人科受診を薦めるなどの啓発が重要である。近年,リンチ症候群を対象とした前向き研究で,婦人科癌に対するサーベイランスを行った場合の10年生存率が子宮内膜癌で98%,卵巣癌で89%と報告された115)。この結果が,サーベイランスの効果によるものか,リンチ症候群に発生する婦人科癌の悪性度が低いことによるものか,などについては現在のところ不明である。
Ⅲ-3-2-3 治療
Ⅲ-3-2-3-1 手術療法
- リンチ症候群女性における子宮内膜癌と卵巣癌の術式選択に対しては,散発性と同様に対応する。
- なお,リンチ症候群女性に対する子宮全摘出術は,死亡率の低減効果は示されていないものの,子宮内膜癌の発生を防ぐことが示されているため,リスク低減手術として考慮すべき選択肢となる(CQ9)40,69,147)。
- 卵巣癌に対しては有効なサーベイランス法は提唱されていないためリスク低減卵管卵巣摘出術(risk-reducing salpingo-oophorectomy:RRSO)が卵巣癌の一次予防として考慮すべき選択肢となるが70),卵巣癌による死亡率の低減効果は示されていない40,69,146,147)。リスク低減手術の施行時期については,出産希望の有無,合併症,家族歴,原因となるMMR遺伝子の種類に基づき個別に検討することが望ましいが,40歳以前の子宮全摘出術+RRSOによるベネフィットは乏しい148)。ただし大腸癌の手術を予定しているリンチ症候群女性に対しては,大腸癌の手術時に子宮全摘術とRRSOの同時施行が考慮される70)。
- RRSO施行時期に応じて,卵巣欠落症状としての更年期症状,sexual activityの変化,脂質プロファイルや骨代謝への影響が危惧される。そのためRRSOを実施するには,女性医学専門家の関与も必要になる。また乳癌既往のない女性のRRSO施行後のヘルスプロモーションにホルモン補充療法が有用な場合がある40,148-150)。
- またリスク低減手術時の永久病理標本にて癌が検出される(オカルト癌)リスクが,子宮内膜癌では5~17%程度,卵巣癌では0.5%程度あるとされる。したがって,手術に先立って十分な評価を行うことが望ましい138,147,151,152)。
Ⅲ-3-2-3-2 化学予防
- リスク低減手術以外のリスク低減法としては化学予防が考慮される。大腸癌においてはアスピリンによる化学予防の有用性が報告されている(CQ8)。子宮内膜癌や卵巣癌などの婦人科癌に関しては経口避妊薬の有用性が報告されているが,本邦でのエビデンスが待たれるところである40,153)。
Ⅲ-3-2-4 術後サーベイランス
- 子宮内膜癌および卵巣癌のリスク低減手術後の婦人科サーベイランスに関して,具体的な方法や期間は示されていない。RRSO後に原発性腹膜癌を発症したリンチ症候群の報告例があるものの154),リンチ症候群におけるRRSO後の原発性腹膜癌の発症頻度に関しては定かではなく,長期的なフォローアップが望ましいと考えられる。
Ⅲ-3-3 泌尿器科腫瘍
Ⅲ-3-3-1 特徴・分類
- 腎盂や尿管などの上部尿路に発生する尿路上皮癌(Upper tract urothelial carcinoma:UTUC)は,泌尿器癌の中で比較的稀な癌であるが,リンチ症候群はその5%にUTUCを発生し,リンチ症候群関連腫瘍の中では大腸癌(63%),子宮内膜癌(9%)に次いで累積発生率が高い155-157)。近年,膀胱癌も関連腫瘍として扱われるようになっており,前立腺癌,精巣腫瘍,副腎皮質癌も,リンチ症候群との関連が示唆されている7,30,158-162)。
- 散発例を含めたUTUC全体をスクリーニングしたところ,5%でMMR遺伝子群(MMRs)の生殖細胞系列病的バリアントが見つかったとの報告がある157,163,164)。そのため大腸癌や子宮内膜癌からだけでなくUTUCからもリンチ症候群のMMR-ICH検査によるスクリーニングが積極的に行われつつある。また,リンチ症候群関連UTUCの64%に大腸癌を含むリンチ症候群関連腫瘍の既往を認めており,UTUCの診療ではリンチ症候群の可能性を念頭に置き詳細な病歴聴取を行う163)。一般的なUTUCの平均罹患年齢は70歳であるが,リンチ症候群関連UTUCでは64歳と比較的若年で,MSH2で累積発生率が高い。
Ⅲ-3-3-2 サーベイランス
- リンチ症候群では,尿路のサーベイランスとして,30~35歳から毎年,尿検査や尿細胞診を行う。生殖細胞系列にMSH2病的バリアントを有する患者ではこれに加えて超音波検査を行うことを提唱する報告もある165)。以上の検査で異常を認めた場合は,CT,逆行性腎盂尿管造影,尿管鏡下腫瘍生検などで精査する。この中で,逆行性腎盂尿管造影や尿管鏡下腫瘍生検は,診断性能は高いが尿管内にカテーテルあるいは尿管鏡を挿入する侵襲的検査であるため,定期的なサーベイランスには適していない。
Ⅲ-3-3-3 治療
- リンチ症候群におけるUTUCの治療は,散発性UTUCの治療に準じる。つまり画像所見や病期などを基に,根治を目的とした腎尿管全摘術,尿管部分切除術,尿管鏡下レーザー焼却術などの外科的治療あるいは,転移症例に対する化学療法や免疫チェックポイント阻害剤などの薬物療法を行う166)。
Ⅲ-3-4 上部消化管腫瘍
Ⅲ-3-4-1 特徴・分類
- リンチ症候群の胃癌の累積発生リスクは,本邦を含む東アジアで高い8,28,32,37,167)。その理由は,ヘリコバクター・ピロリ(Helicobacter pylori:HP)感染胃炎の地域性による発症割合の相違があり,HP感染歴が一般症例の胃癌発症と同様にリスク因子の一旦を担っていると考えられている37,167)。HP感染以外の関連因子として,MLH1・MSH2の病的バリアント保持者で発症リスクが高いと報告されている(CQ10)168)。
Ⅲ-3-4-2 サーベイランス
- リンチ症候群の胃癌の対応について,散発例のHP既感染者同様に東アジアのように胃癌の多い地域や,胃癌の家族歴を有するリンチ症候群の患者と血縁者には,上部消化管内視鏡検査によるサーベイランスを1~3年ごとに行うことが提唱されている169)。胃癌発症年齢は40歳台であるが最小年齢は31~35歳との報告をうけ,サーベイランスの開始時期については,30~35歳とする報告が多い8,37,167)。
- リンチ症候群の小腸癌のサーベイランスについては,頻度が少ないためガイドラインで推奨はされていない。小腸内視鏡検査およびビデオカプセル内視鏡検査,造影CTについては,結論として現段階で有益性を示すエビデンスはなく,好発部位よりむしろ上部消化管内視鏡時の深部十二指腸観察が提案されている170)。
Ⅲ-3-4-3 治療
Ⅲ-3-4-3-1 内視鏡・手術治療
- リンチ症候群の早期胃癌に対する内視鏡治療の適応については,一般症例と同等に胃癌治療ガイドラインに従う171)。また,進行胃癌に対する術式についても,散発性の方針に準ずる。
Ⅲ-3-4-3-2 薬物治療
- 進行胃癌に対する薬物療法においては,一次治療でフッ化ピリミジン+白金製剤による化学療法群を対照とし,ニボルマブ+化学療法併用群,ニボルマブ+イピリムマブ群の有効性・安全性を比較する第三相比較試験(CheckMate-649)により,ニボルマブ+化学療法併用群(n=789)で化学療法群(n=792)よりも有意にOSの延長(ハザード比 0.79)が示された172)。しかし,ニボルマブ+イピリムマブ群では化学療法群に対する有意なOSの延長は示されなかった。その試験のMSI-Highを示したサブグループ解析において,ニボルマブ+化学療法併用群(n=22)では化学療法群(n=21)に対してより顕著なOSの延長(ハザード比 0.38)が示され,ニボルマブ+イピリムマブ群(n=11)でも化学療法群(n=21)に対してOSの延長(ハザード比 0.28)が示された。したがって,進行胃癌においては,標準的な一次治療としてニボルマブ+化学療法が実施されているが,リンチ症候群の進行胃癌はニボルマブの上乗せ効果がより期待できる対象であると考えられる。
Ⅲ-3-5 その他の関連腫瘍
- リンチ症候群の膵癌のサーベイランスについて,検査開始年齢および検査間隔についてのエビデンスは乏しいが,欧米のガイドラインでは膵癌の家族歴がある病的バリアント保持者には,50歳,あるいは家系内で最年少のがん発症年齢より10歳若い年齢からの,EUSあるいはMRI/MRCPを交互にまたはいずれかによるサーベイランスを考慮するとことが提案されている20,40,69,173-176)。
- なお,リンチ症候群の胆道癌,脳腫瘍などに関するサーベイランスについては,エビデンスが乏しく確立されていない170)。
Ⅲ-4 リンチ症候群であることが未確定の大腸癌患者への対応
Ⅲ-4-1 検査未施行・VUS例
- リンチ症候群が疑われても,リンチ症候群であることが未確定の場合は,臨床情報,MSI検査やMMR蛋白質のIHC検査の結果などからリンチ症候群の可能性を個別に評価し,関連腫瘍のサーベイランスを行う(図Ⅲ-1)。「未確定」とは,遺伝学的検査を実施していない,あるいは,遺伝学的検査で病的バリアントが確認されない(VUSのみ検出を含む)ことを示す。
- 「Amsterdam基準Ⅱを満たす」,または「リンチ症候群を強く疑う既往歴・家族歴がある」場合で,MSI検査の結果がMSI-High,またはIHC検査の結果がMMR蛋白質消失であれば,リンチ症候群に準じてサーベイランスを行う。
- 「Amsterdam基準Ⅱを満たす」,または「リンチ症候群を強く疑う既往歴・家族歴がある」場合で,MSS/MSI-LまたはMMR蛋白質消失なし(MMR遺伝子異常を強く疑わせる所見がない)の場合でも,リンチ症候群が否定されたわけではない。このような場合,その後も既往歴,家族歴に注意を払いながら経過観察を行い,大腸癌に対しては少なくとも3~5年ごとに大腸内視鏡検査を行う。
- 「改訂Bethesdaガイドラインを満たす」が,「Amsterdam基準Ⅱを満たさない」または「リンチ症候群を強く疑う既往歴・家族歴がない」場合でも,MSI-HighまたはMMR蛋白質消失であれば,リンチ症候群の可能性がある(多くは散発性大腸癌と考えられる)。既往歴,家族歴に注意を払いながら経過観察を行う。
- 家族歴,既往歴からリンチ症候群の可能性が低いと考えられるMSS/MSI-LまたはMMR蛋白質消失なしの大腸癌症例では,特別なサーベイランスは行わず,大腸癌またはその他の関連腫瘍を疑う症状が出現,もしくは血縁者に新たな関連腫瘍が発症した場合は,受診を勧める。
Ⅲ-5 家族(血縁者)への対応
- 患者本人の他に,家族(血縁者)にも遺伝カウンセリングを行うことが望ましい。
- at risk者(特に,第1度近親者(親,子,兄弟姉妹))には疾患について十分な説明を行い,同意を得たうえで遺伝学的検査,もしくはリスク評価に応じた関連腫瘍のサーベイランスを行う。
- リンチ症候群の関連腫瘍の発症は一般に成年期以降であるので,遺伝学的検査の時期も原則的に成年期以降になる。
Ⅲ-5-1 遺伝学的診断例
- 病的バリアント保持者であることが確定している,あるいは遺伝学的検査を行っていない血縁者にはリンチ症候群としての関連腫瘍のサーベイランスを行う(図Ⅲ-6)。
- 病的バリアントがないことが確認された血縁者については,一般のがん検診を行う(図Ⅲ-6)。
- リンチ症候群の関連腫瘍のサーベイランス開始年齢に達している血縁者に対しては,サーベイランスの必要性,遺伝学的検査の意義についての情報を提供する。遺伝学的検査を受けるかどうかは遺伝カウンセリングを通じて本人の意思で決定する。
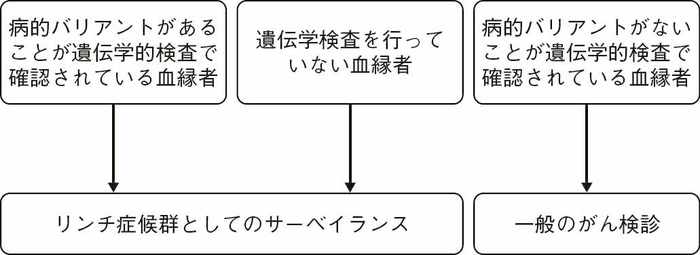
図Ⅲ-6 リンチ症候群患者の家族(血縁者)への対応
Ⅲ-5-2 遺伝学的未確定例
- 遺伝学的検査を実施していない,あるいは実施したがリンチ症候群と診断することができなかった患者の血縁者には,家系における関連腫瘍の発生年齢や頻度などを参考に個別のリスク評価を行い,関連腫瘍のサーベイランスを行う。
文献
- Suter CM, Martin DI, Ward RL: Germline epimutation of MLH1 in individuals with multiple cancers. Nat Genet 2004; 36: 497-501.[PMID: 15064764]
- Hampel H, Frankel WL, Martin E, et al.: Screening for the Lynch syndrome(hereditary nonpolyposis colorectal cancer). N Engl J Med 2005; 352: 1851-1860.[PMID: 15872200]
- Dunlop MG, Farrington SM, Carothers AD, et al.: Cancer risk associated with germline DNA mismatch repair gene mutations. Hum Mol Genet 1997; 6: 105-110.[PMID: 9002677]
- Barrow E, Alduaij W, Robinson L, et al.: Colorectal cancer in HNPCC: cumulative lifetime incidence, survival and tumour distribution. A report of 121 families with proven mutations. Clin Genet 2008; 74: 233-242.[PMID: 18554281]
- Grover S, Syngal S: Genetic testing in gastroenterology: Lynch syndrome. Best Pract Res Clin Gastroenterol 2009; 23: 185-196.[PMID: 19414145]
- Win AK, Young JP, Lindor NM, et al.: Colorectal and other cancer risks for carriers and noncarriers from families with a DNA mismatch repair gene mutation: a prospective cohort study. J Clin Oncol 2012; 30: 958-964.[PMID: 22331944]
- Raymond VM, Mukherjee B, Wang F, et al.: Elevated risk of prostate cancer among men with Lynch syndrome. J Clin Oncol 2013; 31: 1713-1718.[PMID: 23530095]
- Saita C, Yamaguchi T, Horiguchi SI, et al.: Tumor development in Japanese patients with Lynch syndrome. PLoS One 2018; 13: e0195572.[PMID: 29672549]
- Stoffel E, Mukherjee B, Raymond VM, et al.: Calculation of risk of colorectal and endometrial cancer among patients with Lynch syndrome. Gastroenterology 2009; 137: 1621-1627.[PMID: 19622357]
- Barrow E, Robinson L, Alduaij W, et al.: Cumulative lifetime incidence of extracolonic cancers in Lynch syndrome: a report of 121 families with proven mutations. Clin Genet 2009; 75: 141-149.[PMID: 19215248]
- Hampel H, Stephens JA, Pukkala E, et al.: Cancer risk in hereditary nonpolyposis colorectal cancer syndrome: later age of onset. Gastroenterology 2005; 129: 415-421.[PMID: 16083698]
- Watson P, Vasen HFA, Mecklin JP, et al.: The risk of extra-colonic, extra-endometrial cancer in the Lynch syn- drome. Int J Cancer 2008; 123: 444-449.[PMID: 18398828]
- Aarnio M, Sankila R, Pukkala E, et al.: Cancer risk in mutation carriers of DNA-mismatch-repair genes. Int J Cancer 1999; 81: 214-218.[PMID: 10188721]
- Kastrinos F, Mukherjee B, Tayob N, et al.: Risk of pancreatic cancer in families with Lynch syndrome. JAMA 2009; 302: 1790-1795.[PMID: 19861671]
- Kohlmann W, Gruber SB: Lynch Syndrome. In: Adam MP, Ardinger HH, Pagon RA, et al., editors.: GeneReviews®[Internet]. Seattle(WA): University of Washington, Seattle; 1993-2019., 2004 Feb 5[updated 2018 Apr 12]
- Kempers MJ, Kuiper RP, Ockeloen CW, et al.: Risk of colorectal and endometrial cancers in EPCAM deletion-positive Lynch syndrome: a cohort study. Lancet Oncol 2011; 12: 49-55.[PMID: 21145788]
- Tutlewska K, Lubinski J, Kurzawski G: Germline deletions in the EPCAM gene as a cause of Lynch syndrome- literature review. Hered Cancer Clin Pract 2013; 11: 9.[PMID: 23938213]
- Kuiper RP, Vissers LE, Venkatachalam R, et al.: Recurrence and variability of germline EPCAM deletions in Lynch syndrome. Hum Mutat 2011; 32: 407-414.[PMID: 21309036]
- Bonadona V, Bonaiti B, Olschwang S, et al.: Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. JAMA 2011; 305: 2304-2310.[PMID: 21642682]
- Moller P, Seppala TT, Bernstein I, et al.: Cancer risk and survival in path_MMR carriers by gene and gender up to 75 years of age: a report from the Prospective Lynch Syndrome Database. Gut 2018; 67: 1306-1316.[PMID: 28754778]
- Ryan NAJ, Morris J, Green K, et al.: Association of mismatch repair mutation with age at cancer onset in Lynch syndrome: Implications for stratified surveillance strategies. JAMA Oncol 2017; 3: 1702-1706.[PMID: 28772289]
- Møller P, Seppälä T, Bernstein I, et al.: Cancer incidence and survival in Lynch syndrome patients receiving colo-noscopic and gynaecological surveillance: first report from the prospective Lynch syndrome database. Gut 2017; 66: 464-472.[PMID: 26657901]
- Baglietto L, Lindor NM, Dowty JG, et al.: Risks of Lynch syndrome cancers for MSH6 mutation carriers. J Natl Cancer Inst 2010; 102: 193-201.[PMID: 20028993]
- Suerink M, Rodriguez-Girondo M, van der Klift HM, et al.: An alternative approach to establishing unbiased col- orectal cancer risk estimation in Lynch syndrome. Genet Med 2019; 21: 2706-2712.[PMID: 31204389]
- Senter L, Clendenning M, Sotamaa K, et al.: The clinical phenotype of Lynch syndrome due to germ-line PMS2 mutations. Gastroenterology 2008; 135: 419-428.[PMID: 18602922]
- Ten Broeke SW, van der Klift HM, Tops CMJ, et al.: Cancer risks for PMS2-associated Lynch syndrome. J Clin Oncol 2018; 36: 2961-2968.[PMID: 30161022]
- Dominguez-Valentin M, Sampson J, Seppälä T, et al.: Cancer risks by gene, age, and gender in 6350 carriers of pathogenic mismatch repair variants: findings from the Prospective Lynch Syndrome Database. Genet Med 2020; 22: 15-25.[PMID: 31337882]
- Engel C, Loeffler M, Steinke V, et al.: Risks of less common cancers in proven mutation carriers with lynch syn-drome. J Clin Oncol 2012; 30: 4409-4415.[PMID: 23091106]
- Dominguez-Valentin M, Joost P, Therkildsen C, et al.: Frequent mismatch-repair defects link prostate cancer to Lynch syndrome. BMC Urol 2016; 16: 15.[PMID: 27013479]
- Joost P, Therkildsen C, Dominguez-Valentin M, et al.: Urinary tract cancer in Lynch syndrome; increased risk in carriers of MSH2 mutations. Urology 2015; 86: 1212-1217.[PMID: 26385421]
- Watson P, Vasen HFA, Mecklin JP, et al.: The risk of extra-colonic, extra-endometrial cancer in the Lynch syn- drome. Int J Cancer 2008; 123: 444-449.[PMID: 18398828]
- Capelle L, van Grieken N, Lingsma H, et al.: Risk and epidemiological time trends of gastric cancer in Lynch syn- drome carriers in the Netherlands. Gastroenterology 2010; 138: 487-492.[PMID: 19900449]
- Haraldsdottir S, Rafnar T, Frankel WL, et al.: Comprehensive population-wide analysis of Lynch syndrome in Iceland reveals founder mutations in MSH6 and PMS2. Nature Comm 2017; 8: 14755.[PMID: 28466842]
- Møller P, Seppälä T, Dowty JG, et al.; European Hereditary Tumour Group(EHTG)and the International Mis- match Repair Consortium(IMRC): Colorectal cancer incidences in Lynch syndrome: a comparison of results from the prospective lynch syndrome database and the international mismatch repair consortium. Hered Cancer Clin Pract 2022; 20: 36.[PMID: 36182917]
- Dominguez-Valentin M, Haupt S, Seppälä TT, et al.: Mortality by age, gene and gender in carriers of pathogenic mismatch repair gene variants receiving surveillance for early cancer diagnosis and treatment: a report from the prospective Lynch syndrome database. EClinicalMedicine 2023; 58: 101909.[PMID: 37181409]
- International Mismatch Repair Consortium: Variation in the risk of colorectal cancer in families with Lynch syn-drome: a retrospective cohort study. Lancet Oncol 2021; 22: 1014-1022.[PMID: 34111421]
- Cho H, Yamada M, Sekine S, et al.: Gastric cancer is highly prevalent in Lynch syndrome patients with atrophic gastritis. Gastric Cancer 2021; 24: 283-291.[PMID: 32794040]
- Kanaya N, Aoki H, Morito T, et al.: Clinical features of biliary tract cancer in Japanese individuals with Lynch syndrome. J Gastrointest Oncol 2022; 13: 2532-2538.[PMID: 36388648]
- Cumulative risk for the general population represents cumulative incidence reported by the Surveillance, Epide- miology, and End Results 21 program data, 2017-2019. Accessed April 1, 2024 via SEER*Explorer.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology. Genetic/Familial High-Risk Assessment: Colorectal. Version 2. 2023. Available from: https://www.nccn.org/guidelines/guidelines-de tail?category=2&id=1436
- Yanaba K, Nakagawa H, Takeda Y, et al.: Muir-Torre syndrome caused by partial duplication of MSH2 gene by Alu-mediated nonhomologous recombination. Br J Dermatol 2008; 158: 150-156.[PMID: 17941949]
- Win AK, Jenkins MA, Dowty JG, et al.: Prevalence and Penetrance of Major Genes and Polygenes for Colorectal Cancer. Cancer Epidemiol Biomarkers Prev 2017; 26: 404-412.[PMID: 27799157]
- Rosenblum RE, Ang C, Suckiel SA, et al.: Lynch Syndrome-Associated Variants and Cancer Rates in an Ances- trally Diverse Biobank. JCO Precis Oncol 2020; 4: PO.20.00290.[PMID: 33283134]
- Patel AP, Wang M, Fahed AC, et al.: Association of Rare Pathogenic DNA Variants for Familial Hypercholester-olemia, Hereditary Breast and Ovarian Cancer Syndrome, and Lynch Syndrome With Disease Risk in Adults According to Family History. JAMA Netw Open 2020; 3: e203959.[PMID: 32347951]
- Canard G, Lefevre JH, Colas C, et al.: Screening for Lynch syndrome in colorectal cancer: are we doing enough? Ann Surg Oncol 2012; 19: 809-816.[PMID: 21879275]
- Julié C, Trésallet C, Brouquet A, et al.: Identification in daily practice of patients with Lynch syndrome(hereditary nonpolyposis colorectal cancer): revised Bethesda guidelines-based approach versus molecular screening. Am J Gastroenterol 2008; 103: 2825-2835; quiz 2836.[PMID: 18759827]
- Fujita M, Liu X, Iwasaki Y, et al.: Population-based Screening for Hereditary Colorectal Cancer Variants in Japan. Clin Gastroenterol Hepatol 2022; 20: 2132-2141.e9.[PMID: 33309985]
- Chika N, Eguchi H, Kumamoto K, et al.: Prevalence of Lynch syndrome and Lynch-like syndrome among patients with colorectal cancer in a Japanese hospital-based population. Jpn J Clin Oncol 2017; 47: 108-117.[PMID: 27920101]
- Vasen HF, Watson P, Mecklin JP, et al.: New clinical criteria for hereditary nonpolyposis colorectal cancer(HNPCC, Lynch syndrome)proposed by the International Collaborative group on HNPCC. Gastroenterology 1999; 116: 1453-1456.[PMID: 10348829]
- Umar A, Boland CR, Terdiman JP, et al.: Revised Bethesda Guidelines for hereditary nonpolyposis colorectal can- cer(Lynch syndrome)and microsatellite instability. J Natl Cancer Inst 2004; 96: 261-268.[PMID: 14970275]
- Blaker H, Haupt S, Morak M, et al.: Age-dependent performance of BRAF mutation testing in Lynch syndrome diagnostics. Int J Cancer 2020; 147: 2801-2810.[PMID: 32875553]
- Ladabaum U, Ford JM, Martel M, et al.: American Gastroenterological Association Technical Review on the Diag- nosis and Management of Lynch Syndrome. Gastroenterology 2015; 149: 783-813. e20.[PMID: 26226576]
- Moreira L, Balaguer F, Lindor N, et al.: Identification of Lynch syndrome among patients with colorectal cancer. JAMA 2012; 308: 1555-1565.[PMID: 23073952]
- Jiang W, Cai MY, Li SY, et al.: Universal screening for Lynch syndrome in a large consecutive cohort of Chinese colorectal cancer patients: High prevalence and unique molecular features. Int J Cancer 2019; 144: 2161-2168.[PMID: 30521064]
- Sjursen W, Haukanes BI, Grindedal EM, et al.: Current clinical criteria for Lynch syndrome are not sensitive enough to identify MSH6 mutation carriers. J Med Genet 2010; 47: 579-585.[PMID: 20587412]
- 古川洋一: 遺伝性大腸癌を振り返る HNPCC 日本の現状.大腸癌 Frontier 2010; 3: 120-124.
- Piñol V, Castells A, Andreu M, et al.: Accuracy of revised Bethesda guidelines, microsatellite instability, and immu-nohistochemistry for the identification of patients with hereditary nonpolyposis colorectal cancer. JAMA 2005; 293: 1986-1894.[PMID: 15855432]
- Jenkins MA, Hayashi S, OʼShea AM, et al.: Pathology features in Bethesda guidelines predict colorectal cancer microsatellite instability: a population-based study. Gastroenterology 2007; 133: 48-56.[PMID: 17631130]
- Sekine S, Mori T, Ogawa R, et al.: Mismatch repair deficiency commonly precedes adenoma formation in Lynch Syndrome-Associated colorectal tumorigenesis. Mod Pathol 2017; 30: 1144-1151.[PMID: 28548127]
- Aaltonen LA, Peltomaki P, Mecklin JP, et al.: Replication errors in benign and malignant tumors from hereditary nonpolyposis colorectal cancer patients. Cancer Res 1994; 54: 1645-1648.[PMID: 8137274]
- Aaltonen LA, Salovaara R, Kristo P, et al.: Incidence of hereditary nonpolyposis colorectal cancer and the feasibil- ity of molecular screening for the disease. N Engl J Med 1998; 338: 1481-1487.[PMID: 9593786]
- Peltomäki P: Role of DNA mismatch repair defects in the pathogenesis of human cancer. J Clin Oncol 2003; 21: 1174-1179.[PMID: 12637487]
- Ishikubo T, Nishimura Y, Yamaguchi K, et al.: The clinical features of rectal cancers with high-frequency micro- satellite instability(MSI-H)in Japanese males. Cancer Lett 2004; 216: 55-62.[PMID: 15500949]
- Asaka S, Arai Y, Nishimura Y, et al.: Microsatellite instability-low colorectal cancer acquires a KRAS mutation during the progression from Dukesʼ A to Dukesʼ B. Carcinogenesis 30: 494-499.[PMID: 19147861]
- Loughrey MB, McGrath J, Coleman HG, et al.: Identifying mismatch repair-deficient colon cancer: near-perfect concordance between immunohistochemistry and microsatellite instability testing in a large, population-based series. Histopathology 2021; 78: 401-413.[PMID: 32791559]
- Shia J, Tang LH, Vakiani E, et al.: Immunohistochemistry as first-line screening for detecting colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome: a 2-antibody panel may be as predictive as a 4-antibody panel. Am J Surg Pathol 2009; 33: 1639-1645.[PMID: 19701074]
- Shia J, Zhang L, Shike M, et al.: Secondary mutation in a coding mononucleotide tract in MSH6 causes loss of immunoexpression of MSH6 in colorectal carcinomas with MLH1/PMS2 deficiency. Mod Pathol 2013; 26: 131- 138.[PMID: 22918162]
- Adar T, Rodgers LH, Shannon KM, et al.: Universal screening of both endometrial and colon cancers increases the detection of Lynch syndrome. Cancer 2018; 124: 3145-3153.
- Syngal S, Brand RE, Church JM, et al.: ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol 2015; 110: 223-262; quiz 263.[PMID: 25645574]
- Vasen HF, Blanco I, Aktan-Collan K, et al.: Revised guidelines for the clinical management of Lynch syndrome (HNPCC): recommendations by a group of European experts. Gut 2013; 62: 812-823.[PMID: 23408351]
- Giardiello FM, Allen JI, Axilbund JE, et al.: Guidelines on genetic evaluation and management of Lynch syndrome: a consensus statement by the US Multi-Society Task Force on colorectal cancer. Gastroenterology 2014; 147: 502-526.[PMID: 25043945]
- Stoffel EM, Mangu PB, Gruber SB, et al.: Hereditary colorectal cancer syndromes: American Society of Clinical Oncology Clinical Practice Guideline endorsement of the familial risk-colorectal cancer: European Society for Medical Oncology Clinical Practice Guidelines. J Clin Oncol 2015; 33: 209-217.[PMID: 25452455]
- Guillén-Ponce C, Serrano R, Sanchez-Heras AB, et al.: Clinical guideline seom: hereditary colorectal cancer. Clin Transl Oncol 2015; 17: 962-971.[PMID: 26586118]
- Kane MF, Loda M, Gaida GM, et al.: Methylation of the hMLH1 promoter correlates with lack of expression of hMLH1 in sporadic colon tumors and mismatch repair-defective human tumor cell lines. Cancer Res 1997; 57: 808-811.[PMID: 9041175]
- Adar T, Rodgers LH, Shannon KM, et al.: A tailored approach to BRAF and MLH1 methylation testing in a uni- versal screening program for Lynch syndrome. Mod Pathol 2017; 30: 440-447.[PMID: 28059100]
- Palles C, Cazier JB, Howarth KM, et al.: Germline mutations affecting the proofreading domains of POLE and POLD1 predispose to colorectal adenomas and carcinomas. Nat Genet 2013; 45: 136-144.[PMID: 23263490]
- Spier I, Holzapfel S, Altmuller J, et al.: Frequency and phenotypic spectrum of germline mutations in POLE and seven other polymerase genes in 266 patients with colorectal adenomas and carcinomas. Int J Cancer 2015; 137: 320-331.[PMID: 25529843]
- Bellido F, Pineda M, Aiza G, et al.: POLE and POLD1 mutations in 529 kindred with familial colorectal cancer and/or polyposis: review of reported cases and recommendations for genetic testing and surveillance. Genet Med 2016; 18: 325-332.[PMID: 26133394]
- Rodríguez-Soler M, Pérez-Carbonell L, Guarinos C, et al.: Risk of cancer in cases of suspected lynch syndrome without germline mutation. Gastroenterology 2013; 144: 926-932.E1; quiz e13-4.[PMID: 23354017]
- Carethers JM: Differentiating Lynch-like from Lynch syndrome. Gastroenterology 2014; 146: 602-604.[PMID:24468183]
- Wimmer K, Kratz CP, Vasen HF, et al.: Diagnostic criteria for constitutional mismatch repair deficiency syndrome: suggestions of the European consortiumʻcare for CMMRD(ʼC4CMMRD). J Med Genet 2014; 51: 355-365.[PMID: 24737826]
- Hizuka K, Hagiwara SI, Maeyama T, et al.: Constitutional mismatch repair deficiency in childhood colorectal can- cer harboring a de novo variant in the MSH6 gene: a case report. BMC Gastroenterol 2021; 21: 60.[PMID: 33568103]
- 小児慢性特定疾病情報センター:PMS2異常症.https://www.shouman.jp/disease/details/10_02_016/(2024年4月1日閲覧)
- Durno C, Ercan AB, Bianchi V, et al.: Survival benefit for individuals with constitutional mismatch repair defi- ciency undergoing surveillance. J Clin Oncol 2021; 39: 2779-2790.[PMID: 33945292]
- Durno C, Boland CR, Cohen S, et al.: Recommendations on Surveillance and Management of Biallelic Mismatch Repair Deficiency(BMMRD)Syndrome: A Consensus Statement by the US Multi-Society Task Force on Col- orectal Cancer. Gastroenterology 2017; 152: 1605-1614.[PMID: 28363489]
- Vasen HF, Mecklin JP, Khan PM, et al.: The International Collaborative Group on Hereditary Non-Polyposis Col- orectal Cancer(ICG-HNPCC). Dis Colon Rectum 1991; 34: 424-425.[PMID: 2022152]
- Lindor NM, Rabe K, Petersen GM, et al.: Lower cancer incidence in Amsterdam-I criteria families without mis- match repair deficiency: familial colorectal cancer type X. JAMA 2005; 293: 1979-1985.[PMID: 15855431]
- Yamaguchi T, Furukawa Y, Nakamura Y, et al.: Comparison of clinical features between suspected familial col- orectal cancer type X and Lynch syndrome in Japanese patients with colorectal cancer: a cross-sectional study conducted by the Japanese Society for Cancer of the Colon and Rectum. Jpn J Clin Oncol 2015; 45: 153-159.[PMID: 25404568]
- Hatamori H, Chino A, Arai M, et al.: Malignant potential of colorectal neoplasms in Lynch syndrome: an analysis of 325 lesions endoscopically treated at a single institute. Jpn J Clin Oncol 2021; 51: 737-743.[PMID: 33558893]
- Vasen HF, Nagengast FM, Khan PM: Interval cancers in hereditary non-polyposis colorectal cancer(Lynch syndrome). Lancet 1995; 345: 1183-1184.[PMID: 7723574]
- Vasen HF, Watson P, Mecklin JP, et al.: New clinical criteria for hereditary nonpolyposis colorectal cancer(HNPCC, Lynch syndrome)proposed by the International Collaborative group on HNPCC. Gastroenterology 1999; 116: 1453-1456.[PMID: 10348829]
- Jass JR, Stewart SM: Evolution of hereditary non-polyposis colorectal cancer. Gut 1992; 33: 783-786.[PMID: 1624160]
- Jass JR, Cottier DS, Pokos V, et al.: Mixed epithelial polyps in association with hereditary non-polyposis colorectal cancer providing an alternative pathway of cancer histogenesis. Pathology 1997; 29: 28-33.[PMID: 9094174]
- Ahadova A, Gallon R, Gebert J, et al.: Three molecular pathways model colorectal carcinogenesis in Lynch syn-drome. Int J Cancer 2018; 143: 139-150.[PMID: 29424427]
- Seppälä TT, Latchford A, Negoi I, et al.: European guidelines from the EHTG and ESCP for Lynch syndrome: an updated third edition of the Mallorca guidelines based on gene and gender. Br J Surg 2021; 108: 484-498.[PMID: 34043773]
- Monahan KJ, Bradshaw N, Dolwani S, et al.: Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology(BSG)/Association of Coloproctology of Great Britain and Ireland(ACPGBI)/United Kingdom Cancer Genetics Group(UKCGG). Gut 2020; 69: 411-444.[PMID: 31780574]
- Järvinen HJ, Aarnio M, Mustonen H, et al.: Controlled 15-year trial on screening for colorectal cancer in families with hereditary nonpolyposis colorectal cancer. Gastroenterology 2000; 118: 829-834.[PMID: 10784581]
- Engel C, Rahner N, Schulmann K, et al.: Efficacy of annual colonoscopic surveillance in individuals with hereditary nonpolyposis colorectal cancer. Clin Gastroenterol Hepatol 2010; 8: 174-182.[PMID: 19835992]
- Engel C, Vasen HF, Seppälä T, et al.: No Difference in Colorectal Cancer Incidence or Stage at Detection by Colo-noscopy Among 3 countries with different Lynch syndrome surveillance policies. Gastroenterology 2018; 155: 1400-1409.e2.[PMID: 30063918]
- Seppälä TT, Ahadova A, Dominguez-Valentin M, et al.: Lack of association between screening interval and cancer stage in Lynch syndrome may be accounted for by over-diagnosis; a prospective Lynch syndrome database report. Hered Cancer Clin Pract 2019; 17: 8.
- Rivero-Sanchez L, Arnau-Collell C, Herrero J, et al.: White-light endoscopy is adequate for Lynch syndrome surveillance in a randomized and noninferiority study. Gastroenterology 2020; 158: 895-904.e1.[PMID: 30858900]
- Botma A, Nagengast FM, Braem MG, et al.: Body mass index increases risk of colorectal adenomas in men with Lynch syndrome: the GEOLynch cohort study. J Clin Oncol 2010; 28: 4346-4353.[PMID: 20733131]
- Movahedi M, Bishop DT, Macrae F, et al.: Obesity, aspirin, and risk of colorectal cancer in carriers of hereditary colorectal cancer: A prospective investigation in the CAPP2 Study. J Clin Oncol 2015; 33: 3591-3597.[PMID: 26282643]
- Burn J, Gerdes AM, Macrae F, et al.: Long-term effect of aspirin on cancer risk in carriers of hereditary colorec- tal cancer: an analysis from the CAPP2 randomised controlled trial. Lancet 2011; 378: 2081-2087.[PMID: 22036019]
- Tanakaya K, Furukawa Y, Nakamura Y, et al.: Relationship between smoking and multiple colorectal cancers in patients with Japanese Lynch syndrome: a cross-sectional study conducted by the Japanese Society for Cancer of the Colon and Rectum. Jpn J Clin Oncol 2015; 45: 307-310.[PMID: 25583420]
- van Duijnhoven FJ, Botma A, Winkels R, et al.: Do lifestyle factors influence colorectal cancer risk in Lynch syn- drome? Fam Cancer 2013; 12: 285-293.[PMID: 23657759]
- Winkels RM, Botma A, Van Duijnhoven FJ, et al.: Smoking increases the risk for colorectal adenomas in patients with Lynch syndrome. Gastroenterology 2012; 142: 241-247.[PMID: 22062356]
- Chau R, Dashti SG, Ait Ouakrim D, et al.: Multivitamin, calcium and folic acid supplements and the risk of colorec- tal cancer in Lynch syndrome. Int J Epidemiol 2016; 45: 940-953.[PMID: 27063605]
- Diergaarde B, Braam H, Vasen HF, et al.: Environmental factors and colorectal tumor risk in individuals with hereditary nonpolyposis colorectal cancer. Clin Gastroenterol Hepatol 2007; 5: 736-742.[PMID: 17544999]
- Kamiza AB, Hsieh LL, Tang R, et al.: Risk factors associated with colorectal cancer in a subset of patients with mutations in MLH1 and MSH2 in Taiwan fulfilling the Amsterdam Ⅱ criteria for Lynch syndrome. PLoS One 2015; 10: e0130018.[PMID: 26053027]
- Dashti SG, Buchanan DD, Jayasekara H, et al.: Alcohol consumption and the risk of colorectal cancer for mismatch repair gene mutation carriers. Cancer Epidemiol Biomarkers Prev 2017; 26: 366-375.[PMID: 27811119]
- Miguchi M, Hinoi T, Tanakaya K, et al.: Alcohol consumption and early-onset risk of colorectal cancer in Japanese patients with Lynch syndrome: a cross-sectional study conducted by the Japanese Society for Cancer of the Colon and Rectum. Surg Today 2018; 48: 810-814.[PMID: 29574523]
- Dashti SG, Win AK, Hardikar SS, et al.: Physical activity and the risk of colorectal cancer in Lynch syndrome. Int J Cancer 2018; 143: 2250-2260.[PMID: 29904935]
- Haanstra JF, Vasen HF, Sanduleanu S, et al.: Quality colonoscopy and risk of interval cancer in Lynch syndrome. Int J Colorectal Dis 2013; 28: 1643-1649.[PMID: 23857598]
- Møller P, Seppälä T, Bernstein I, et al.: Incidence of and survival after subsequent cancers in carriers of pathogenic MMR variants with previous cancer: a report from the prospective Lynch syndrome database. Gut 2017; 66: 1657-1664.[PMID: 27261338]
- Anele CC, Adegbola SO, Askari A, et al.: Risk of metachronous colorectal cancer following colectomy in Lynch syndrome: a systematic review and meta-analysis. Colorectal Dis 2017; 19: 528-536.[PMID: 28407411]
- Malik SS, Lythgoe MP, McPhail M, et al.: Metachronous colorectal cancer following segmental or extended colectomy in Lynch syndrome: a systematic review and meta-analysis. Fam Cancer 2018; 17: 557-564.[PMID: 29189962]
- Win AK, Parry S, Parry B, et al.: Risk of metachronous colon cancer following surgery for rectal cancer in mis- match repair gene mutation carriers. Ann Surg Oncol 2013; 20: 1829-1836.[PMID: 23358792]
- Yamano T, Hamanaka M, Babaya A, et al.: Management strategies in Lynch syndrome and familial adenomatous polyposis: a national healthcare survey in Japan. Cancer Sci 2017; 108: 243-249.[PMID: 27870147]
- Nagasaki T, Arai M, Chino A, et al.: Feasibility of Segmental Colectomy Followed by Endoscopic Surveillance as a Treatment Strategy for Colorectal Cancer Patients with Lynch Syndrome. Dig Surg 2018; 35: 448-456.[PMID: 29017165]
- Sinicrope FA, Foster NR, Thibodeau SN, et al.: DNA mismatch repair status and colon cancer recurrence and survival in clinical trials of 5-fluorouracil-based adjuvant therapy. J Natl Cancer Inst 2011; 103: 863-875.[PMID: 21597022]
- Des Guetz G, Schischmanoff O, Nicolas P, et al.: Does microsatellite instability predict the efficacy of adjuvant chemotherapy in colorectal cancer? A systematic review with meta-analysis. Eur J Cancer 2009; 45: 1890-1896.[PMID: 19427194]
- Webber EM, Kauffman TL, OʼConnor E, et al.: Systematic review of the predictive effect of MSI status in colorec- tal cancer patients undergoing 5FU-based chemotherapy. BMC Cancer 2015; 15: 156.[PMID: 25884995]
- Andre T, de Gramont A, Vernerey D, et al.: Adjuvant Fluorouracil, Leucovorin, and Oxaliplatin in Stage Ⅱ to Ⅲ Colon Cancer: Updated 10-Year Survival and Outcomes According to BRAF Mutation and Mismatch Repair Status of the MOSAIC Study. J Clin Oncol 2015; 33: 4176-4187.[PMID: 26527776]
- Cohen R, Taieb J, Fiskum J, et al.: Microsatellite Instability in Patients With Stage Ⅲ Colon Cancer Receiving Fluoropyrimidine With or Without Oxaliplatin: An ACCENT Pooled Analysis of 12 Adjuvant Trials. J Clin Oncol 2021; 39: 642-651.[PMID: 26527776]
- Tran B, Kopetz S, Tie J, et al.: Impact of BRAF mutation and microsatellite instability on the pattern of metastatic spread and prognosis in metastatic colorectal cancer. Cancer 2011; 117: 4623-4632.[PMID: 21456008]
- Venderbosch S, Nagtegaal ID, Maughan TS, et al.: Mismatch repair status and BRAF mutation status in meta-static colorectal cancer patients: a pooled analysis of the CAIRO, CAIRO2, COIN, and FOCUS studies. Clin Can- cer Res 2014; 20: 5322-5330.[PMID: 25139339]
- Le DT, Uram JN, Wang H, et al.: PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015; 372: 2509-2520.[PMID: 26028255]
- Romiti A, Rulli E, Pilozzi E, et al.: Exploring the Prognostic Role of Microsatellite Instability in Patients With Stage Ⅱ Colorectal Cancer: A Systematic Review and Meta-Analysis. Clin Colorectal Cancer 2017; 16: e55-e59.[PMID: 27670891]
- Le DT, Diaz LA, Jr., Kim TW, et al.: Pembrolizumab for previously treated, microsatellite instability-high/mis- match repair-deficient advanced colorectal cancer: final analysis of KEYNOTE-164. Eur J Cancer 2023; 186: 185- 195.[PMID: 37141828]
- Maio M, Ascierto PA, Manzyuk L, et al.: Pembrolizumab in microsatellite instability high or mismatch repair deficient cancers: updated analysis from the phase Ⅱ KEYNOTE-158 study. Ann Oncol 2022; 33: 929-938.[PMID: 35680043]
- Overman MJ, McDermott R, Leach JL, et al.: Nivolumab in patients with metastatic DNA mismatch repair-defi- cient or microsatellite instability-high colorectal cancer(CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017; 18: 1182-1191.[PMID: 28734759]
- Overman MJ, Lonardi S, Wong KYM, et al.: Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol 2018; 36: 773-779.[PMID: 29355075]
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 2020; 383: 2207-2218.[PMID: 33264544]
- Carnevali I, Sahnane N, Chiaravalli AM, et al.: Strategies for Lynch syndrome identification in selected and unse- lected gynecological cancers. Eur J Cancer Prev 2022; 31: 369-376.[PMID: 34519692]
- Zhao S, Chen L, Zang Y, et al.: Endometrial cancer in Lynch syndrome. Int J Cancer 2022; 150: 7-17.[PMID: 34398969]
- Ryan NAJ, Glaire MA, Blake D, et al.: The proportion of endometrial cancers associated with Lynch syndrome: a systematic review of the literature and meta-analysis. Genet Med 2019; 21: 2167-2180.[PMID: 31086306]
- Lim N, Hickey M, Young GP, et al.: Screening and risk reducing surgery for endometrial or ovarian cancers in Lynch syndrome: a systematic review. Int J Gynecol Cancer 2022; 32: 646-655.[PMID: 35437274]
- 婦人科腫瘍委員会:本邦における遺伝性子宮内膜癌の頻度とその病態に関する小委員会.日産婦誌 2009; 61: 1540-1542
- Shikama A, Minaguchi T, Matsumoto K, et al.: Clinicopathologic implications of DNA mismatch repair status in endometrial carcinomas. Gynecol Oncol 2016; 140: 226-233.[PMID: 26644264]
- Masuda K, Banno K, Hirasawa A, et al.: Relationship of lower uterine segment cancer with Lynch syndrome: a novel case with an hMLH1 germline mutation. Oncol Rep 2012; 28: 1537-1543.[PMID: 22940821]
- Westin SN, Lacour RA, Urbauer DL, et al.: Carcinoma of the lower uterine segment: a newly described association with Lynch syndrome. J Clin Oncol 2008; 26: 5965-5971.[PMID: 19001318]
- Dong D, Lei H, Liu D, et al.: POLE and Mismatch Repair Status, Checkpoint Proteins and Tumor-Infiltrating Lymphocytes in Combination, and Tumor Differentiation: Identify Endometrial Cancers for Immunotherapy. Front Oncol 2021; 11: 640018.[PMID: 33816285]
- Ran X, Jing H, Li Z: The clinical features and management of Lynch syndrome-associated ovarian cancer. J Obstet Gynaecol Res 2022; 48: 1538-1545.[PMID: 35478369]
- Tanaka T, Takehara K, Yamashita N, et al.: Frequency and clinical features of deficient mismatch repair in ovar- ian clear cell and endometrioid carcinoma. J Gynecol Oncol 2022; 33: e67.[PMID: 36032025]
- Llach J, Pellise M, Monahan K: Lynch syndrome; towards more personalized management? Best Pract Res Clin Gastroenterol 2022; 58-59: 101790.[PMID: 35988964]
- Schmeler KM, Lynch HT, Chen LM, et al.: Prophylactic surgery to reduce the risk of gynecologic cancers in the Lynch syndrome. N Engl J Med 2006; 354: 261-269.[PMID: 16421367]
- Dominguez-Valentin M, Seppälä TT, Engel C, et al.: Risk-Reducing Gynecological Surgery in Lynch Syndrome: Results of an International Survey from the Prospective Lynch Syndrome Database. J Clin Med 2020; 9: 2290.[PMID: 32708519]
- Swanson CL, Bakkum-Gamez JN: Preventing Ovarian Cancer in High-risk Women: One Surgery at a Time. Clin Obstet Gynecol 2020; 63: 64-73.[PMID: 31764001]
- Manchanda R, Gaba F, Talaulikar V, et al.: Risk-Reducing Salpingo-Oophorectomy and the Use of Hormone Replacement Therapy Below the Age of Natural Menopause: Scientific Impact Paper No. 66 October 2021: Scien- tific Impact Paper No. 66. BJOG 2022; 129: e16-e34.[PMID: 34672090]
- Lachiewicz MP, Kravochuck SE, OʼMalley MM, et al.: Prevalence of occult gynecologic malignancy at the time of risk reducing and nonprophylactic surgery in patients with Lynch syndrome. Gynecol Oncol 2014; 132: 434-437.[PMID: 24211399]
- Fedda FA, Euscher ED, Ramalingam P, et al.: Prophylactic Risk-reducing Hysterectomies and Bilateral Salpingo-oophorectomies in Patients With Lynch Syndrome: A Clinicopathologic Study of 29 Cases and Review of the Lit- erature. Int J Gynecol Pathol 2020; 39: 313-320.[PMID: 31851061]
- Sun CC, Meyer LA, Daniels MS, et al.: Womenʼs preferences for cancer risk management strategies in Lynch syndrome. Gynecol Oncol 2019; 152: 514-521.[PMID: 30876497]
- Schmeler KM, Daniels MS, Soliman PT, et al.: Primary peritoneal cancer after bilateral salpingo-oophorectomy in two patients with Lynch syndrome. Obstet Gynecol 2010; 115: 432-434.[PMID: 20093870]
- Rouprêt M, Yates DR, Comperat E, et al.: Upper urinary tract urothelial cell carcinomas and other urological malignancies involved in the hereditary nonpolyposis colorectal cancer(lynch syndrome)tumor spectrum. Eur Urol 2008; 54: 1226-1236.[PMID: 18715695]
- Barrow PJ, Ingham S, OʼHara C, et al.: The spectrum of urological malignancy in Lynch syndrome. Fam Cancer 2013; 12: 57-63.[PMID: 23054215]
- Urakami S, Inoshita N, Oka S, et al.: Clinicopathological characteristics of patients with upper urinary tract urothe-lial cancer with loss of immunohistochemical expression of the DNA mismatch repair proteins in universal screening. Int J Urol 2018; 25: 151-156.[PMID: 29164703]
- Win AK, Lindor NM, Young JP, et al.: Risks of primary extracolonic cancers following colorectal cancer in lynch syndrome. J Natl Cancer Inst 2012; 104: 1363-1372.[PMID: 22933731]
- Skeldon SC, Semotiuk K, Aronson M, et al.: Patients with Lynch syndrome mismatch repair gene mutations are at higher risk for not only upper tract urothelial cancer but also bladder cancer. Eur Urol 2013; 63: 379-385.[PMID: 22883484]
- Huang D, Matin SF, Lawrentschuk N, et al.: Systematic Review: An Update on the Spectrum of Urological Malig- nancies in Lynch Syndrome. Bladder Cancer 2018; 4: 261-268.[PMID: 30112437]
- Dowty JG, Win AK, Buchanan DD, et al.: Cancer risks for MLH1 and MSH2 mutation carriers. Hum Mutat 2013; 34: 490-497.[PMID: 23255516]
- Raymond VM, Everett JN, Furtado LV, et al.: Adrenocortical carcinoma is a lynch syndrome-associated cancer. J Clin Oncol 2013; 31: 3012-3018.[PMID: 23752102]
- Harper HL, McKenney JK, Heald B, et al.: Upper tract urothelial carcinomas: frequency of association with mis- match repair protein loss and lynch syndrome. Mod Pathol 2017; 30: 146-156.[PMID: 27713421]
- Metcalfe MJ, Petros FG, Rao P, et al.: Universal Point of Care Testing for Lynch Syndrome in Patients with Upper Tract Urothelial Carcinoma. J Urol 2018; 199: 60-65.[PMID: 28797715]
- Kim JY, Byeon JS: Genetic Counseling and Surveillance Focused on Lynch Syndrome. J Anus Rectum Colon 2019; 3: 60-68.[PMID: 31559369]
- Hubosky SG, Boman BM, Charles S, et al.: Ureteroscopic management of upper tract urothelial carcinoma(UTUC) in patients with Lynch Syndrome(hereditary nonpolyposis colorectal cancer syndrome). BJU Int 2013; 112: 813- 819.[PMID: 23452166]
- Ikenoue T, Arai M, Ishioka C, et al.: Importance of gastric cancer for the diagnosis and surveillance of Japanese Lynch syndrome patients. J Hum Genet 2019; 64: 1187-1194.[PMID: 31588121]
- Barrow E, Hill J, Evans DG: Cancer risk in Lynch Syndrome. Fam Cancer 2013; 12: 229-240.[PMID: 23604856]
- 新井正美,小川大志,千野晶子,他:Lynch 症候群のサーベイランスにおける大腸内視鏡および上部消化管内視鏡による病変の発見頻度と病理学的所見に関する検討.家族性腫瘍 2010; 10: 32-38
- Olivier R, Randrian V, Tougeron D, et al.: Endoscopy to Diagnose and Prevent Digestive Cancers in Lynch Syn- drome. Cancers(Basel)2021; 13: 3505.[PMID: 34298719]
- 日本胃癌学会編:胃癌治療ガイドライン 医師用2021年7月改訂[第6版],金原出版,東京,2021
- Shitara K, Ajani JA, Moehler M, et al.: Nivolumab plus chemotherapy or ipilimumab in gastro-oesophageal cancer. Nature 2022; 603: 942-948.[PMID: 35322232]
- Abe T, Blackford AL, Tamura K, et al.: Deleterious Germline Mutations Are a Risk Factor for Neoplastic Progres- sion Among High-Risk Individuals Undergoing Pancreatic Surveillance. J Clin Oncol 2019; 37: 1070-1080.[PMID: 30883245]
- Goggins M, Overbeek KA, Brand R, et al.: Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening(CAPS)Consortium. Gut 2020; 69: 7-17.[PMID: 31672839]
- Calderwood AH, Sawhney MS, Thosani NC, et al.: American Society for Gastrointestinal Endoscopy guideline on screening for pancreatic cancer in individuals with genetic susceptibility: methodology and review of evidence. Gastrointest Endosc 2022; 95: 827-854.e3.[PMID: 35183359]
- Canto MI, Almario JA, Schulick RD, et al.: Risk of Neoplastic Progression in Individuals at High Risk for Pancreatic Cancer Undergoing Long-term Surveillance. Gastroenterology 2018; 155: 740-751.e2.[PMID: 29803839]









