
各論
Ⅱ.家族性大腸腺腫症(familial adenomatous polyposis:FAP)
Ⅱ-1 概要
- 家族性大腸腺腫症(Familial adenomatous polyposis:FAP)は大腸腺腫性ポリポーシスを主徴とする第5番染色体上のAPC遺伝子(5q22.2)の生殖細胞系列病的バリアントを原因とする常染色体顕性遺伝(優性遺伝)性疾患である(サイドメモⅡ-1:家族性大腸腺腫症の呼称,サイドメモⅡ-2:APC関連ポリポーシス)。
- FAPの患者は大腸癌の罹患リスクが高いため,大腸癌に対する適切な治療介入が重要である。また,大腸外にも腫瘍性および非腫瘍性病変が好発するため,随伴病変を考慮したサーベイランスや治療が必要となる。
- なお,FAPの診断は遺伝学的検査によってのみ実施されるが,2024年1月現在,本邦では大腸腺腫性ポリポーシスに対する遺伝学的検査は保険適用外である。したがって,本邦では臨床的にFAPが疑われても遺伝学的検査未実施の症例が多い。しかし,100個以上の腺腫性ポリポーシスを認める症例では,8割以上にAPC遺伝子に生殖細胞系列の病的バリアントを認めることから,古典的FAPに矛盾しない表現型を認める症例は,臨床上はFAPに準じてサーベイランスおよび治療,血縁者への対応を行う。
サイドメモⅡ-1
■家族性大腸腺腫症の呼称
本ガイドラインではfamilial adenomatous polyposisの日本語訳として「家族性大腸腺腫症」の呼称を用いてきたが,同疾患を「家族性腺腫性ポリポーシス」,「家族性大腸ポリポーシス(症候群)」と呼称することもある。
サイドメモⅡ-2
■APC関連ポリポーシス(APC-associated polyposis(conditions))
近年,大腸腺腫性ポリポーシスを引き起こす複数の原因遺伝子とその遺伝形式,関連腫瘍を含む随伴病変が明らかとなり,原因遺伝子ごとにサーベイランスや治療,血縁者への対応が提案されている(CQ1)。それに伴い,原因遺伝子にちなんだ疾患名の命名が増えつつあり,FAPとgastric adenocarcinoma and proximal polyposis of the stomach(GAPPS)(Ⅱ-2-2:鑑別を要する疾患・病態)を併せてAPC関連ポリポーシス(APC-associated polyposis(conditions))との総称を用いられることがある1,2)。また,FAPを含む腺腫性ポリポーシスを生じる疾患を腺腫性ポリポーシス症候群(adenomatous polyposis syndrome)と総称することがある1)。
Ⅱ-1-1 臨床的特徴
- FAPは大腸癌(CRC)素因症候群であり,古典型とattenuated型がある。
- 古典型FAPは数百から数千の大腸腺腫性ポリープを特徴とし,平均16歳(範囲7~36歳)から発症し始める。古典型FAPの場合,95%が35歳までにポリープを形成し,大腸切除などの介入を行わなければCRCは避けられない。未治療者のCRC診断の平均年齢は39歳(範囲34~43歳)である。古典型FAPは腺腫密度により,密生型FAP,非密生型FAPに分類されることがあり,肉眼的に正常粘膜が観察できないほど腺腫を発生し,腺腫数が>1,000個(または>2,000個)の場合,密生型FAP(severe/profuse/dense FAP)(図Ⅱ-1),正常粘膜を背景に腺腫が多発し腺腫数がおよそ100~1,000個(または2,000個)の場合,非密生型FAP(sparse FAP)と分類する(図Ⅱ-2)ことがある。ただし,大腸の部位によって腺腫密度が異なることもしばしば経験し,密生型と非密生型を厳密に区別する臨床的意義は乏しい。
- 腺腫数が,およそ10個以上100個未満で,生殖細胞系列にAPC病的バリアントを認めた場合,attenuated型FAP(AFAP:attenuated FAP)注1に分類される。AFAPは,古典型FAPと比べて大腸ポリープ数が少なく(平均30個),近位に多く,診断年齢が高く(平均50~55歳),CRC生涯リスクは低い(70%)。
- 大腸外症状は様々で,胃や十二指腸のポリープ,骨腫,歯の異常,網膜色素上皮の先天性肥大(CHRPE),良性の皮膚病変,デスモイド腫瘍,副腎腫瘤,その他の関連癌がある。
- GAPPSは近位胃ポリポーシスを特徴とし,胃腺癌のリスクが高く,報告されたほとんどの個体では十二指腸や大腸の病変は認められない。
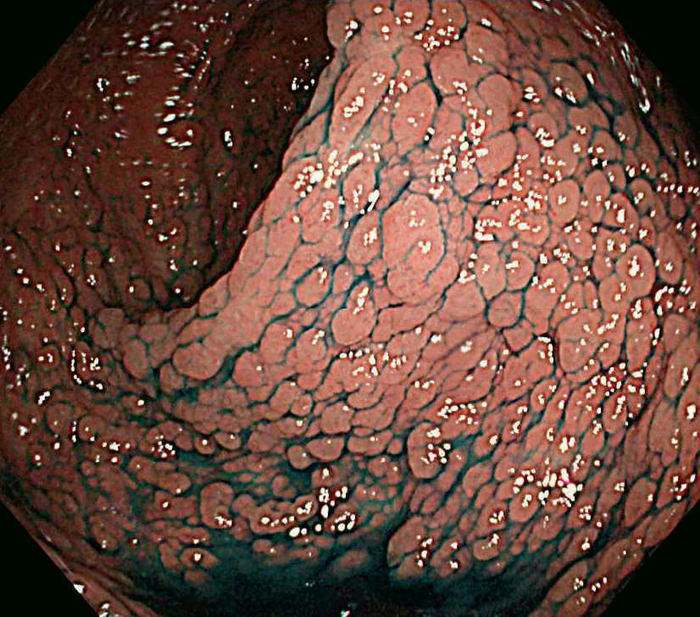
図Ⅱ-1 密生型FAP
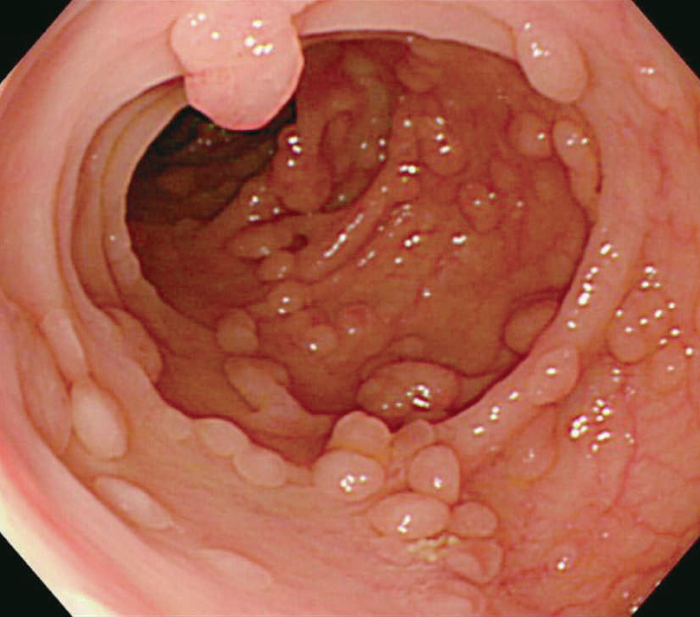
図Ⅱ-2 非密生型FAP
注1 attenuated FAP:減弱型,軽症型FAP,希薄型FAP,散発型FAPなど定訳はない。
Ⅱ-1-2 原因遺伝子と遺伝形式
APC 5q22.2 常染色体顕性遺伝(優性遺伝)- APCは5番染色体長腕(5q22.2)に位置するがん抑制遺伝子で,2,843個のアミノ酸残基からなる311.8kDの蛋白質をコードし,βカテニンやAxinなどとの結合ドメインを持つ。細胞の腫瘍化抑制におけるAPCの重要な機能は,Wntシグナル経路に関与するβカテニンの分解である。Wntシグナルがoffの時,APCやAxin,GSK3βなどで形成される複合体によってβカテニンはリン酸化され,ユビキチンが結合し,プロテアソームで分解される。一方,Wntシグナルがonの時,βカテニンは分解されなくなり,細胞質内で増加したβカテニンは核内に移行し,TCFを介して標的となる遺伝子の転写を活性化する。しかし,Wntシグナルがonの時でも,APCの病的バリアントがある場合,そのAPC遺伝子産物はβカテニンと結合することができないため,βカテニンを分解することができない。これが両アレルのAPC遺伝子産物でβカテニンの分解能が欠如すると,細胞内にβカテニンが蓄積し,Wnt標的遺伝子の転写を促進することで細胞増殖が亢進し腺腫が発生する3,4)。FAPの患者は,APCの片アレルでの生殖細胞系列病的バリアントを全ての細胞に持つため,対立アレルのAPC遺伝子に機能喪失型バリアントや欠失などの異常が起こることが腺腫の発生に繋がり,多くの腺腫が発生する5)(サイドメモⅠ-1:ヘテロ接合性の消失)。腺腫は,放置すれば,その後,KRASなどのがん遺伝子やTP53などのがん抑制遺伝子の異常が加わり,60歳頃までにほぼ全例で大腸癌が発生する。
- 腺腫密度はAPCの生殖細胞系列バリアントの部位や大腸癌発生のリスクと関連する。密生型FAPではAPCのcodon 1250~1464(特にcodon 1309)6,7),AFAPでは,APCの5’側や3’側の領域のほかに選択的スプライシング領域(バリアントにより特定のexonが転写時に読み飛ばされる領域)に生殖細胞系列バリアントが認められることが多い8)。密生型FAPではその他のFAPと比べて腺腫発生の年齢やがん化の年齢も早く,本邦の多施設共同研究では,密生型で41歳,非密生型で48歳,attenuated FAPで59歳になると半数に大腸癌の発生がみられた(図Ⅱ-3)9)。
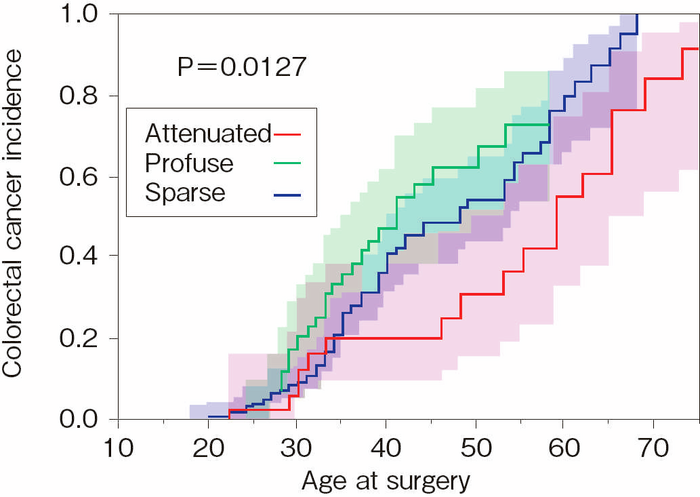
図Ⅱ-3 大腸癌の累積発生率(文献9)を改変)
Ⅱ-1-3 関連腫瘍・随伴病変(表Ⅱ-1)
- FAPには腫瘍性・非腫瘍性の関連腫瘍・随伴病変を合併する。なお,大腸外随伴病変は大腸腺腫の個数にかかわらずFAPの補助診断として有用である。

Ⅱ-1-4 疫学的特徴
- 一般集団におけるFAP患者の頻度は,欧米では1:20,000~1:10,000,本邦では1:17,400と推定される10)。また,全大腸癌患者におけるFAP患者の頻度は1%未満である11)。
- 大腸癌の発生は10歳代での報告もあるが,40歳代でほぼ50%,放置すれば60歳頃までにはほぼ100%に達する12)。
- FAPの死因13)の第1位は大腸癌で,その割合は1980年代まで約80%であったが,1990年代以降は約60%と減少傾向にある。
- 主な大腸外随伴病変(表Ⅱ-1)のうち,デスモイド腫瘍,十二指腸癌は大腸癌以外のFAPの主な死因であり,その頻度はそれぞれ約10%,約6%である13)。
Ⅱ-2 診断
Ⅱ-2-1 診断の流れ(各論Ⅰ-Ⅱ-2-1:遺伝性大腸ポリポーシス 診断の流れ参照)
- FAPは以下のSTEPにしたがって診断する。
STEP 1: 臨床情報によるリスク評価
大腸(下部消化管)内視鏡検査において10個以上のポリープを認めた場合にはSTEP 2へと進む。STEP 2: 病理組織学的および分子病理学的評価
ポリープの病理組織学的評価により腺腫性ポリープであることが確認できた場合にはSTEP 3へと進む。STEP 3: 遺伝学的検査(CQ1参照)
APC遺伝子の生殖細胞系列における病的バリアントを認めた場合にはFAPと診断する。遺伝学的検査により診断される大腸腺腫性ポリポーシスの分類を図Ⅱ-4に示す。 - 大腸腺腫性ポリポーシス患者の20%~40%ではAPC遺伝子の生殖細胞系列病的バリアントが同定されないが14-16),その原因として①体細胞APCモザイク,②APC遺伝子以外の原因遺伝子による大腸腺腫性ポリポーシス,③原因不明大腸腺腫性ポリポーシス,④解析技術の限界などがある。
- なお,大腸外随伴病変は大腸腺腫の個数にかかわらずFAPの補助診断として有用である。
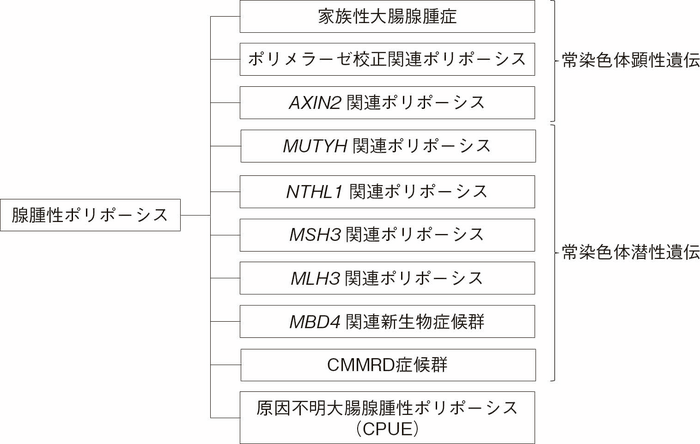
図Ⅱ-4 遺伝学的検査による大腸腺腫性ポリポーシスの分類
CMMRD:constitutional mismatch repair deficiency,CPUE:colonic adenomatous polyposis of unknown etiology
Ⅱ-2-2 鑑別を要する疾患・病態
体細胞APCモザイク(somatic APC mosaicism)
- APCの体細胞バリアントが個体発生の過程で起こった場合,APCにバリアントがある細胞とない細胞から構成されるモザイク状態となる。大腸の粘膜細胞に分化する細胞にAPC遺伝子の病的バリアントが生じるとFAP同様大腸腺腫性ポリポーシスがみられる。体細胞モザイクの程度は,APCの病的バリアントが生じたタイミングにより異なる。例えば,後腸のみにAPCの病的バリアントが生じた場合には左側結腸と直腸に大腸腺腫性ポリポーシスを認めるが,右側結腸には認めない。また,性腺に分化する中胚葉が分化する以前にAPC遺伝子の病的バリアントが生じた場合には次世代にも遺伝する可能性があるが,三胚葉の分化が完成した後の内胚葉(消化管などに分化)にAPCの病的バリアントが生じた場合には次世代に遺伝しない。APCバリアントが明らかになったFAP患者の1.6~4%にAPCモザイクが認められ,家族歴のないFAPの11~20%が体細胞APCモザイクであったと報告されている17,18)。近年,次世代シークエンサーを用いて生殖細胞系列における低頻度の病的バリアントを検出することが可能になり,通常の方法では病的バリアントが認められなかった臨床的にFAPが疑われるかCPUEと考えられる患者の25~50%に低頻度の病的バリアントが認められ,体細胞APCモザイクと診断されることがある19,20)。本邦の多施設共同研究では,大腸腺腫性ポリポーシス123例中9例(7.3%)に体細胞APCモザイクが認められた16)。このうち3例は低頻度の病的バリアントを認めたが,残り6例は2つ以上の腫瘍組織または腫瘍組織とそれに近接する正常粘膜に同じ病的バリアントを認めたことで体細胞APCモザイクと診断されている。
GAPPS(Gastric Adenocarcinoma and Proximal Polyposis of the Stomach)
- GAPPSは,胃底腺ポリポーシスを主徴とし,APCのプロモーター1B領域における生殖細胞系列の病的バリアントを原因とする常染色体顕性遺伝(優性遺伝)性疾患であり,APC関連ポリポーシスに含まれる1,2,21)。
- 胃では,APCのプロモーター1A領域は高度メチル化により不活化されており,プロモーター1B領域により制御されている。そのため,プロモーター1B領域に病的バリアントが生じると正常なAPC蛋白質の発現が消失する。一方,大腸ではAPC蛋白質の発現は主にプロモーター1A領域により制御されているため,プロモーター1B領域に病的バリアントが生じてもAPC蛋白質の発現は維持される。そのため,GAPPSは胃底腺ポリポーシスを主徴とし,大腸腺腫は目立たない2,21)。
- 胃癌の生涯発症リスクは12~25%である22)が,大腸癌の発症リスクに関する十分なデータがなく,リスク管理は家族歴をもとに考慮する。胃癌のサーベイランスは15歳より開始し,リスク低減胃全摘術は20~30歳以降に考慮する23)。大腸ポリポーシスを除外するための下部消化管内視鏡検査を考慮する。
原因不明大腸腺腫性ポリポーシス(Colonic adenomatous polyposis of unknown etiology(CPUE))
- マルチ遺伝子パネル検査(multi-gene panel testing, MGPT)による遺伝学的検査でも原因遺伝子が同定できない場合は「原因不明大腸腺腫性ポリポーシス(Colonic adenomatous polyposis of unknown etiology(CPUE))」と呼称される1)。ただし,一般的な遺伝学的検査では,体細胞モザイク16,18),遺伝子内の逆位24),転座25),エクソン-イントロン境界部位から離れたイントロンのバリアント26,27),プロモーター領域のバリアント28)などは検出できないことがある。そのため,CPUEの中には技術的な問題から原因遺伝子が同定できない症例がいることを念頭に置く必要がある。したがって,遺伝学的検査未実施の場合や,遺伝学的検査で原因遺伝子に病的バリアントを認めない場合でも,大腸に100個以上の腺腫を認める場合には,FAPに準じてサーベイランスおよび治療,血縁者への対応を行う。
他にも鑑別を要する疾患として以下のようなpolyposisが同定されている(詳細は付録Ⅱ:FAPと鑑別を要する稀な腺腫性ポリポーシス)。- MUTYH-associated polyposis(MAP)
- ポリメラーゼ校正関連ポリポーシス(polymerase proofreading-associated polyposis:PPAP)
- NTHL1-associated polyposis
- MSH3-associated polyposis
- MLH3-associated polyposis
- MBD4-associated polyposis(MBD4-associated neoplasia syndrome)
- AXIN2-associated polyposis
- CMMRD(constitutional mismatch repair deficiency)症候群
Ⅱ-3 サーベイランスと治療
Ⅱ-3-1 大腸腺腫・癌
Ⅱ-3-1-1 特徴・分類
- 腺腫密度により,密生型FAP,非密生型FAP,attenuated FAPに分類されることがある。密生型FAPと非密生型FAPをあわせて,典型的(古典的)FAPとも呼称される(Ⅱ-1-1:臨床的特徴)。
- 腺腫密度はAPCの生殖細胞系列病的バリアントの部位や大腸癌発生のリスクと関連する(Ⅱ-1-2:原因遺伝子と遺伝形式)。
- 国際遺伝性消化管癌学会(InSiGHT)は,大腸腺腫の数と大きさ(polyp burden)を用いた内視鏡的評価によるステージングを提案し(表Ⅱ-2),下部消化管内視鏡検査の間隔や手術適応の判断がpolyp burdenと強く相関することを示した29)。また,経時的にみたpolyp burdenの明らかな増加は,臨床上の手術適応の判断基準として用いられている30)。評価者によるpolyp burdenの一致率は十分とは言えないものの,polyp burdenは下部消化管内視鏡検査の間隔や手術適応を決定し,明らかに増加する場合は,手術を考慮することが提案されている。

Ⅱ-3-1-2 サーベイランスと発がん予防
Ⅱ-3-1-2-1 サーベイランス
- FAPに対する下部消化管サーベイランスについて,古典的FAPでは10歳を過ぎた頃から1~2年間隔で,AFAPでは10歳代後半(18~20歳)から2~3年間隔で行うことを推奨する。下部消化管サーベイランスを開始する年齢は,遺伝学的にFAPと診断された症例も遺伝学的検査未施行例も同様に考慮する。
- 欧州のグループが20歳以下のFAP患者における大腸癌発生を解析したところ,大腸癌の発生は10歳以前では認められず,11~15歳の間で0.2%に認められた11)。そのため,FAP患者の下部消化管サーベイランス開始の推奨年齢は10歳を過ぎた頃から考慮する2)。しかし,密生型FAPでは10歳未満でも大腸癌が発生することがある31)ため注意を要する。
- AFAPでは,古典的FAPと比較して大腸癌の発生年齢は10~15年遅く32),30歳未満での大腸癌の発生も稀であることから33),10歳代後半(18~20歳)より下部消化管のサーベイランスを開始する2)。
- 遺伝学的検査未施行例において,大腸内視鏡検査で大腸腺腫が認められなければ検査間隔を伸ばして,サーベイランス中に複数回大腸腺腫を認めない場合,臨床判断に基づいてさらに間隔を延長する1)。
Ⅱ-3-1-2-2 化学予防
- サーベイランス中に,ポリープの増加・増大を抑制する目的で化学予防として非ステロイド性抗炎症剤(NSAIDs)が試みられているが,発がん予防効果や長期投与のエビデンスは十分ではなく,その有用性は明らかではない(CQ2)。
Ⅱ-3-1-3 治療
Ⅱ-3-1-3-1 内視鏡治療
- Ⅱ-3-1-3-2の外科治療の項にあるように,大腸癌による癌死を回避できる確実な治療法は大腸癌発生前に大腸切除を行う予防的大腸切除であるが,近年の大腸内視鏡治療手技の進歩により,安全に多数の大腸ポリープを摘除することができるようになったため,非密生型で手術拒否された症例について,多数の大腸ポリープを内視鏡的に摘除しつつ経過観察を行う研究が試みられた34)。この報告では,内視鏡治療における穿孔や重篤な出血は認められず,経過観察中に進行癌の発生も認めなかった。本研究は,単施設で行われたものであり,その後安全性と有効性をみる探索的臨床第Ⅰ・Ⅱ相試験(J-FAPP Study Ⅲ)が多施設共同前向き研究として実施された35)。10mm以上の全腺腫の摘除が確認されるまで大腸内視鏡検査を実施し,その後に5mm以上の腺腫も摘除し,可能であればそれ以下のサイズの腺腫も摘除した。介入期間の大腸手術の有無をエンドポイントとし最終的に大腸未切除群の90.4%,大腸切除群の83.9%が介入を完遂した。
- その結果を受け,令和4年度(2022年4月1日)からの診療報酬改定において,FAPに関係する改定が行われFAP患者に対する積極的大腸ポリープ切除術(intensive downstaging polypectomy:IDP)に対して,年に1回5,000点加算が認められた。20歳頃に大腸全摘するしか大腸癌予防の治療法がなかったFAPにおいて,内視鏡的にポリープを積極的に摘除する治療法(IDP)が今回の改定で認められたことになり,今後,本治療法の技術をもつ施設では実臨床としてIDPを受けることができることになった。
FAPにおける大腸癌予防のための大腸ポリープの内視鏡的摘除
- 令和4年(2022年)の診療報酬改訂により,消化管ポリポーシスのうち,家族性大腸腺腫症については,放置するとほぼ確実に大腸癌を発症することを踏まえ,内視鏡により大腸ポリープを積極的に摘除した場合の評価が新設され,K71:内視鏡的大腸ポリープ・粘膜切除術に対して,「家族性大腸腺腫症の患者に対して実施した場合は,消化管ポリポーシス加算として,年1回に限り5,000点を所定点数に加算する。」が追加された。なお,上記に規定する消化管ポリポーシス加算は,以下のいずれも満たす家族性大腸腺腫症患者に対して内視鏡的大腸ポリープ・粘膜切除術を行った場合,年1回に限り算定できる。
(ア) 16歳以上であること。 (イ) 大腸に腺腫が100個以上あること。なお,手術又は内視鏡により摘除された大腸の腺腫の数を合算しても差し支えない。 (ウ) 大腸切除の手術が実施された場合においては,大腸が10cm以上残存していること。 (エ) 大腸の三分の一以上が密生型ではないこと。なお,密生型とは,大腸内視鏡所見において,十分に進展させた大腸粘膜を観察し,正常粘膜よりも腺腫の占拠面積が大きい場合をいう。
Ⅱ-3-1-3-2 外科治療
- 大腸癌による癌死を回避できる確実な治療法は大腸癌発生前に大腸切除を行う予防的大腸切除である。
- 主な術式として(サイドメモⅡ-3:術式の名称)
がある(図Ⅱ-5,表Ⅱ-3)。(1) 大腸全摘・回腸人工肛門造設術(TPC) (2) 大腸全摘・回腸囊肛門(管)吻合術(IPAA) (3) 結腸全摘・回腸直腸吻合術(IRA) - 予防的大腸切除の時期については,①累積大腸癌有病率13),②腺腫密度36),③腺腫の大きさと形態,④その家系員の死亡年齢,癌発生年齢,およびデスモイド腫瘍発生状況37),⑤APC遺伝子変異部位38,39),⑥患者の就学,就職などの環境40),⑦回腸囊肛門(管)吻合術後の妊孕性41)や男性性機能障害42),⑧下痢,腹痛,下血などの消化管症状,および⑨腫瘍の病理組織所見,などを総合的に考慮して決定する。大腸癌の有病率の点から,典型的FAPでは早ければ10歳代後期から,多くは20歳代に手術を受けることが推奨されている43,44)。APCの病的バリアント部位の確定しているFAP症例に対する本邦での解析により,古典的FAPのgenotype群では34歳を,AFAP(減弱型FAP)にlinkするgenotype群では49歳を越えると急激にStage Ⅱ以上の大腸癌の発症リスクが高まることが報告された39)。予防的大腸切除の施行時期を検討するためにも,遺伝学的検査による病的バリアント部位の同定が参考となる。
- 現在では大腸全摘・回腸囊肛門(管)吻合術が標準的術式と考えられ,施行される割合も多く45-48),また腹腔鏡下手術の割合が増加している47-52)。なお,IPAA時の一時的回腸人工肛門造設の併施については,そのメリット,デメリットのバランスを考慮した上で,個別に対応するのが現実的である。
- 予防的大腸切除時に腸間膜内にデスモイド腫瘍を認める場合には,デスモイド腫瘍の再発・増大や技術的な問題からIPAAは一般的に推奨されないが,一定の条件のもとでは許容される。(Ⅱ-3-4:デスモイド腫瘍)なお,特にIRAでは腹腔鏡下手術のほうが,術後デスモイド腫瘍の発生が少ないという報告がある53,54)。
- 女性のFAPに対する大腸全摘術は妊孕性が低下する可能性がある(サイドメモⅡ-4:手術と妊孕性・妊娠・出産)。
- なお,進行大腸癌を契機に発見されたFAPに対する術式は,大腸癌の進行度,部位などを考慮して総合的に決定する。治癒切除が見込める場合には領域リンパ節郭清を含む大腸全摘術や結腸全摘術も選択肢となる。切除不能進行大腸癌や転移巣への対処や薬物療法については,「大腸癌治療ガイドライン」に基づき,散発性大腸癌と同様に対応する。
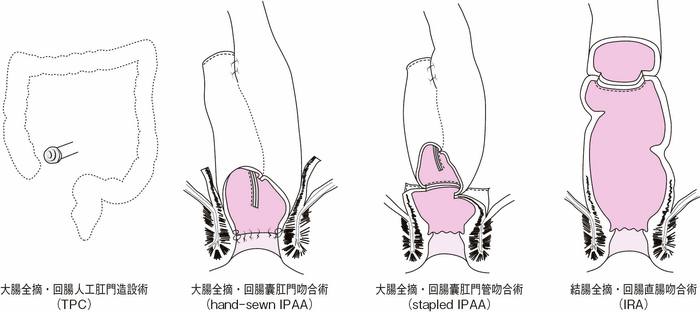
図Ⅱ-5 FAPに対する術式

サイドメモⅡ-3
■術式の名称
本邦では回腸囊肛門管吻合術をileoanal canal anastomosis(IACA)と呼称することが多いが,欧米では回腸囊肛門吻合術と回腸囊肛門管吻合術を区別せずに一括してileal pouch-anal anastomosis(IPAA)と呼ぶことが多い。また,回腸囊肛門吻合術をhand-sewn IPAA,回腸囊肛門管吻合術をstapled IPAAと呼ぶこともある。回腸直腸吻合術(ileorectal anastomosis:IRA)の吻合部の高さ(残存直腸の長さ)には明確な定義はなく,結腸全摘術も結腸亜全摘術も同義として扱われる。なお,大腸全摘・回腸人工肛門造設術はtotal proctocolectomy(TPC)と呼称されることが多い。
サイドメモⅡ-4
■手術と妊孕性・妊娠・出産
デンマークの女性FAP患者58名を対象とした研究55)では,妊孕性は90%で,一般集団と同等であった。162名のヨーロッパの女性FAP患者を対象とした研究では,手術を受けていないFAP患者の妊孕性は一般集団と同等であった。また,IRAを受けた患者の妊孕性も一般集団と同等であったが,IPAAを受けた患者では妊孕率が0.46倍に低下していた41)。一方,オランダのFAP患者138例を対象とした研究では,妊孕性は術式とは関連がなく,初回手術の年齢と関連があると報告されている56)。
IPAA後の妊孕性低下の原因としては,術後の癒着が考えられている。海外の報告57)では大腸全摘後に子宮・卵管造影を行い,卵管の骨盤壁への癒着を48%に,片側閉塞を43%に,両側閉塞を10%に認めた。
FAPと潰瘍性大腸炎の患者を含めた検討では,腹腔鏡によるIPAAは,開腹手術よりも妊孕性が有意に高かったと報告されている58)。FAPを対象とした検討でも,腹腔鏡手術は術後腸閉塞が少なく,さらに女性では術後妊孕性の低下が少ないと報告されている49)。しかし,FAP患者を対象とした前向きの検討はない。また,IPAA後の妊娠・経腟分娩は安全であると報告されているが59,60),IPAA後の経腟分娩では会陰切開後の肛門括約筋の損傷と骨盤底筋の神経損傷を考慮する必要がある。
Ⅱ-3-1-4 大腸術後下部消化管サーベイランス
- 回腸直腸吻合術(IRA)後には,残存直腸の癌発生に対する内視鏡を含む長期間のサーベイランスが必要である。(サイドメモⅡ-5:結腸全摘・回腸直腸吻合術(IRA)後の直腸癌の発生リスク)回腸囊肛門管吻合術(stapled IPAA)後には通常直腸粘膜が2~3cm残存し,回腸囊肛門吻合(hand-sewn IPAA)後でもわずかに直腸粘膜が残存する可能性がある。したがって,stapled IPAA,hand-sewn IPAAのいずれにおいても,残存直腸粘膜に対する長期間のサーベイランスが必要である。IPAA後の回腸囊内の腺腫発生頻度は6.7~74%と報告されている61-64)。また,癌が発生することも報告されているため65,66),長期間のサーベイランスが必要である。FAPに対するIPAA後の回腸囊炎はおよそ5%の患者に発生するが,潰瘍性大腸炎の術後よりも頻度は低い67)。臨床症状として,発熱,下痢,貧血が認められ,このような症状が出現したら,すみやかに大腸内視鏡検査を行う。進行大腸癌合併例で治癒切除が行われた場合には,散発性大腸癌と同様に再発に対するサーベイランスを行う。
サイドメモⅡ-5
■結腸全摘・回直腸吻合術(IRA)後の直腸癌の発生リスク
IRA後の長期観察では24~43%に残存直腸に癌が発生する68,69)。IRA後20年までの経過で直腸を切除する必要があったのは,AFAPで10%,非密生型FAPで39%,密生型FAPで61%であった70)。外科技術の進歩とともにIPAAの割合が多くなっていること45-47),直腸癌の危険因子をより多く持つ症例にIPAAが選択されることにより,IRA後の直腸切除率も40%から13%に減少し,IRA後の残存直腸癌の累積発生率も減少している49,71,72)。なお,Ⅱ-3-2以降で述べる大腸外随伴病変で治療が必要な病態は大腸切除後に発生することが多い。大腸切除後の残存直腸と大腸外随伴病変に対するサーベイランスについて,表Ⅱ-4のような方法が提唱されている。

Ⅱ-3-2 胃底腺ポリポーシス・胃腺腫
Ⅱ-3-2-1 特徴・分類
- 胃底腺ポリポーシス(図Ⅱ-6)は健常人にみられる胃底腺ポリープとは数や大きさが異なり特徴的で,FAP症例の88%にみられ73),補助診断として参考になる。
- FAP患者において,Helicobacter pylori非感染者に胃底腺ポリポーシスが多い傾向がある73)。
- 胃底腺ポリポーシスの中に腺腫(図Ⅱ-7),および癌が発生しうる。
- 胃底腺ポリポーシス,胃腺腫とAPCの遺伝型の関連は明らかでない74)。
- FAP患者に発生する胃の腫瘍性病変は,肉眼形態,局在,色調で分類されると報告されている75)。
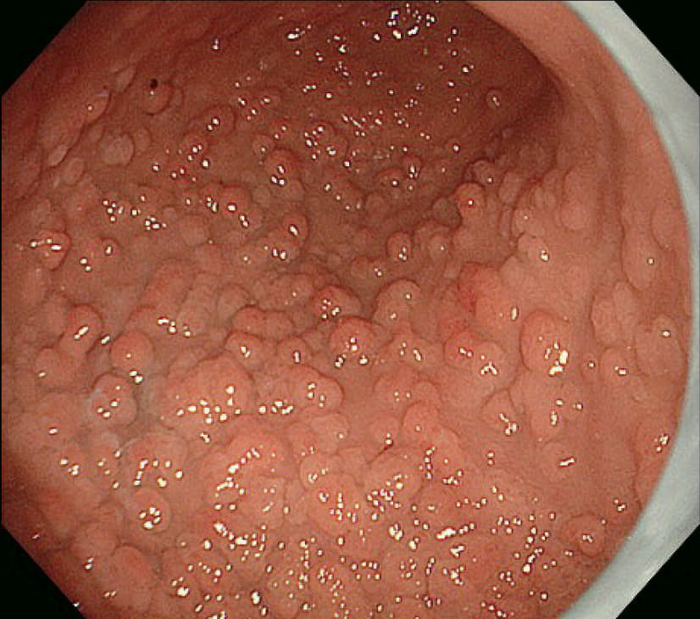
図Ⅱ-6 胃底腺ポリポーシス
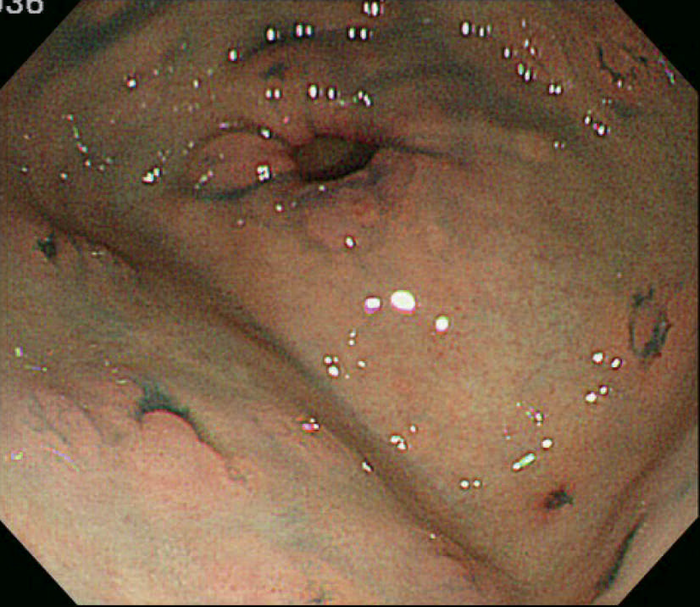
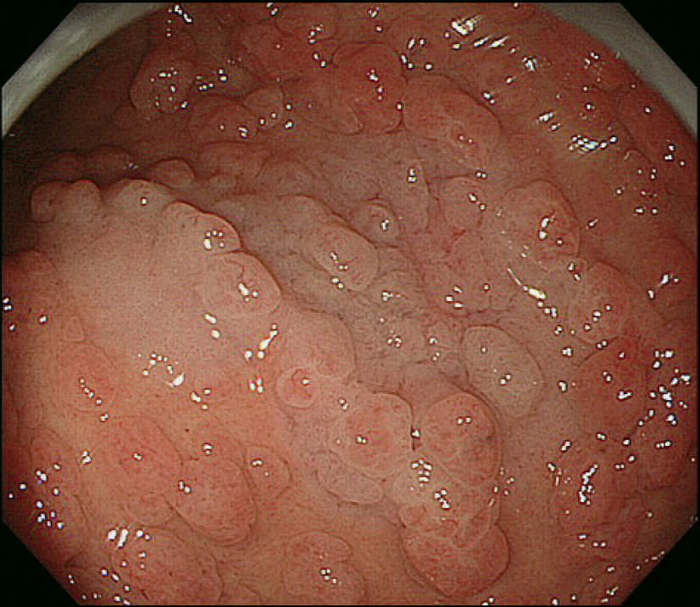
図Ⅱ-7 胃腺腫(左:陥凹型,右:表面隆起型)
Ⅱ-3-2-2 サーベイランス
- 胃底腺ポリポーシスの中に腺腫や癌といった腫瘍性病変が発生するため,サーベイランスが必要である。
- 低異型度の異形成病変は多く発生するものの,高異型度の異形成病変が発生する頻度は多くはないとされている73,76)。またさらに頻度は高くないものの胃癌が合併した報告もある77)。
- サーベイランス開始時期,頻度については基本的により頻度の高い十二指腸病変の程度(Spigelman病期分類)に準ずる。
- アジアでは欧米より腫瘍性病変の発生頻度が高いと報告されており73,76,78-80),また存在診断が難しい病変もあるため78),1~2年に一度程度の上部消化管内視鏡検査も考慮できる。特にびまん性(カーペット状)のポリポーシス,大きな隆起を伴う病変では注意深いサーベイランスが求められる。
Ⅱ-3-2-3 治療
- 胃底腺ポリポーシス自体に対する積極的な治療は不要である。
- 胃腺腫に対する内視鏡治療に関する定まった見解はないが,低異型度腺腫全てを治療適応とする必要はない。一般的には10mm以上の腫瘍性病変,もしくは高異型度腺腫は治療の適応と考えることが多い1)。
Ⅱ-3-3 十二指腸腺腫・癌
Ⅱ-3-3-1 特徴・分類
- 十二指腸腺腫(図Ⅱ-8),乳頭部腺腫は健常人には稀にしか発見されず,特に多発する十二指腸腺腫は特徴的であり,FAPの補助診断として参考になる。
- 十二指腸腺腫はFAP患者の30~90%に認められ81-83),腺腫有病率は40歳以降高くなる82,83)。
- 大腸癌研究会の多施設共同研究によれば,十二指腸腺腫の50歳までの累積発生率は39.2%で,古典的FAPはAFAPと比較して有意に累積発生率が高かった(42.5% vs. 23.5%)84)。
- 乳頭部腫瘍は多いものでは72%の症例に認める85)。
- 十二指腸病変の観察には,直視内視鏡に加え,乳頭部の観察のために斜視内視鏡を用いる。
- 十二指腸腺腫,乳頭部腫瘍とAPCの遺伝型の関連は明らかでない74)。
- Spigelman分類は検査者間,検査者内で再現性がある86)。
- 十二指腸癌は,FAP患者の死因の約3%を占め,予防的大腸全摘後の主な死因の一つである13,87)。
- 十二指腸癌に関するFAP患者の一般集団に対する相対リスクは250~330.8倍であり88,89),十二指腸癌の累積発生率は4~10%程度11,90,91)と見積もられている。
〔分類〕
- 十二指腸腺腫の臨床病理学的分類としてSpigelman分類がある79)。
- Spigelman分類は,内視鏡検査で十二指腸腺腫の個数,最大径を評価し,さらに腺腫の組織像(図Ⅱ-9)について,細胞構造と異型度を評価する。現在では若干の修正(修正Spigelman分類)が加えられている92)(図Ⅱ-10)。
- 狭帯域光観察(narrow-band imaging:NBI)の使用により十二指腸腺腫の同定数は増えるが,Spigelman分類には影響を与えない93)。
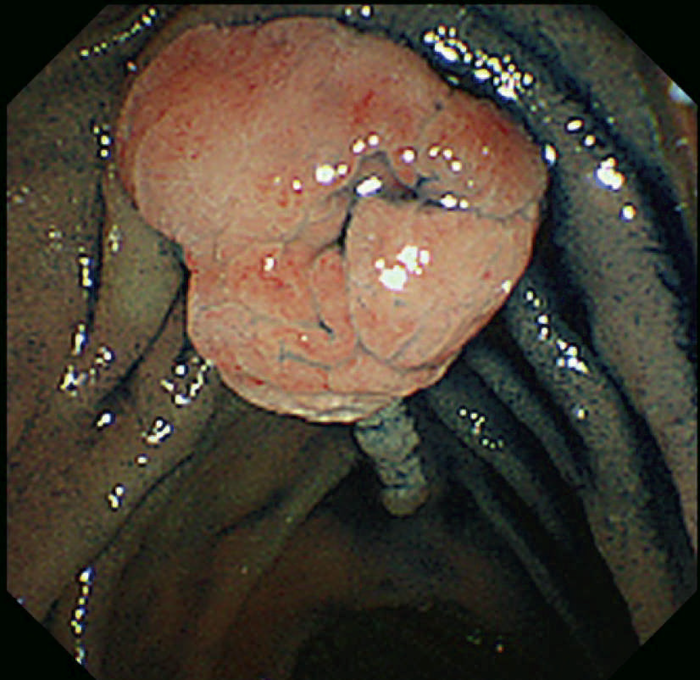
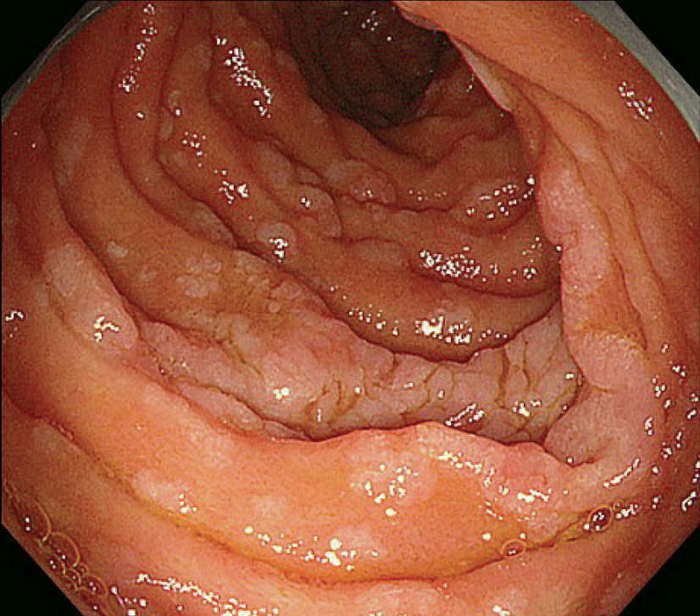
図Ⅱ-8 十二指腸乳頭部腺腫(左)および多発十二指腸腺腫(右)
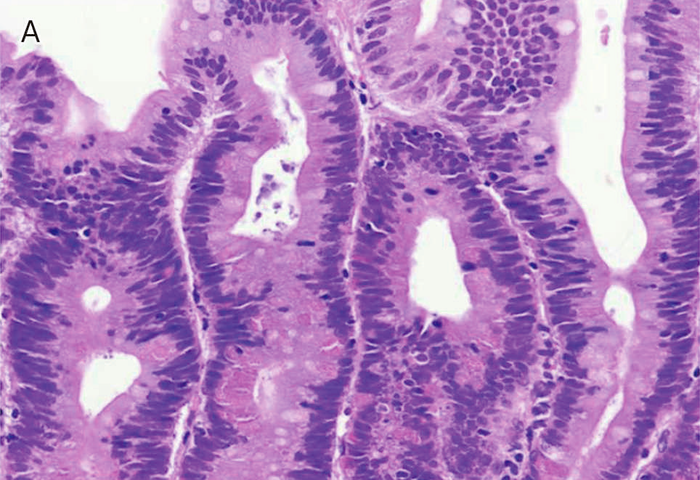

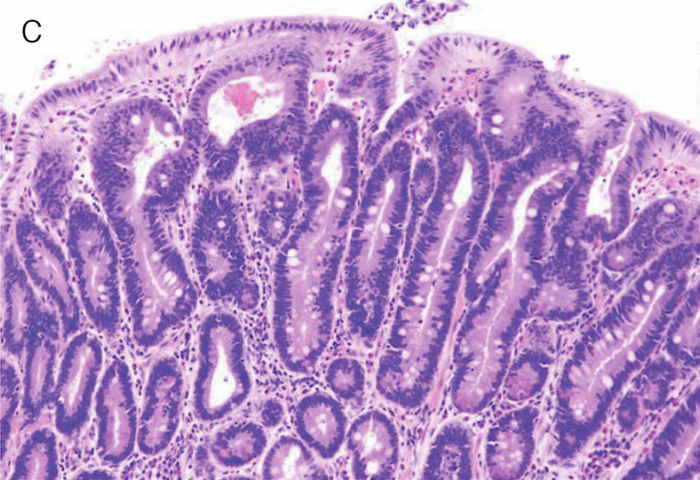
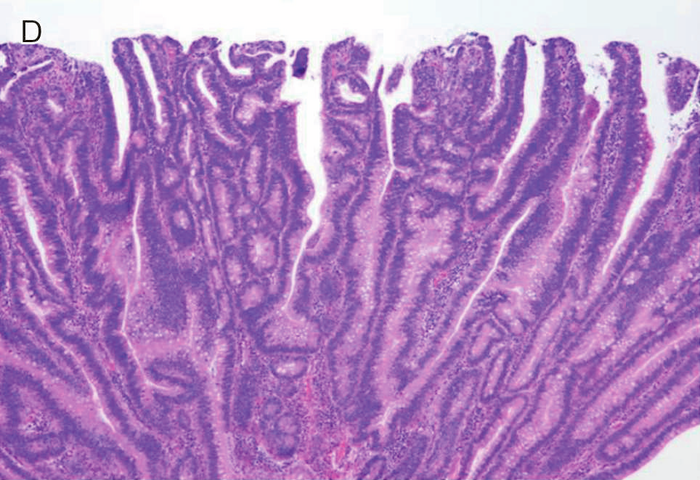
図Ⅱ-9 FAPに合併する十二指腸腺腫の組織像
| A: | 低異型度腺腫(low-grade adenoma):腫瘍腺管は比較的整然と配列する。小型紡錘形の核が基底側に配列している。 |
| B: | 粘膜内癌:腫瘍腺管は不規則さを増し,核の重層化が目立つとともに核小体もしばしば認められる。Spigelman分類でhigh-grade adenomaとされる病変には,日本の診断基準で非浸潤性の粘膜内癌に相当する病変が含まれる。 |
| C: | 管状腺腫(tubular adenoma):単純な腺管状の増殖を示す。 |
| D: | 管状絨毛腺腫(tubulo-villous adenoma):狭小な間質を伴った絨毛状構造の混在を認める。 |
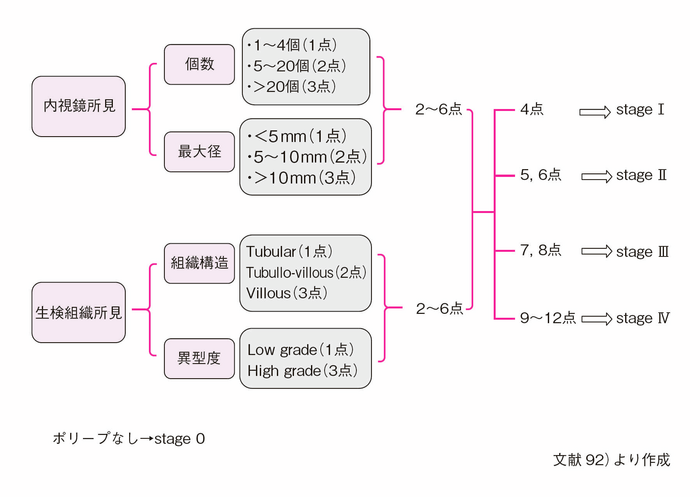
図Ⅱ-10 修正Spigelman分類92)による十二指腸腺腫の評価法
Ⅱ-3-3-2 サーベイランス
- 十二指腸腺腫の発育は緩徐だが82,94,95),増悪,および癌化のリスクがあるため定期的な内視鏡サーベイランスが必要である(CQ3)。
- 一般的には20~25歳程度より開始し,Spigelman Stage 0では4~5年ごと,Stage Ⅰは2~5年ごと,Stage Ⅱでは2~3年ごと,Stage Ⅲでは6カ月~2年ごとに行うことが推奨されてきた83)。ただし,見逃し病変がありうることや,胃底腺ポリポーシス,胃腺腫の発生状況などを考慮し,年に一度から3年に一度程度の内視鏡検査も考慮できる。
- 乳頭部からの生検は膵炎のリスクが低く安全に実施可能であり,内視鏡的に異常所見のない乳頭からの生検でSpigelman病期を上昇させる可能性がある96)。しかし一般的には乳頭部腫瘍の進行は緩徐と報告されており,内視鏡上異常所見を認めない乳頭が早期に臨床的に意義のある病変に進行するとは考えにくく,異常所見を認めない乳頭からのルーチンの生検は不要である90)。
Ⅱ-3-3-3 治療(CQ3)
- 修正Spigelman分類に準じた十二指腸腺腫への対応の目安を図Ⅱ-11に示す。
- 十二指腸腺腫に対する内視鏡治療にはスネアによる切除,アルゴンプラズマ凝固などが行われている85)が,近年,新しい治療手技(バイポーラースネアによる切除,コールドポリペクトミー,Underwater EMR)の安全性,有用性について報告があり,治療の選択肢が広がっている97-100)。
- Spigelman Stage Ⅱ/Ⅲに対する内視鏡的完全切除は合併症が多く,50~100%の再発割合が報告されてきたが83),近年は内視鏡切除技術の向上や新規治療が導入されたことにより,内視鏡切除の安全性,有用性についても報告が増えている97-101)。
- システマティックレビューにて非乳頭部十二指腸癌発生のリスクとして修正Spigelman分類ステージⅣが挙げられている102)。Spigelman分類ごとの十二指腸癌発生頻度がStageⅡ,Ⅲでそれぞれ2.3%,2.4%103)であるのに比べ,Stage Ⅳでは7~36%90,103)と高く,手術適応の評価あるいは6~12カ月毎の専門家によるサーベイランスが推奨される。近年は内視鏡治療によるダウンステージも報告されているが,長期予後のデータは不十分であり自然史を変えるほどの効果があるかは不明である80,85,104,105)(CQ3)。
- 癌合併例(Stage Ⅴ)に対する手術としては膵頭十二指腸切除術が標準的術式ではあるが,予防的意味合いの強いStage Ⅳに対してはより低侵襲で腸管再建方法が術後内視鏡サーベイランスの障壁とならない膵温存十二指腸切除術106-108)が選択される。
- 乳頭部腫瘍は1cm以上の病変や,管状絨毛腺腫や高異型度腺腫といったいわゆるadvanced histology病変,肝機能障害や膵炎などの閉塞に伴う症状がある場合に治療を考慮するべきであり,専門施設での内視鏡的乳頭切除術の実施をまず検討する109)。
- 内視鏡的乳頭切除術は10%程度の有害事象,28%の遺残,17%の再発が報告されており,慎重な症例選択と十分なサーベイランスが必要である109)。
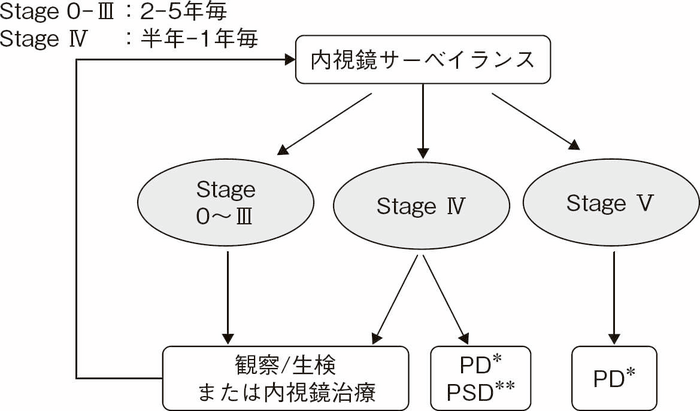
図Ⅱ-11 修正Spigelman分類に基づいた十二指腸腺腫のサーベイランス・治療方針
*PD:Pancreaticoduodenectomy(膵頭十二指腸切除術)
**PSD:Pancreas sparing duodenectomy(膵温存十二指腸切除術)
Ⅱ-3-4 デスモイド腫瘍
Ⅱ-3-4-1 特徴・分類
〔特徴・分類〕
- デスモイド腫瘍(図Ⅱ-12)は,FAP患者の8~20%に認められ37,110-112),線維腫の一種で,転移はしないが浸潤性に発育する傾向がある。
- 腹腔内デスモイド,腹腔外デスモイド,混在型に分類され,腹腔内デスモイド腫瘍がデスモイド腫瘍全体の70%を占める113)。大腸切除後(特に2~3年以内)の腹壁・腸間膜あるいは後腹膜に発生することが多い61,114,115)。
- 本邦のデータでも発生率が10~15%で,腹腔内デスモイド腫瘍がデスモイド腫瘍全体の71.8~80%であり,年齢が30歳以下,性別では女性に有意に多く認められ,女性の場合,約2/3が1年以内に発症している115,116)。
- FAPに認められるデスモイド腫瘍は,散発性のデスモイド腫瘍とは,発生のメカニズムや発生部位などの臨床的特徴が異なり117,118),FAPの補助診断として参考になる。
- 自然消退ないし安定化することがある119-121)。
- 腹腔内(後腹膜を含む)に発生した場合には,消化管通過障害,穿孔,膿瘍,あるいは尿管閉塞などの原因となり,しばしば治療に難渋する。
- 本邦の多施設共同研究からのデータでは,腹腔鏡手術と開腹手術によるデスモイド発生リスクに差は認めなかった47,48)。
- 従来,術式別のデスモイド腫瘍発生リスクには差がないとの報告に対して,本邦からのデータを含む最近の2つの報告では,大腸全摘術(IPAA)の方が部分切除(IRA)よりもデスモイドの発生リスクが高かった115,122)。
- デスモイド腫瘍が発生した場合の死亡率は0~14%と考えられる61,110,112,119)。
- これまでにデスモイド腫瘍の発生とAPC遺伝子の病的バリアントの相関性についてはAPCのcodon 1,444よりも3’側または1,445~1,580における病的バリアントに相関性を認めるという報告があるが123,124),Churchらの報告ではcodon 1,399よりも3’側に病的バリアントを持つ症例に高い罹患率を認め,症状が強く致死的な傾向を認めたものの,APCのバリアント部位とデスモイド腫瘍の発生との間に相関性は認めなかった125)。AFAPにおけるデスモイドは3’側病的バリアントとの相関性を認めるという報告がある1,5)。
〔Churchの分類〕
- Churchら126)の分類を参考にして作成した腹腔内デスモイド腫瘍の病期分類を表Ⅱ-5に示す。なお,この分類では増大傾向を評価する必要があり,前向きの評価では6カ月間の経過観察が必要であり,後ろ向きの評価では増大傾向に関する正確なデータが得られない場合がある。
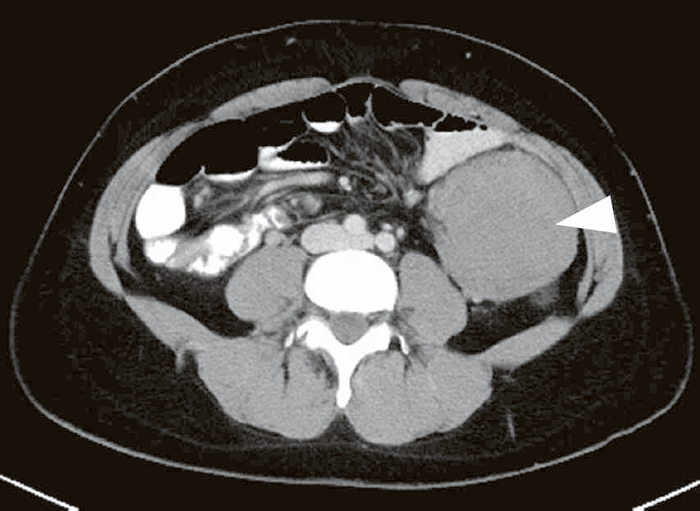
図Ⅱ-12 腹腔内デスモイド腫瘍(▽)

〔本邦で提唱された石田らの新分類〕
- FAPに合併するデスモイド腫瘍が腹腔外(大部分は腹壁)の場合は一般的に“wait and see”もしくは外科的切除が選択され,予後も良好であるが,腹腔内の場合は原則的に非観血的治療が選択されるものの,腫瘍の増大・進展による臓器障害(尿路・腸管)のため,QOLの低下・重症化による予後不良な転帰に至る場合がある。以上を考慮し,本邦でデスモイド腫瘍に関するその存在部位・腫瘍径・QOL低下の要因となる臓器障害(運動制限・尿路通過障害・腸管通過障害),さらには合併症(膿瘍・瘻孔形成・腹壁哆開)の有無を加味した新分類が提案された127,128)(表Ⅱ-6)。この新分類は,臨床経過のどのtime pointにおいても評価でき,Church分類と異なる点である。

Ⅱ-3-4-2 サーベイランス(CQ4)
- 進行したデスモイド腫瘍は,治療や遠隔成績に影響を与えるためサーベイランスによる早期の診断が重要である126)。
- デスモイド腫瘍は大腸切除後2~3年以内に,腹壁や腸間膜,後腹膜に発生することが多く61,114,115),この期間内は臨床症状(腹痛,腹満,腫瘤,消化管通過障害など)に注意し,6カ月ごとの腹部触診,1年ごとの画像診断(腹部および骨盤の造影CT検査あるいはMRI検査)を検討する。
- 特にデスモイド腫瘍の既往歴・家族歴を有する場合は,定期的な腹部および骨盤の造影CT検査またはMRI検査を行う1)。
Ⅱ-3-4-3 治療
- サーベイランス中発見された腹腔内デスモイド腫瘍は,Churchの分類125,126)を参考にして治療方針を検討する。腹腔外(大部分が腹壁)デスモイド腫瘍については,症状や日常生活への影響を考慮し治療方針を検討する。
〔薬物療法〕
- FAP患者に生じるデスモイド腫瘍を特異的に対象とした薬物療法のエビデンスはほとんどない。デスモイド腫瘍に関する臨床試験の中にFAP患者も含まれているものがあるため,一般的なデスモイド腫瘍に準じて考えられる129)。
1.抗エストロゲン薬,NSAIDs
- デスモイド腫瘍にエストロゲン受容体あるいはCOX2の発現が高いことなどから抗エストロゲン薬(タモキシフェン,ラロキシフェン,トレミフェンなど)や非ステロイド抗炎症剤(NSAIDs)(スリンダク,インドメタシンなど)が試されてきたが,多くは後方視的解析である。抗エストロゲン薬に関するシステマティックレビューでは,奏効割合51%であり,抗エストロゲン薬単剤とNSAIDs併用の有効性,安全性に有意差はなく,FAP患者(91名)と散発性群(50名)の比較においても,奏効割合(51% vs. 48%),病勢制御割合(78% vs. 86%)に有意差はなかった130)。唯一の前向き第Ⅱ相試験は小児(20%がFAP患者)を対象としたスリンダクとタモキシフェンの併用療法の解析であり,奏効割合8%,2年無増悪生存率が36%と後方視的報告よりも低く,評価が難しい131)。
2.分子標的薬
- チロシンキナーゼ阻害薬であるイマチニブの前向き第Ⅱ相試験がいくつかあり,奏効割合(6~19%)の割には,高い病勢制御割合(84~91%)が示されている132-135)。マルチキナーゼ阻害薬であるソラフェニブにはプラセボを対象としたランダム化比較試験があり,ソラフェニブ群ではプラセボ群に対して有意に無増悪生存期間中央値の延長(未到達vs. 11.3カ月,ハザード比0.13,p<0.001)を認め,奏効割合(33% vs. 20%)も良好であった136)。マルチキナーゼ阻害薬のパゾパニブと経口メトトレキサート+ビンブラスチンを比較したランダム化第Ⅱ相試験(DESMOPAZ試験)において,パゾパニブ群は経口メトトレキサート+ビンブラスチン群に比べ奏効割合(37% vs. 25%),1年無増悪生存率(86% vs. 67%)ともに良好な結果であった137)。
3.細胞障害性抗がん薬
- 細胞障害性抗がん薬に関する報告の多くは後方視的であるが,システマティックレビューでは低用量のメトトレキサート+ビンカアルカロイド(ビンブラスチンまたはビノレルビン)の奏効割合は11~82%,病勢制御割合は71~100%,通常量のアントラサイクリン系治療の奏効割合は33~100%,病勢制御割合は89~100%であった138)。メトトレキサート+ビンブラスチン療法には前向き第Ⅱ相試験があり,奏効割合は35~40%とされている139,140)。FAP患者のデスモイド腫瘍に対しドキソルビシン+ダカルバジン,低用量メトトレキサート+ビンカアルカロイドの有効性を示した後方視的報告(それぞれ奏効割合63.6%,40.3%)がある141,142)。
4.γ-secretase阻害剤
- 2023年11月,FDAは全身治療を必要とする進行性デスモイド腫瘍の成人患者に対しnirogacestatを承認した。nirogacestatはNOTCH受容体のγ-secretaseを阻害し抗腫瘍効果を示す。DeFi試験はnirogacestatのデスモイド腫瘍に対する有効性を確認するランダム化第三相試験であり,nirogacestat投与群はプラセボ投与群と比較して無増悪生存期間の有意な延長がみられた(HR:0.29)。FAPの家族歴のある者に限ったサブグループ解析では症例数が少なく,両群の無増悪生存期間に有意差は認められていないものの,プラセボが投与された13例中8例に増悪がみられたのに対し,nirogacestatが投与された11例では増悪がみられたのは2例に留まっていた(2024年1月現在,本邦においてnirogacestatの承認申請は行われていない)。
- デスモイド腫瘍は希少疾患のため,ランダム化比較試験が困難であり標準治療が確立していないのが現状である。上記の抗エストロゲン薬,分子標的薬・細胞障害性抗がん薬,γ-secretase阻害剤はいずれも保険適用外である。なお,上記薬剤のうち,分子標的薬であるパゾパニブと細胞障害性抗がん薬であるドキソルビシンは悪性軟部腫瘍に対する保険適用はある。
〔手術〕
- 腹腔内デスモイド腫瘍は,完全切除しても10~68%に再発がみられることや111),5~33%が自然消退すること119-121),手術侵襲の大きさ143)などから,安易な外科的治療は慎み腸閉塞などの症状があるものに限定すべきである144)。症状のないものはChurchの分類125,126)を参考に,経過観察145)や薬物療法が推奨される。腹腔外(大部分が腹壁)デスモイド腫瘍についても原則的に経過観察を行うが,運動制限等,生活の質に影響する場合には手術も考慮される。
- 再発の原因として,不完全切除だけでなく,切除創部に新たに発生する場合も考えられるので,切除する場合でも腫瘍辺縁の過剰な切除は控える146)。
- 腹腔内デスモイド腫瘍による消化管通過障害には手術が考慮されるが,切除困難あるいは腸管大量切除が必要になることがある143,147)。
- 完全切除例とバイパスを含む非切除例との間で生存率に差はないとする報告がある148)。
- 本邦でのデータでは,腹腔外,腹腔内,混合性に対する治療は86%,48%,71%の症例で外科的切除が行われており,完全切除は腹腔外で91%に対し腹腔内では46.7%であった149)。
- 本邦での26例の解析では,病期Ⅰでは手術をせずに非ステロイド性抗炎症剤(NSAIDs)(主にスリンダク)や化学療法が多い傾向にあり,病期Ⅲになると手術が62.5%の症例に施行されており,他にもNSAIDs(主にスリンダク),ホルモン治療,化学療法が高頻度で行われていた。
- 前向きな検討は行われていないが,病期Ⅰでは経過観察またはNSAIDs,病期Ⅱでは可能であれば手術およびNSAIDs+タモキシフェン,病期Ⅲでは化学療法±NSAIDs±タモキシフェン,病期Ⅳでは化学療法やバイパス手術などが選択肢となる。病期Ⅰ/Ⅱでは死亡例はなく,病期Ⅲ/Ⅳの死亡率はそれぞれ15%,44%と報告されている(図Ⅱ-13)。尿管閉塞にはステント留置が推奨される126,150)。
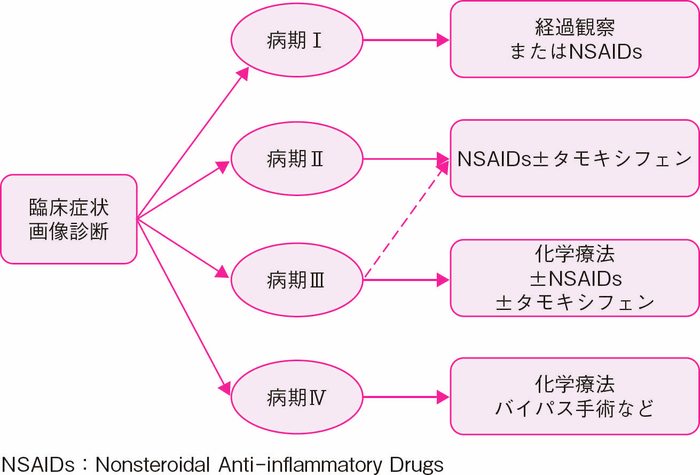
図Ⅱ-13 腹腔内デスモイド腫瘍の病期分類と治療方針
Ⅱ-3-4-4 術後サーベイランス
- デスモイド(特に腹腔内デスモイド)腫瘍に対しては,可能であれば外科治療を回避すべきであるが,やむなく手術が行われた場合には,早期再発の可能性も考慮し,腹部エコー検査やMRI検査,必要な場合にはCT検査などの画像検査も含めた厳重なサーベイランスを予定する。
Ⅱ-3-5 その他の随伴病変
- FAP患者では,小腸腫瘍,肝芽腫,副腎腫瘍,甲状腺癌などの随伴腫瘍性病変を発生することがある。
〔小腸(空腸・回腸)腫瘍(カプセル内視鏡検査)〕
- FAPにおける小腸癌の累積発生リスクは<1%(一般集団0.3%),平均年齢は43歳と報告されている1)。小腸腫瘍の発生には十二指腸腫瘍の発生と正の相関がみられることがメタアナリシスの結果により報告されている151)。小腸腫瘍に対するサーベイランスについては小腸の定期的な画像診断や小腸内視鏡検査のエビデンスは確率されておらず1,152),デスモイド腫瘍の画像検査(CT/MRI)の際の可及的な観察や,高度な十二指腸ポリポーシスが認められる場合はカプセル内視鏡などの小腸検査が提案されている1)。
- FAPの小腸腫瘍に対するカプセル内視鏡検査については,大腸手術後や若年者でも安全に完遂できることが報告されている151,153-155)。ただし,大腸手術後では,事前の通過障害の有無の確認や検査後のカプセル回収に注意しカプセル内視鏡検査を行うことが肝要である156)。FAPにおけるカプセル内視鏡検査での空・回腸ポリープの発見率は30.4~60%と報告されている151,153-155)。カプセル内視鏡を用いた空・回腸ポリープの発生部位に関する研究では,29例のFAPのうち21例に小腸ポリープを認め,近位空腸では76%に認めたのに対して遠位空腸と回腸では3%であった157)。しかし,小腸ポリープからの発がん頻度は不明であり,本邦におけるFAPの空・回腸癌の報告は少なく,カプセル内視鏡検査を用いた小腸の検索の有用性は限定的であり158,159),上部消化管内視鏡検査では観察できない範囲に悪性腫瘍の発生が疑われる場合,FAPに対するカプセル内視鏡検査が検討される。
〔副腎腫瘍〕
- FAP患者の7.4~16%(一般集団1~3%)に副腎腫瘍が合併する160-162)。海外の報告では,FAP患者311例中48例(16%)に副腎腫瘍を認め,診断時の平均年齢は45歳,両側性は23%であったと報告した160)。大部分はCT検査により偶然発見されたものであり,80%が腺腫,97%以上が良性(他に骨髄脂肪腫,過形成など),癌は1例(約2%)のみであった。
〔肝芽腫〕
- 肝芽腫の発生は一般集団と比較しFAPの若年者で増加する163)。肝芽腫の累積発生リスクは0.4~2.5%で,平均年齢18~33カ月に認められる1)。最近の109例のFAPに併存した肝芽腫のreview164)では,男女比2.6:1,年齢中央値は20カ月(出生後~11.6歳)であった。35例(データのある49例中)ではFAPの診断前に肝芽腫が指摘されている。12%にde novo発生を認め,APCのバリアント部位と肝芽腫の発生との間に相関性は認めなかった。肝触診,腹部エコー,血清AFPによるスクリーニング(3~6カ月の間隔で5歳まで1)や2年間隔で7歳まで165))が提案されているが,エビデンスの高いルーチンの肝芽腫のスクリーニン方法はない1,165)。
〔甲状腺癌〕(CQ5)
- FAPでは,一般集団と比較し甲状腺癌の累積発生リスクが高い(FAP 1.2~12% vs 一般集団1.2%)1)。最近のメタアナリシスでは,甲状腺癌はFAP患者の約2.6%で認められ,診断された平均年齢は31歳,女性が95%を占めている。Papillary carcinomaが83%を占め,そのうちcribriform-morular variantは26%の割合であった。約1/3の症例では,FAPの診断の前に甲状腺癌が診断されていた。46%は両葉,59%は多中心性に癌が局在していた。病的バリアントの79%はAPCの5’末端側に位置していた1,166)。本邦の報告では,頻度はFAPの6.4%で,女性に多く(女性:男性 8:1),年齢は女性17~41歳,男性39~57歳で他国の報告と同様であった167)。甲状腺癌の有病率はスクリーニングに超音波検査を施行した群で(6.9% vs 1.4%)有意に高く,10代から開始した毎年の超音波による甲状腺検査が提案されている1,166)。ベースライン超音波を10代後半で開始,もし正常であれば2~5年間隔での定期検査,異常が指摘されれば甲状腺の専門医へのコンサルトを考慮する。甲状腺癌の家族歴があれば,定期検査間隔の短縮を考慮する1)。
Ⅱ-4 家族(血縁者)・小児への対応
Ⅱ-4-1 家族(血縁者)への対応
- 血縁者(特に第1度近親者である親,子,兄弟姉妹)には疾患について十分な説明を行い,同意を得たうえで大腸を中心とする消化管サーベイランスを行う。
- 血縁者に大腸腺腫(特に複数)を認めた場合はFAPの診断チャート(図Ⅰ-5)に従う。
- 血縁者にFAP関連の臨床症状がある場合には,年齢に関係なく症状への対応を行う。
- FAPを含めた遺伝性腫瘍では,家族歴の聴取が必須事項であり,標準的記載法に基づいた家系図168-170)として正確に記載・記録しておくことが望ましい(付録Ⅲ:家系図の記載法)。個人の病歴などは経時的に変化するため,家系情報の更新を適宜行うことが望まれる171)。
- 患者本人のほかに,家族(血縁者)にも遺伝カウンセリングを行うことが望ましい。
- 家系の中でAPCの生殖細胞系列病的バリアントが判明している場合は,血液検体等の正常組織を用いた遺伝学的検査で診断が確定するため,遺伝カウンセリングで発症前診断についても適切な時期に検討する(Ⅰ-3:遺伝カウンセリング)。なお,遺伝学的検査を行う場合には,検査前後に医師および,あるいは専門家による遺伝カウンセリングが必須である。
Ⅱ-4-2 小児への対応
- 古典的FAPの場合は大腸サーベイランスが開始推奨時期である10代前半~半ばに,減弱型FAPの場合は10代後半に,親・親権者を伴った遺伝カウンセリング・発症前診断実施を検討する。
- 肝芽腫スクリーニングについて積極的に考える場合は,乳幼児期の発症前診断について考慮する。
Ⅱ-4-2-1 小児期のFAP
〔消化管病変〕
- 10歳代で大腸に複数の腺腫が出現する。英国のレジストリ研究によると,初回の大腸内視鏡検査(平均年齢13歳)時の大腸ポリープ数は79%が100個以下,101~500個が17%,500以上が4%であり,ポリープ最大径の中央値は2mm(1~15mm)であった172)。さらに初回検査後のサーベイランスでは,ポリープ数が12.5個/年(0~145個)増加したと報告されている。また,小児期の大腸ポリープの増加率はcodon 1309の病的バリアントを有する症例で89個/年とより急速であることが知られている173)。
- 20歳未満の大腸癌の合併は極めて稀(FAP患者の0.2%未満)11)である。ただし下痢,血便,貧血などの消化器症状がある場合には,年齢によらず大腸内視鏡検査を行う。
- 中学生以下の小児の内視鏡検査においては,「内視鏡検査を二度と受けたくない」というトラウマを残さないよう配慮する。腸管プレパレーション,鎮静・麻酔の適応と医療体制は,「小児消化管内視鏡ガイドライン2017」に詳細に示されている174)。FAPのサーベイランスの適応となる思春期は,検査の理解や受け入れにおいて個人差が大きく,一人一人の子どもの発達段階に合わせた内視鏡検査の説明とインフォームド・アセントが重要である。腸管前処置は容易でないものの,近年アスコルビン酸含有ポリエチレングリコール電解質製剤(商品名:ピコプレップ)の有効性と安全性との報告がある175)。また鎮静・麻酔を適切な管理体制で積極的に用いることがすすめられる。
〔消化管外病変〕
- 肝芽腫:FAPの小児の2%未満に,主に3歳までに肝芽腫の合併が報告されている176)。生後6カ月から5歳までの肝芽腫のスクリーニング検査(腹部触診,腹部超音波検査,血清αフェトプロテイン)を推奨する意見と1,177),有効性のエビデンスがなく推奨できないとする意見がある165)。FAP at risk者の乳幼児では,肝芽腫のリスクについて説明し,保護者の希望を考慮のうえ対応する。
- 甲状腺癌,デスモイド腫瘍,脳腫瘍(髄芽腫):小児においても合併することがある。
- 先天性網膜色素上皮腫大(congenital hypertrophy of the retinal pigment epithelium:CHRPE):CHRPEはFAPの患者の約80%に生下時から認める,網膜上の不連続平坦な色素性病変である。臨床症状はなく,治療の必要性はない。視力に影響なく,悪性化もしない。両側性または多発性のCHRPEは,FAPに特徴的な所見である。
Ⅱ-4-2-2 小児慢性特定疾病事業と医療費助成
- 18歳未満の児童等がFAPと診断され,一定の基準を満たす場合には,小児慢性特定疾病事業による医療費助成等の支援が受けられる。18歳到達時点において本事業の対象になっており,かつ,18歳到達後も引き続き治療が必要と認められる場合には,20歳未満の者も対象となる。申請のための意見書の交付にあたっては,事前に小児慢性特定疾病指定医療機関ならびに指定医の認定を要する。〈詳細は小児慢性特定疾病情報センターホームページを参照のこと:https://www.shouman.jp〉
文献
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology. Genetic/Familial High-Risk Assessment: Colorectal. Version 2. 2023. Available from https://www.nccn.org/guidelines/guidelines-detail?category=2&id=1436
- Yen T, Stanich PP, Axell L, et al.: APC-Associated Polyposis Conditions. 1998 Dec 18[updated 2022 May 12]In: Adam MP, Feldman J, Mirzaa GM, et al., editors.: GeneReviews®[Internet]. Seattle(WA): University of Washington, Seattle; 1993-2024. 1998 Dec 18[updated 2022 May 12](. Ⓒ1993-2023 University of Washington)Available from https://www.ncbi.nlm.nih.gov/books/NBK1345[PMID: 20301519]
- Morin PJ, Sparks AB, Korinek V, et al.: Activation of β-catenin-Tcf signaling in colon cancer by mutation in β- catenin or APC. Science 1997; 275: 1787-1790.[PMID: 9065402]
- Behrens J, Jerchow BA, Wurtele M, et al.: Functional interaction of an axin homolog, conductin, with β-catenin, APC, and GSK3β. Science 1998; 280: 596-599.[PMID: 9554852]
- Miyaki M, Yamaguchi T, Iijima T, et al.: Difference in characteristics of APC mutations between colonic and extracolonic tumors of FAP patients: variations with phenotype. Int J Cancer 2008; 122: 2491-2497.[PMID: 18224684]
- Nagase H, Miyoshi Y, Horii A, et al.: Correlation between the location of germ-line mutations in the APC gene and the number of colorectal polyps in familial adenomatous polyposis patients. Cancer Res 1992 15; 52: 4055-4057.[PMID: 1319838]
- Nugent KP, Phillips RK, Hodgson SV, et al.: Phenotypic expression in familial adenomatous polyposis: partial prediction by mutation analysis. Gut 1994; 35: 1622-1623.[PMID: 7828985]
- Knudsen AL, Bisgaard ML, Bülow S: Attenuated familial adenomatous polyposis(AFAP). A review of the literature. Fam Cancer 2003; 2: 43-55.[PMID: 14574166]
- Kobayashi H, Ishida H, Ueno H, et al.: Association between the age and the development of colorectal cancer in patients with familial adenomatous polyposis: a multi-institutional study. Surg Today 2017; 47: 470-475.[PMID: 27506752]
- Murata M, Utsunomiya J, Iwama T, et al.: Frequency of adenomatosis coli in Japan. Jinrui Idengaku Zasshi 1981; 26: 19-30.[PMID: 7265541]
- Vasen HF, Möslein G, Alonso A, et al.: Guidelines for the clinical management of familial adenomatous polyposis (FAP). Gut 2008; 57: 704-713.[PMID: 18194984]
- Bussey HJR, Morson BC: Familial Polyposis Coli. In: Lipkin M, Good RA(eds): Gastrointestinal Tract Cancer. Sloan-Kettering Institute Cancer Series. Springer, Boston, MA. 1978.
- Iwama T, Tamura K, Morita T, et al.: A clinical overview of familial adenomatous polyposis derived from the database of the Polyposis Registry of Japan. Int J Clin Oncol 2004; 9: 308-316.[PMID: 15375708]
- Grover S, Kastrinos F, Steyerberg EW, et al.: Prevalence and phenotypes of APC and MUTYH mutations in patients with multiple colorectal adenomas. JAMA 2012; 308: 485-492.[PMID: 22851115]
- Hamilton SR, Liu B, Parsons RE, et al.: The molecular basis of Turcotʼs syndrome. N Engl J Med 1995 30; 332: 839-847.[PMID: 7661930]
- Takao M, Yamaguchi T, Eguchi H, et al.: APC germline variant analysis in the adenomatous polyposis phenotype in Japanese patients. Int J Clin Oncol 2021; 26: 1661-1670.[PMID: 34106356]
- Aretz S, Stienen D, Friedrichs N, et al.: Somatic APC mosaicism: a frequent cause of familial adenomatous polyposis(FAP). Hum Mutat 2007; 28: 985-992.[PMID: 17486639]
- Hes FJ, Nielsen M, Bik EC, et al.: Somatic APC mosaicism: an underestimated cause of polyposis coli. Gut 2008; 57: 71-76.[PMID: 17604324]
- Kim B, Won D, Jang M, et al.: Next-generation sequencing with comprehensive bioinformatics analysis facilitates somatic mosaic APC gene mutation detection in patients with familial adenomatous polyposis. BMC Med Genomics 2019 3; 12: 103.[PMID: 31269945]
- Jansen AM, Crobach S, Geurts-Giele WR, et al.: Distinct Patterns of Somatic Mosaicism in the APC Gene in Neoplasms From Patients With Unexplained Adenomatous Polyposis. Gastroenterology 2017; 152: 546-549.e3.[PMID: 27816598]
- Worthley DL, Phillips KD, Wayte N, et al.: Gastric adenocarcinoma and proximal polyposis of the stomach(GAPPS): a new autosomal dominant syndrome. Gut 2012; 61: 774-779.[PMID: 21813476]
- Kim W, Kidambi T, Lin J, et al.: Genetic Syndromes Associated with Gastric Cancer. Gastrointest Endosc Clin N Am 2022; 32: 147-162.[PMID: 34798983]
- Tacheci I, Repak R, Podhola M, et al.: Gastric adenocarcinoma and proximal polyposis of the stomach(GAPPS)―A Helicobacter-opposite point. Best Pract Res Clin Gastroenterol 2021; 50-51: 101728.[PMID: 33975682]
- Shirts BH, Salipante SJ, Casadei S, et al.: Deep sequencing with intronic capture enables identification of an APC exon 10 inversion in a patient with polyposis. Genet Med 2014; 16: 783-786.[PMID: 24675673]
- van der Luijt RB, Tops CM, Khan PM, et al.: Molecular, cytogenetic, and phenotypic studies of a constitutional reciprocal translocation t(5;10)(q22;q25)responsible for familial adenomatous polyposis in a Dutch pedigree. Genes Chromosomes Cancer 1995; 13: 192-202.[PMID: 7669739]
- Elsayed FA, Tops CMJ, Nielsen M, et al.: Use of sanger and next-generation sequencing to screen for mosaic and intronic APC variants in unexplained colorectal polyposis patients. Fam Cancer 2022; 21: 79-83.[PMID: 33683519]
- Bozsik A, Butz H, Grolmusz VK, et al.: Genome sequencing-based discovery of a novel deep intronic APC pathogenic variant causing exonization. Eur J Hum Genet 2023; 31: 841-845.[PMID: 36828923]
- Pavicic W, Nieminen TT, Gylling A, et al.: Promoter-specific alterations of APC are a rare cause for mutation-negative familial adenomatous polyposis. Genes Chromosomes Cancer 2014; 53: 857-864. doi: 10.1002/gcc.22197.[PMID: 24946964]
- Lynch PM, Morris JS, Wen S, et al.: A proposed staging system and stage-specific interventions for familial adenomatous polyposis. Gastrointest Endosc 2016; 84: 115-125.e114.[PMID: 26769407]
- Septer S, Lawson CE, Anant S, et al.: Familial adenomatous polyposis in pediatrics: natural history, emerging surveillance and management protocols, chemopreventive strategies, and areas of ongoing debate. Fam Cancer 2016; 15: 477-485.[PMID: 27056662]
- Distante S, Nasioulas S, Somers GR, et al.: Familial adenomatous polyposis in a 5 year old child: a clinical, pathological, and molecular genetic study. J Med Genet 1996; 33: 157-160.[PMID: 8929955]
- Nielsen M, Hes FJ, Nagengast FM, et al.: Germline mutations in APC and MUTYH are responsible for the majority of families with attenuated familial adenomatous polyposis. Clin Genet 2007; 71: 427-433.[PMID: 17489848]
- Burt RW, Leppert MF, Slattery ML, et al.: Genetic testing and phenotype in a large kindred with attenuated familial adenomatous polyposis. Gastroenterology 2004; 127: 444-451.[PMID: 15300576]
- Ishikawa H, Mutoh M, Iwama T, et al.: Endoscopic management of familial adenomatous polyposis in patients refusing colectomy. Endoscopy 2016; 48: 51-55.[PMID: 26352809]
- Ishikawa H, Yamada M, Sato Y, et al.: Intensive endoscopic resection for downstaging of polyp burden in patients with familial adenomatous polyposis(J-FAPP Study Ⅲ): a multicenter prospective interventional study. Endoscopy 2023; 55: 344-352. doi: 10.1055/a-1945-9120.[PMID: 36216266]
- 岩間毅夫: 大腸腺腫症の病理形態学的研究.日外会誌1978; 79: 10-23
- Sturt NJ, Gallagher MC, Bassett P, et al.: Evidence for genetic predisposition to desmoid tumours in familial adenomatous polyposis independent of the germline APC mutation. Gut 2004; 53: 1832-1836.[PMID: 15542524]
- Rozen P, Macrae F: Familial adenomatous polyposis: The practical applications of clinical and molecular screening. Fam Cancer 2006; 5: 227-235.[PMID: 16998668]
- Mori Y, Ishida H, Chika N, et al.: Usefulness of genotyping APC gene for individualizing management of patients with familial adenomatous polyposis. Int J Clin Oncol 2023; 28: 1641-1650.[PMID: 37853284]
- Crabtree MD, Tomlinson IP, Talbot IC, et al.: Variability in the severity of colonic disease in familial adenomatous polyposis results from differences in tumour initiation rather than progression and depends relatively little on patient age. Gut 2001; 49: 540-543.[PMID: 11559652]
- Olsen KØ, Juul S, Bülow S, et al.: Female fecundity before and after operation for familial adenomatous polyposis. Br J Surg 2003; 90: 227-231.[PMID: 12555301]
- Kartheuser AH, Parc R, Penna CP, et al.: Ileal pouch-anal anastomosis as the first choice operation in patients with familial adenomatous polyposis: a ten-year experience. Surgery 1996; 119: 615-623.[PMID: 8650601]
- Rozen P, Samuel Z, Rabau M, et al.: Familial adenomatous polyposis at the Tel Aviv Medical Center: demographic and clinical features. Fam Cancer 2001; 1: 75-82.[PMID: 14574001]
- Eccles DM, Lunt PW, Wallis Y, et al.: An unusually severe phenotype for familial adenomatous polyposis. Arch Dis Child 1997; 77: 431-435.[PMID: 9487968]
- Vasen HF, van Duijvendijk P, Buskens E, et al.: Decision analysis in the surgical treatment of patients with familial adenomatous polyposis: a Dutch-Scandinavian collaborative study including 659 patients. Gut 2001; 49: 231-235.[PMID: 11454800]
- Kartheuser A, Stangherlin P, Brandt D, et al.: Restorative proctocolectomy and ileal pouch-anal anastomosis for familial adenomatous polyposis revisited. Fam Cancer 2006; 5: 241-260; discussion 261-262.[PMID: 16998670]
- Ueno H, Kobayashi H, Konishi T, et al.: Prevalence of laparoscopic surgical treatment and its clinical outcomes in patients with familial adenomatous polyposis in Japan. Int J Clin Oncol 2016; 21: 713-722.[PMID: 26820718]
- Konishi T, Ishida H, Ueno H, et al.: Feasibility of laparoscopic total proctocolectomy with ileal pouch-anal anastomosis and total colectomy with ileorectal anastomosis for familial adenomatous polyposis: results of a nationwide multicenter study. Int J Clin Oncol 2016; 21: 953-961.[PMID: 27095110]
- Campos FG: Surgical treatment of familial adenomatous polyposis: dilemmas and current recommendations. World J Gastroenterol 2014; 20: 16620-16629.[PMID: 25469031]
- Kjaer MD, Laursen SB, Qvist N, et al.: Sexual function and body image are similar after laparoscopy-assisted and open ileal pouch-anal anastomosis. World J Surg 2014; 38: 2460-2465.[PMID: 24711157]
- Fajardo AD, Dharmarajan S, George V, et al.: Laparoscopic versus open 2-stage ileal pouch: laparoscopic approach allows for faster restoration of intestinal continuity. J Am Coll Surg 2010; 211: 377-383.[PMID: 20800195]
- da Luz Moreira A, Church JM, Burke CA: The evolution of prophylactic colorectal surgery for familial adenomatous polyposis. Dis Colon Rectum 2009; 52: 1481-1486.[PMID: 19617764]
- Sinha A, Burns EM, Latchford A, et al.: Risk of desmoid formation after laparoscopic versus open colectomy and ileorectal anastomosis for familial adenomatous polyposis. BJS Open 2018; 2: 452-455.[PMID: 30511045]
- Chittleborough TJ, Warrier SK, Heriot AG, et al.: Dispelling misconceptions in the management of familial adenomatous polyposis. ANZ J Surg 2017; 87: 441-445.[PMID: 28266097]
- Johansen C, Bitsch M, Bülow S: Fertility and pregnancy in women with familial adenomatous polyposis. Int J Colorectal Dis 1990; 5: 203-206.[PMID: 1962811]
- Nieuwenhuis MH, Douma KF, Bleiker EM, et al.: Female fertility after colorectal surgery for familial adenomatous polyposis: a nationwide cross-sectional study. Ann Surg 2010; 252: 341-344.[PMID: 20622653]
- Oresland T, Palmblad S, Ellstrom M, et al.: Gynaecological and sexual function related to anatomical changes in the female pelvis after restorative proctocolectomy. Int J Colorectal Dis 1994; 9: 77-81.[PMID: 8064194]
- Bartels SA, DʼHoore A, Cuesta MA, et al.: Significantly increased pregnancy rates after laparoscopic restorative proctocolectomy: a cross-sectional study. Ann Surg 2012; 256: 1045-1048.[PMID: 22609840]
- Remzi FH, Gorgun E, Bast J, et al.: Vaginal delivery after ileal pouch-anal anastomosis: a word of caution. Dis Colon Rectum 2005; 48: 1691-1699.[PMID: 16142432]
- Juhasz ES, Fozard B, Dozois RR, et al.: Ileal pouch-anal anastomosis function following childbirth. An extended evaluation. Dis Colon Rectum 1995; 38: 159-165.[PMID: 7851170]
- Parc Y, Piquard A, Dozois RR, et al.: Long-term outcome of familial adenomatous polyposis patients after restorative coloproctectomy. Ann Surg 2004; 239: 378-382.[PMID: 15075655]
- Thompson-Fawcett MW, Marcus VA, Redston M, et al.: Adenomatous polyps develop commonly in the ileal pouch of patients with familial adenomatous polyposis. Dis Colon Rectum 2001; 44: 347-353.[PMID: 11289279]
- Groves CJ, Beveridge lG, Swain DJ, et al.: Prevalence and morphology of pouch and ileal adenomas in familial adenomatous polyposis. Dis Colon Rectum 2005; 48: 816-823.[PMID: 15747076]
- Tajika M, Niwa Y, Bhatia V, et al.: Risk of ileal pouch neoplasms in patients with familial adenomatous polyposis. World J Gastroenterol 2013; 19: 6774-6783.[PMID: 24187452]
- Hoehner JC, Metcalf AM: Development of invasive adenocarcinoma following colectomy with ileoanal anastomosis for familial polyposis coli. Report of a case. Dis Colon Rectum 1994; 37: 824-828.[PMID: 8055729]
- Ault GT, Nunoo-Mensah JW, Johnson L, et al.: Adenocarcinoma arising in the middle of ileoanal pouches: report of five cases. Dis Colon Rectum 2009; 52: 538-541.[PMID: 19333060]
- Angriman I, Scarpa M, Castagliuolo I: Relationship between pouch microbiota and pouchitis following restorative proctocolectomy for ulcerative colitis. World J Gastroenterol 2014; 20: 9665-9674.[PMID: 25110406]
- Koskenvuo L, Renkonen-Sinisalo L, Järvinen HJ, et al.: Risk of cancer and secondary proctectomy after colectomy and ileorectal anastomosis in familial adenomatous polyposis. Int J Colorectal Dis 2014; 29: 225-230.[PMID:24292488]
- Campos FG, Perez RO, Imperiale AR, et al.: Surgical treatment of familial adenomatous polyposis: ileorectal anastomosis or restorative proctolectomy? Arq Gastroenterol 2009; 46: 294-299.[PMID: 20232009]
- Nieuwenhuis MH, Bülow S, Björk J, et al.: Genotype predicting phenotype in familial adenomatous polyposis: a practical application to the choice of surgery. Dis Colon Rectum 2009; 52: 1259-1263.[PMID: 19571702]
- Bülow S, Bülow C, Vasen H, et al.: Colectomy and ileorectal anastomosis is still an option for selected patients with familial adenomatous polyposis. Dis Colon Rectum 2008; 51: 1318-1323.[PMID: 18523824]
- Church J, Simmang C; Standards Task Force; American Society of Colon and Rectal Surgeons; Collaborative Group of the Americas on Inherited Colorectal Cancer and the Standards Committee of The American Society of Colon and Rectal Surgeons: Practice parameters for the treatment of patients with dominantly inherited colorectal cancer(familial adenomatous polyposis and hereditary nonpolyposis colorectal cancer). Dis Colon Rectum 2003; 46: 1001-1012.[PMID: 12907889]
- Bianchi LK, Burke CA, Bennett AE, et al.: Fundic gland polyp dysplasia is common in familial adenomatous polyposis. Clin Gastroenterol Hepatol 2008; 6: 180-185.[PMID: 18237868]
- Takao A, Koizumi K, Takao M, et al.: Upper gastrointestinal tumors are unrelated to the APC genotype in APC-associated polyposis. Jpn J Clin Oncol 2022 31; 52: 554-561.[PMID: 35296888]
- Shimamoto Y, Ishiguro S, Takeuchi Y, et al.: Gastric neoplasms in patients with familial adenomatous polyposis: endoscopic and clinicopathologic features. Gastrointest Endosc 2021; 94: 1030-1042.e2.[PMID: 34146551]
- Bertoni G, Sassatelli R, Nigrisoli E, et al.: Dysplastic changes in gastric fundic gland polyps of patients with familial adenomatous polyposis. Ital J Gastroenterol Hepatol 1999; 31: 192-197.[PMID: 10379478]
- Kobashi M, Iwamuro M, Kuraoka S, et al.: Endoscopic findings of gastric neoplasms in familial adenomatous polyposis are associated with the phenotypic variations and grades of dysplasia. Medicine(Baltimore). 2022; 101: e30997. doi: 10.1097/MD.0000000000030997. PMCID: PMC9575760.[PMID: 36254079]
- Ngamruengphong S, Boardman LA, Heigh RI, et al.: Gastric adenomas in familial adenomatous polyposis are common, but subtle, and have a benign course. Hered Cancer Clin Pract 2014; 12: 4.[PMID: 24565534]
- Spigelman AD, Williams CB, Talbot IC, et al.: Upper gastrointestinal cancer in patients with familial adenomatous polyposis. Lancet 1989; 2: 783-785.[PMID: 2571019]
- Yang J, Gurudu SR, Koptiuch C, et al.: American Society for Gastrointestinal Endoscopy guideline on the role of endoscopy in familial adenomatous polyposis syndromes. Gastrointest Endosc 2020; 91: 963-982.e2.[PMID: 32169282]
- Iida M, Yao T, Itoh H, et al.: Natural history of duodenal lesions in Japanese patients with familial adenomatosiscoli(Gardnerʼs syndrome). Gastroenterology 1989; 96: 1301-1306.[PMID: 2703115]
- Moozar KL, Madlensky L, Berk T, et al.: Slow progression of periampullary neoplasia in familial adenomatous polyposis. J Gastrointest Surg 2002; 6: 831-837; discussion 837.[PMID: 12504221]
- Brosens LA, Keller JJ, Offerhaus GJ, et al.: Prevention and management of duodenal polyps in familial adenomatous polyposis. Gut 2005; 54: 1034-1043.[PMID: 15951555]
- Yamaguchi T, Ishida H, Ueno H, et al.: Upper gastrointestinal tumours in Japanese familial adenomatous polyposis patients. Jpn J Clin Oncol 2016; 46: 310-315.[PMID: 26819281]
- Moussata D, Napoleon B, Lepilliez V, et al.: Endoscopic treatment of severe duodenal polyposis as an alternative to surgery for patients with familial adenomatous polyposis. Gastrointest Endosc 2014; 80: 817-825.[PMID: 24814771]
- Karstensen JG, Bülow S, Burisch J, et al.: Validation of the Endoscopic Part of the Spigelman Classification for Evaluating Duodenal Adenomatosis in Familial Adenomatous Polyposis: A Prospective Study of Interrater and Intrarater Reliability. Am J Gastroenterol 2022; 117: 343-345.[PMID: 34913876]
- Galle TS, Juel K, Bülow S: Causes of death in familial adenomatous polyposis. Scand J Gastroenterol 1999; 34: 808-812.[PMID: 10499482]
- Offerhaus GJ, Giardiello FM, Krush AJ, et al.: The risk of upper gastrointestinal cancer in familial adenomatous polyposis. Gastroenterology 1992; 102: 1980-1982.[PMID: 1316858]
- Park JG, Park KJ, Ahn YO, et al.: Risk of gastric cancer among Korean familial adenomatous polyposis patients. Report of three cases. Dis Colon Rectum 1992; 35: 996-998.[PMID: 1327683]
- Bülow S, Björk J, Christensen IJ, et al.: Duodenal adenomatosis in familial adenomatous polyposis. Gut 2004; 53: 381-386.[PMID: 14960520]
- Björk J, Akerbrant H, Iselius L, et al.: Periampullary adenomas and adenocarcinomas in familial adenomatous polyposis: cumulative risks and APC gene mutations. Gastroenterology 2001; 121: 1127-1135.[PMID: 11677205]
- Saurin JC, Gutknecht C, Napoleon B, et al.: Surveillance of duodenal adenomas in familial adenomatous polyposis reveals high cumulative risk of advanced disease. J Clin Oncol 2004; 22: 493-498.[PMID: 14752072]
- Lopez-Ceron M, van den Broek FJ, Mathus-Vliegen EM, et al.: The role of high-resolution endoscopy and narrow-band imaging in the evaluation of upper GI neoplasia in familial adenomatous polyposis. Gastrointest Endosc 2013; 77: 542-550
- 飯田三男,檜沢一興,松本主之,他: 家族性大腸腺腫症における胃・十二指腸病変の長期経過.胃と腸1997; 32: 563-576
- Singh AD, Bhatt A, Joseph A, et al.: Natural history of ampullary adenomas in familial adenomatous polyposis: a long-term follow-up study. Gastrointest Endosc 2022; 95: 455-467.e3.[PMID: 34624304]
- Mehta NA, Shah RS, Yoon J, et al.: Risks, Benefits, and Effects on Management for Biopsy of the Papilla in Patients With Familial Adenomatous Polyposis. Clin Gastroenterol Hepatol 2021; 19: 760-767.[PMID: 32492482]
- Inoki K, Nakajima T, Nonaka S, et al.: Feasibility of endoscopic resection using bipolar snare for nonampullary duodenal tumours in familial adenomatous polyposis patients. Fam Cancer 2018; 17: 517-524.[PMID: 29189961]
- Hamada K, Takeuchi Y, Ishikawa H, et al.: Feasibility of cold snare polypectomy for multiple duodenal adenomas in patients with familial adenomatous polyposis: A pilot study. Dig Dis Sci 2016; 61: 2755-2759.[PMID: 27126203]
- Hamada K, Takeuchi Y, Ishikawa H, et al.: Safety of cold snare polypectomy for duodenal adenomas in familial adenomatous polyposis: a prospective exploratory study. Endoscopy 2018; 50: 511-517.[PMID: 29351704]
- Nakahira H, Takeuchi Y, Kanesaka T, et al.: Wide-field underwater EMR followed by line-assisted complete closure for a large duodenal adenoma. VideoGIE 2019; 4: 469-471.[PMID: 31709333]
- Alarcon FJ, Burke CA, Church JM, et al.: Familial adenomatous polyposis: efficacy of endoscopic and surgical treatment for advanced duodenal adenomas. Dis Colon Rectum 1999; 42: 1533-1536.[PMID: 10613470]
- Yabuuchi Y, Yoshida M, Kakushima N, et al.: Risk Factors for Non-Ampullary Duodenal Adenocarcinoma: A Systematic Review. Dig Dis 2022; 40: 147-155.[PMID: 34000722]
- Groves CJ, Saunders BP, Spigelman AD, et al.: Duodenal cancer in patients with familial adenomatous polyposis (FAP): results of a 10 year prospective study. Gut 2002; 50: 636-641.[PMID: 11950808]
- Noh JH, Song EM, Ahn JY, et al.: Prevalence and endoscopic treatment outcomes of upper gastrointestinal neoplasms in familial adenomatous polyposis. Surg Endosc 2022; 36: 1310-1319.[PMID: 33709227]
- Roos VH, Bastiaansen BA, Kallenberg FGJ, et al.: Endoscopic management of duodenal adenomas in patients with familial adenomatous polyposis. Gastrointest Endosc 2021; 93: 457-466.[PMID: 32535190]
- Busquets J, Lopez-Dominguez J, Gonzalez-Castillo A, et al.: Pancreas sparing duodenectomy in the treatment of primary duodenal neoplasms and other situations with duodenal involvement. Hepatobiliary Pancreat Dis Int 2021; 20: 485-492.[PMID: 33753002]
- Naples R, Simon R, Moslim M, et al.: Long-Term Outcomes of Pancreas-Sparing Duodenectomy for Duodenal Polyposis in Familial Adenomatous Polyposis Syndrome. J Gastrointest Surg 2021; 25: 1233-1240.[PMID: 32410179]
- Aelvoet AS, Bastiaansen BAJ, Fockens P, et al.: Pancreas-preserving total duodenectomy for advanced duodenal polyposis in patients with familial adenomatous polyposis: short and long-term outcomes. HPB(Oxford)2022; 24: 1642-1650.[PMID: 35568653]
- Angsuwatcharakon P, Ahmed O, Lynch PM, et al.: Management of ampullary adenomas in familial adenomatous polyposis syndrome: 16 years of experience from a tertiary cancer center. Gastrointest Endosc 2020; 92: 323-330.[PMID: 32145286]
- Iwama T, Mishima Y, Utsunomiya J: The impact of familial adenomatous polyposis on the tumorigenesis and mortality at the several organs. Its rational treatment. Ann Surg 1993; 217: 101-108.[PMID: 8382467]
- Knudsen AL, Bulow S: Desmoid tumour in familial adenomatous polyposis. A review of literature. Fam Cancer 2001; 1: 111-119.[PMID: 14574007]
- Nieuwenhuis MH, De Vos Tot Nederveen Cappel W, Botma A, et al.: Desmoid tumors in a dutch cohort of patients with familial adenomatous polyposis. Clin Gastroenterol Hepatol 2008; 6: 215-219.[PMID: 18237870]
- Bertario L, Presciuttini S, Sala P, et al.: Causes of death and postsurgical survival in familial adenomatous polyposis: results from the Italian Registry. Italian Registry of Familial Polyposis Writing Committee. Semin Surg Oncol 1994; 10: 225-234.[PMID: 8085100]
- Speake D, Evans DG, Lalloo F, et al.: Desmoid tumours in patients with familial adenomatous polyposis and desmoid region adenomatous polyposis coli mutations. Br J Surg 2007; 94: 1009-1013.[PMID: 17410559]
- Saito Y, Hinoi T, Ueno H, et al.: Risk Factors for the Development of Desmoid Tumor After Colectomy in Patients with Familial Adenomatous Polyposis: Multicenter Retrospective Cohort Study in Japan. Ann Surg Oncol 2016; 23: 559-565.[PMID: 27387679]
- Yamano T, Hamanaka M, Babaya A, et al.: Management strategies in Lynch syndrome and familial adenomatous polyposis: a national healthcare survey in Japan. Cancer Sci 2017; 108: 243-249.[PMID: 27870147]
- Koskenvuo L, Ristimaki A, Lepisto A: Comparison of sporadic and FAP-associated desmoid-type fibromatoses. J Surg Oncol 2017; 116: 716-721.[PMID: 28570749]
- Kasper B, Baumgarten C, Garcia J, et al.; Desmoid Working Group: An update on the management of sporadic desmoid-type fibromatosis: a European Consensus Initiative between Sarcoma PAtients EuroNet(SPAEN)and European Organization for Research and Treatment of Cancer(EORTC)/Soft Tissue and Bone Sarcoma Group(STBSG). Ann Oncol 2017; 28: 2399-2408.[PMID: 28961825]
- Latchford AR, Sturt NJ, Neale K, et al.: A 10-year review of surgery for desmoid disease associated with familial adenomatous polyposis. Br J Surg 2006; 93: 1258-1264.[PMID: 16952208]
- Stevenson JK, Reid BJ: Unfamiliar aspects of familial polyposis coli. Am J Surg 1986; 152: 81-86.[PMID: 3728822]
- Benoit L, Faivre L, Cheynel N, et al.: 3ʼMutation of the APC gene and family history of FAP in a patient with apparently sporadic desmoid tumors. J Clin Gastroenterol 2007; 41: 297-300.[PMID: 17426470]
- Walter T, Zhenzhen Wang C, Guillaud O, et al.: Management of desmoid tumours: A large national database of familial adenomatous patients shows a link to colectomy modalities and low efficacy of medical treatments. United European Gastroenterol J 2017; 5: 735-741.[PMID: 28815038]
- Bertario L, Russo A, Sala P, et al.: Genotype and phenotype factors as determinants of desmoid tumors in patients with familial adenomatous polyposis. Int J Cancer 2001; 95: 102-107.[PMID: 11241320]
- Nieuwenhuis MH, Lefevre JH, Bülow S, et al.: Family history, surgery, and APC mutation are risk factors for desmoid tumors in familial adenomatous polyposis: an international cohort study. Dis Colon Rectum 2011; 54: 1229-1234.[PMID: 21904137]
- Church J, Xhaja X, LaGuardia L, et al.: Desmoids and genotype in familial adenomatous polyposis. Dis Colon Rectum 2015; 58: 444-448.[PMID: 25751801]
- Church J, Lynch C, Neary P, et al.: A desmoid tumor-staging system separates patients with intra-abdominal, familial adenomatous polyposis-associated desmoid disease by behavior and prognosis. Dis Colon Rectum 2008; 51: 897-901.[PMID: 18322756]
- Ishida H, Chikatani K, Mori Y, et al.: Diagnosis, treatment, and proposal of the new classification system for the severity of desmoid tumors associated with familial adenomatous polyposis. J Heredi Tumors 2020; 20: 45-58.
- Kumamoto K, Ishida H, Tomita N: Recent Advances and Current Management for Desmoid Tumor Associated with Familial Adenomatous Polyposis. J Anus Rectum Colon 2023; 7: 38-51.[PMID: 37113586]
- Desmoid Tumor Working G: The management of desmoid tumours: A joint global consensus-based guideline approach for adult and paediatric patients. Eur J Cancer 2020; 127: 96-107.[PMID: 32004793]
- Bocale D, Rotelli MT, Cavallini A, et al.: Anti-oestrogen therapy in the treatment of desmoid tumours: a systematic review. Colorectal Dis 2011; 13: e388-395.[PMID: 21831172]
- Skapek SX, Anderson JR, Hill DA, et al.: Safety and efficacy of high-dose tamoxifen and sulindac for desmoid tumor in children: results of a Childrenʼs Oncology Group(COG)phase Ⅱ study. Pediatr Blood Cancer 2013; 60: 1108-1112.[PMID: 23281268]
- Chugh R, Wathen JK, Patel SR, et al.: Sarcoma Alliance for Research through C: Efficacy of imatinib in aggressive fibromatosis: Results of a phase Ⅱ multicenter Sarcoma Alliance for Research through Collaboration(SARC)trial. Clin Cancer Res 2010; 16: 4884-4891.[PMID: 20724445]
- Heinrich MC, McArthur GA, Demetri GD, et al.: Clinical and molecular studies of the effect of imatinib on advanced aggressive fibromatosis(desmoid tumor). J Clin Oncol 2006; 24: 1195-1203.[PMID: 16505440]
- Kasper B, Gruenwald V, Reichardt P, et al.: Imatinib induces sustained progression arrest in RECIST progressive desmoid tumours: Final results of a phase Ⅱ study of the German Interdisciplinary Sarcoma Group(GISG). Eur J Cancer 2017; 76: 60-67.[PMID: 28282612]
- Penel N, Le Cesne A, Bui BN, et al.: Imatinib for progressive and recurrent aggressive fibromatosis(desmoid tumors): an FNCLCC/French Sarcoma Group phase Ⅱ trial with a long-term follow-up. Ann Oncol 2011; 22: 452-457.[PMID: 20622000]
- Gounder MM, Mahoney MR, Van Tine BA, et al.: Sorafenib for Advanced and Refractory Desmoid Tumors. N Engl J Med 2018; 379: 2417-2428.[PMID: 30575484]
- Toulmonde M, Pulido M, Ray-Coquard I, et al.: Pazopanib or methotrexate-vinblastine combination chemotherapy in adult patients with progressive desmoid tumours(DESMOPAZ): a non-comparative, randomised, open-label, multicentre, phase 2 study. Lancet Oncol 2019; 20: 1263-1272.[PMID: 31331699]
- Tsukamoto S, Takahama T, Mavrogenis AF, et al.: Clinical outcomes of medical treatments for progressive desmoid tumors following active surveillance: a systematic review. Musculoskelet Surg 2023; 107: 7-18.[PMID: 35150408]
- Azzarelli A, Gronchi A, Bertulli R, et al.: Low-dose chemotherapy with methotrexate and vinblastine for patients with advanced aggressive fibromatosis. Cancer 2001; 92: 1259-1264.[PMID: 11571741]
- Skapek SX, Ferguson WS, Granowetter L, et al.: Vinblastine and methotrexate for desmoid fibromatosis in children: results of a Pediatric Oncology Group Phase Ⅱ Trial. J Clin Oncol 2007; 25: 501-506.[PMID: 17290057]
- Gega M, Yanagi H, Yoshikawa R, et al.: Successful chemotherapeutic modality of doxorubicin plus dacarbazine for the treatment of desmoid tumors in association with familial adenomatous polyposis. J Clin Oncol 2006; 24: 102-105.[PMID: 16382119]
- Napolitano A, Provenzano S, Colombo C, et al.: Familial adenomatosis polyposis-related desmoid tumours treated with low-dose chemotherapy: results from an international, multi-institutional, retrospective analysis. ESMO Open 2020; 5: e000604.[PMID: 31958289]
- Clark SK, Neale KF, Landgrebe JC, et al.: Desmoid tumours complicating familial adenomatous polyposis. Br J Surg 1999; 86: 1185-1189.[PMID: 10504375]
- DE Marchis ML, Tonelli F, Quaresmini D, et al.: Desmoid Tumors in Familial Adenomatous Polyposis. Anticancer Res 2017; 37: 3357-3366.[PMID: 28668823]
- Burtenshaw SM, Cannell AJ, McAlister ED, et al.: Toward Observation as First-line Management in Abdominal Desmoid Tumors. Ann Surg Oncol 2016; 23: 2212-2219.[PMID: 27020588]
- Iwama T, Kuwabara K, Ushiama M, et al.: Identification of somatic APC mutations in recurrent desmoid tumors in a patient with familial adenomatous polyposis to determine actual recurrence of the original tumor or de novo occurrence. Fam Cancer 2009; 8: 51-54.[PMID: 18704758]
- Nieuwenhuis MH, Mathus-Vliegen EM, Baeten CG, et al.: Evaluation of management of desmoid tumours associated with familial adenomatous polyposis in Dutch patients. Br J Cancer 2011; 104: 37-42.[PMID: 21063417]
- Smith AJ, Lewis JJ, Merchant NB, et al.: Surgical management of intra-abdominal desmoid tumours. Br J Surg 2000; 87: 608-613.[PMID: 10792318]
- Inoue Y, Ishida H, Ueno H, et al.: The treatment of desmoid tumors associated with familial adenomatous polyposis: the results of a Japanese multicenter observational study. Surg Today 2017; 47: 1259-1267.[PMID: 28251376]
- Church J, Berk T, Boman BM, et al.: Staging intra-abdominal desmoid tumors in familial adenomatous polyposis: a search for a uniform approach to a troubling disease. Dis Colon Rectum 2005; 48: 1528-1534.[PMID: 15906134]
- Yamada A, Watabe H, Iwama T, et al.: The prevalence of small intestinal polyps in patients with familial adenomatous polyposis: a prospective capsule endoscopy study. Fam Cancer 2014; 13: 23-28.[PMID: 23743563]
- Monahan KJ, Bradshaw N, Dolwani S, et al.: Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology(BSG)/Association of Coloproctology of Great Britain and Ireland(ACPGBI)/United Kingdom Cancer Genetics Group(UKCGG). Gut 2020; 69: 411-444.[PMID: 31780574]
- Burke CA, Santisi J, Church J, et al.: The utility of capsule endoscopy small bowel surveillance in patients with polyposis. Am J Gastroenterol 2005; 100: 1498-1502.[PMID: 15984971]
- Cavallo D, Ballardini G, Ferrari A, et al.: Wireless capsule endoscopy in adolescents with familial adenomatous polyposis. Tumori 2016; 102: 40-44.[PMID: 26219574]
- Iaquinto G, Fornasarig M, Quaia M, et al.: Capsule endoscopy is useful and safe for small-bowel surveillance in familial adenomatous polyposis. Gastrointest Endosc 2008; 67: 61-67.[PMID: 18155426]
- Araujo IK, Pages M, Romero C, et al.: Twelve-year asymptomatic retention of a colon capsule endoscope. Gastrointest Endosc 2017; 85: 681-682.[PMID: 27156654]
- Schulmann K, Hollerbach S, Kraus K, et al.: Feasibility and diagnostic utility of video capsule endoscopy for the detection of small bowel polyps in patients with hereditary polyposis syndromes. Am J Gastroenterol 2005; 100: 27-37.[PMID: 15654777]
- Tanaka K, Sato Y, Ishikawa H, et al.: Small intestinal involvement and genotype-phenotype correlation in familial adenomatous polyposis. Techn Innovat Gastrointest Endosc 2022; 24-34.
- Fukushi G, Yamada M, Kakugawa Y, et al.: Genotype-phenotype correlation of small-intestinal polyps on small-bowel capsule endoscopy in familial adenomatous polyposis. Gastrointest Endosc 2023; 97: 59-68.e7.[PMID: 36084716]
- Shiroky JS, Lerner-Ellis JP, Govindarajan A, et al.: Characteristics of Adrenal Masses in Familial Adenomatous Polyposis. Dis Colon Rectum 2018; 61: 679-685.[PMID: 29377868]
- Smith TG, Clark SK, Katz DE, et al.: Adrenal masses are associated with familial adenomatous polyposis. Dis Colon Rectum 2000; 43: 1739-1742.[PMID: 11156460]
- Marchesa P, Fazio VW, Church JM, et al.: Adrenal masses in patients with familial adenomatous polyposis. Dis Colon Rectum 1997; 40: 1023-1028.[PMID: 9293929]
- Aretz S, Koch A, Uhlhaas S, et al.: Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations?Pediatr Blood Cancer 2006; 47: 811-818.[PMID: 16317745]
- Trobaugh-Lotrario AD, López-Terrada D, Li P, et al.: Hepatoblastoma in patients with molecularly proven familial adenomatous polyposis: Clinical characteristics and rationale for surveillance screening. Pediatr Blood Cancer 2018; 65: e27103.[PMID: 29719120]
- Hyer W, Cohen S, Attard T, et al.: Management of Familial Adenomatous Polyposis in Children and Adolescents: Position Paper From the ESPGHAN Polyposis Working Group. J Pediatr Gastroenterol Nutr 2019; 68: 428-441.[PMID: 30585891]
- Chenbhanich J, Atsawarungruangkit A, Korpaisarn S, et al.: Prevalence of thyroid diseases in familial adenomatous polyposis: a systematic review and meta-analysis. Fam Cancer 2019; 18: 53-62.[PMID: 29663106]
- Sada H, Hinoi T, Ueno H, et al.: Prevalence of and risk factors for thyroid carcinoma in patients with familial adenomatous polyposis: results of a multicenter study in Japan and a systematic review. Surg Today 2019; 49: 72-81.[PMID: 30182306]
- Bennett RL, Steinhaus KA, Uhrich SB, et al.: Recommendations for standardized human pedigree nomenclature. Pedigree Standardization Task Force of the National Society of Genetic Counselors. Am J Hum Genet 1995; 56: 745-752.[PMID: 7887430]
- Bennett RL, French KS, Resta RG, et al.: Standardized human pedigree nomenclature: update and assessment of the recommendations of the National Society of Genetic Counselors. J Genet Couns 2008; 17: 424-433.[PMID: 18792771]
- Bennett RL, French KS, Resta RG, et al.: Practice resource-focused revision: Standardized pedigree nomenclature update centered on sex and gender inclusivity: A practice resource of the National Society of Genetic Counselors. J Genet Couns 2022; 31: 1238-1248.[PMID: 36106433]
- 日本遺伝性腫瘍学会 監,日本遺伝性腫瘍学会テキストブック作成委員会 編: 遺伝性腫瘍専門医テキストブック.へるす出版,東京,2022
- Anele CC, Xiang J, Martin I, et al.: Polyp progression in paediatric patients with familial adenomatous polyposis: A single-centre Experience. J Pediatr Gastroenterol Nutr 2020; 71: 612-616.[PMID: 33093367].
- Sarvepalli S, Burke CA, Monachese M, et al.: Natural history of colonic polyposis in young patients with familial adenomatous polyposis. Gastrointest Endosc 2018; 88: 726-733.[PMID: 29864420]
- 日本小児栄養消化器肝臓学会 編: 小児消化器内視鏡ガイドライン2017.診断と治療社,東京,pp11-22,pp53-66,2017
- 角田文彦,星雄介,虻川大樹: 小児における下部消化管内視鏡検査前処置のためのアスコルビン酸含有ポリエチレングリコール電解質製剤の有効性,安全性の検討.Gastroenterological Endoscopy 2018; 60: 125-130
- Giardiello FM, Offerhaus GJ, Krush AJ, et al.: Risk of hepatoblastoma in familial adenomatous polyposis. J Pediatr1991; 119: 766-768.[PMID: 1658283]
- Syngal S, Brand RE, Church JM, et al.; American College of Gastroenterology: ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol 2015; 110: 223-262; quiz 263. PMCID: PMC4695986.[PMID: 25645574]









