
Clinical Questions
CQ2:FAPに対する上部消化管サーベイランスは推奨されるか?
CQ3:FAPの十二指腸腺腫(乳頭部を除く)に膵温存手術(pancreas-sparing duodenectomy:PSD)は推奨されるか?
CQ4:FAP患者における症状のない腹腔内デスモイド腫瘍に対する外科的治療は推奨されるか?
CQ5:FAPに対する予防的大腸全摘術は推奨されるか?
CQ6:FAPに対する大腸全摘・回腸囊肛門(管)吻合術(IPAA)において一時的回腸人工肛門造設は推奨されるか?
CQ7:FAPに対する腹腔鏡下手術は推奨されるか?
CQ8:FAPの大腸腺腫に対する化学予防は推奨されるか?
CQ9:FAP患者において消化管外病変のサーベイランスは推奨されるか?
CQ10:FAPに対するカプセル内視鏡検査は推奨されるか?
CQ11:リンチ症候群の関連腫瘍に対し原因遺伝子ごとの異なるサーベイランスが推奨されるか?
CQ12:リンチ症候群では婦人科癌に対するサーベイランスは推奨されるか?
CQ13:リンチ症候群では婦人科癌に対するリスク低減手術は推奨されるか?
CQ14:リンチ症候群を診断するためにMSIやIHCのユニバーサルスクリーニングは推奨されるか?
CQ15:リンチ症候群では血縁者に対する遺伝学的検査は推奨されるか?
CQ16:リンチ症候群では初発大腸癌の術式として拡大手術(大腸亜全摘など)は推奨されるか?
CQ17:リンチ症候群では大腸癌に対する術後補助化学療法は推奨されるか?
CQ18:リンチ症候群の進行・再発大腸癌に対する化学療法は推奨されるか?
CQ19:リンチ症候群では進行・再発大腸癌に対する免疫チェックポイント阻害剤は推奨されるか?
CQ20:リンチ症候群では発がんに対する生活習慣の改善は推奨されるか?
CQ21:リンチ症候群では発がんに対する化学予防(アスピリン)は推奨されるか?
CQ22:リンチ症候群では下部消化管内視鏡サーベイランスは推奨されるか?
CQ1:FAPにおいて遺伝学的検査は推奨されるか?
臨床的にFAPと診断された患者に対し,治療法の選択やサーベイランスの参考,他の腺腫性ポリポーシスとの鑑別のために遺伝学的検査を行うことを弱く推奨する。
1.臨床的にFAPと診断されている患者に対する遺伝学的検査
FAPの診断は臨床的に診断可能な場合が多いため,必ずしも遺伝学的検査を必要としない。FAP患者の20~25%はde novo発生(新生発端者)であるため,家族歴がない場合でもAPC遺伝子に病的バリアントを持つ場合がある127)。また,de novoに発生したFAPの20%はAPCモザイク(各論Ⅱ 2-3):鑑別を要する疾患・病態参照)であるとの報告もある31)。
これまで,APC遺伝子の変異の部位(遺伝型)は,大腸腺腫数やその他の随伴病変など(表現型)との関連が数多く報告されている27,28,118,128)。そのため,遺伝型は,大腸切除術の時期,手術術式の選択,術後デスモイド腫瘍発生の予測,随伴病変のサーベイランスなどの参考になる場合がある。
2.AFAPの診断あるいはMUTYH関連ポリポーシスやポリメラーゼ校正関連ポリポーシスとの鑑別
AFAPではポリープ数が100個未満,常染色体優性遺伝に矛盾しない家族歴,随伴病変(胃底腺ポリポーシス,十二指腸腺腫,骨腫,デスモイド腫瘍,先天性網膜色素上皮肥大など)などから臨床診断は可能なことが多いが,APC遺伝子バリアントの同定は確定診断となる。
患者のみ,あるいは兄弟姉妹のみに100個未満の大腸腺腫が認められる場合には,常染色体劣性遺伝形式のMUTYH関連ポリポーシスの可能性があり,APC遺伝子の遺伝学的検査の後または同時にMUTYH遺伝子の遺伝学的検査を行うと両者の鑑別に有用である。
ポリメラーゼ校正関連ポリポーシスは,POLE遺伝子またはPOLD1遺伝子の生殖細胞系列の病的バリアントを原因とする常染色体優性遺伝性疾患であり,大腸腺腫は100個以下のことが多い37,129)。大腸癌以外の腫瘍としてはPOLE遺伝子バリアントでは十二指腸腺腫や中枢神経系腫瘍を,POLD1遺伝子バリアントでは子宮内膜癌,乳癌,中枢神経系腫瘍を併発することが報告されている38,39)。
臨床的にFAPと診断されてもAPC遺伝子バリアントが検出されない場合がある。欧米からの報告では,通常の検査方法でAPC遺伝子バリアントが検出されるのは典型的FAPの約60%であり,20~99個の大腸腺腫を認める患者では,10%にAPC遺伝子変異,7%に両アレルのMUTYH遺伝子変異を認め,10~19個の患者では,それぞれ5%と4%である20)。APC遺伝子バリアントが検出できない理由としては,①使用した解析法では検出できないようなAPC遺伝子の異常,②未知の大腸ポリポーシスの原因遺伝子の存在,③体細胞APCモザイク,④MUTYH関連ポリポーシス,⑤ポリメラーゼ校正関連ポリポーシスなどが考えられる。
CQ2:FAPに対する上部消化管サーベイランスは推奨されるか?
FAP患者では,一般集団と比較して胃癌・十二指腸癌(乳頭部癌を含む)のリスクが高いため,上部消化管サーベイランスを実施することを強く推奨する。
FAPに対する上部消化管内視鏡検査は,胃底腺ポリポーシスの有無や十二指腸腺腫,十二指腸乳頭部腺腫の同定のために初回診断時には行うことが推奨される。サーベイランスの至適間隔については,本邦における胃癌の発生率および死亡率や,他臓器の病型との相関性,家系を含む背景因子との関連等について症例の蓄積による分析が必要である。わが国のFAP患者の胃底腺ポリポーシスと胃腺腫の頻度は,それぞれ50.2~64%,14.7~39%と報告されている49,130,131)。胃底腺ポリポーシスがある場合にはHelicobacter pylori(HP)の感染が少なく,胃粘膜萎縮を認めない傾向があるが,APC変異部位や家系との特異的関連は研究段階である131,132)。FAP患者の胃癌の罹患率については,本邦からの報告によれば3.1~4.2%49,60)とされるが,欧米からの報告では0.6%とまれである46)。本邦におけるFAP患者の胃癌の報告は,胃底腺ポリポーシスを背景に発生する胃癌やHP感染による胃粘膜萎縮を背景に発生する胃癌,高度異型腺腫の合併など一般集団よりも多様であり44,133,134),定期的な内視鏡検査での早期発見例が多い130,133,134)。一方,APC遺伝子変異に起因する胃限定ポリポーシスであるGAPPS(gastric adenocarcinoma and proximal polyposis of the stomach)を背景に発症する胃癌は,悪性度が高いことから,初回診断時に鑑別が必要である135)。
FAPにおける十二指腸腺腫,十二指腸癌の頻度はそれぞれ39.2%,7.7%との報告があり49),十二指腸癌は大腸癌に次いで予後規定因子となり得る大腸外合併疾患と考えられる。十二指腸腺腫に対する積極的治療の必要性および時期,手法についてのコンセンサスはないが,今後の課題である。十二指腸乳頭部腺腫に関してはFAPに合併する頻度は52%で,長期経過による腺腫のslow growingな増大傾向が指摘されているが,癌化は1%とまれであり,腺腫に対する積極的治療の必要はないとする報告がある136,137)。
これまで,FAP患者における上部消化管サーベイランスの有用性を検討した前向き試験はないが,FAP患者では,一般集団と比較して胃癌・十二指腸癌(乳頭部癌を含む)のリスクが高いため,上部消化管サーベイランスを実施することを強く推奨する。
CQ3:FAPの十二指腸腺腫(乳頭部を除く)に膵温存手術(pancreas-sparing duodenectomy:PSD)は推奨されるか?
FAPの十二指腸腺腫に対し,PSDを実施することを弱く推奨する。
FAP患者の乳頭部を除く十二指腸腺腫において,スピゲルマン分類の病期Ⅳ以上では手術が考慮される。手術術式には,膵頭十二指腸切除術(pancreaticoduodenectomy:PD),幽門輪温存膵頭十二指腸切除術(pylorus-preserving pancreaticoduodenectomy:PPPD)あるいは膵温存十二指腸切除術(pancreas-sparing duodenectomy:PSD)がある。特に,幽門輪を温存せずに全十二指腸を切除する場合,膵温存全十二指腸切除術(pancreas-sparing total duodenectomy:PSTD)と呼ぶことがある。
一般的には,PDやPPPDが選択されるが,近年,PSDの報告が増加している。
1999~2010年にデンマークのFAPの13例に対してPSDが行われたが,3例の縫合不全を含む6例(46%)に術後合併症を認めたが,保存的に軽快した138)。オランダの多施設後方視的研究によれば,FAP患者の十二指腸腺腫に行われた十二指腸切除術の51%(43例中22例)がPSDで,術後合併症の頻度はPDやPPPDと同等であり,1999年以降の主流の術式となっている139)。本邦からは,スピゲルマン病期Ⅳの十二指腸腺腫10例に対してPSD(PSTD)を施行した単施設の報告があるが,保存的に軽快した膵液瘻を4例と,手術部位感染と胆管炎をそれぞれ1例に認めているが,いずれも程度は軽く,feasibleな治療法であるとしている140)。
1995~2012年のPSDに関する報告のまとめでは,全96例の20%で全十二指腸が切除されており,80%では幽門輪が温存されていた140)。幽門輪を温存したPSD後の残存十二指腸粘膜からの癌発生に関する明確な答えはないため,十二指腸の全切除が必要かどうかは議論の余地がある。
傾向スコアをマッチングさせた解析によれば,PSDはPDと比較して,手術時間は短く(391分vs. 460分),膵外分泌機能不全の頻度は低く(11% vs. 30%),術後合併症の頻度や予後は同等であったものの,晩期の急性膵炎の頻度が高いことが報告されている(16% vs. 0%)141)。
術前に十二指腸腺腫と診断されていても,術後の組織学的検索で9.6~30%に癌が存在していることがあるため140,142),スピゲルマン病期の進行した例では注意を要する。手術に際しては,直前には慎重に十二指腸を観察し,適切な手術術式を選択することが肝要である。
CQ4:FAP患者における症状のない腹腔内デスモイド腫瘍に対する外科的治療は推奨されるか?
FAP患者の症状のない腹腔内デスモイド腫瘍は,切除後の再発リスクが高く,自然消退する可能性もあるため,外科的切除を実施しないことを強く推奨する。
FAP患者のデスモイド腫瘍の診療に当たっては,散発性のデスモイド腫瘍と臨床的特徴が異なることを念頭に入れる必要がある。本邦においては,腹腔外,腹腔内,混合性デスモイド腫瘍に対する治療はそれぞれ86%,48%,71%の症例で外科的切除が行われていた83)。
腹腔内デスモイド腫瘍は,大腸切除後の腸間膜内に発生することが多く56-58),外科的切除を行った場合,腸管の大量切除が必要になることがある76)。腹腔内デスモイド腫瘍に関する手術療法については,完全切除例とバイパスを含む非切除例との間で生存率に差はないと報告されている86)。腹腔内デスモイド腫瘍は,完全切除しても10~68%に再発がみられることや61),5~33%が自然消退すること63-65),手術侵襲の大きさなどから78),安易な外科的治療は慎むべきである。腹腔内デスモイド腫瘍に対する外科的治療は,腸閉塞などの症状があるものに限定すべきであり143),症状のないものはChurchの分類68,71)を参考に,経過観察144)や薬物療法が推奨される。
なお腹腔外(大部分が腹壁)デスモイド腫瘍についても原則的に経過観察を行うが,運動制限等,生活の質に影響する場合には手術も考慮される。腹腔外デスモイド腫瘍切除後の再発率は高い(20~25%)が,術後合併症は少ない。切除後の再発の原因として,不完全切除だけでなく,切除創部に新たに発生する場合も考えられるので,切除する場合でも腫瘍辺縁の過剰な切除は控える85)。
CQ5:FAPに対する予防的大腸全摘術は推奨されるか?
典型的FAPに対し,予防的大腸全摘術・回腸囊肛門(管)吻合術(IPAA)を実施することを強く推奨する。
典型的FAPでは,IPAAが標準術式である92)(図20)。一般的に,回腸囊はJ型145)で作成されることが多い。IPAAは,直腸粘膜を歯状線から切除して回腸囊と歯状線を手縫いで吻合する回腸囊肛門吻合術(hand-sewn IPAA)と,外科的肛門管と回腸囊を器械吻合する回腸囊肛門管吻合術(stapled IPAA)とに大別される。前者の方が直腸粘膜の残存は少ないが,術者の熟練を要するが,IPAA後の合併症は手術チームの経験が増すとともに低下することも報告されている146)。なお,IPAAの術後には,回腸囊腺腫の発生が問題となる。男性,18歳未満,胃腺腫の合併は,回腸囊腺腫の発生リスクとして報告されており,長期的には癌化することもある147)。そのため,大腸全摘術後であっても下部消化管内視鏡検査によるサーベイランスが必要である。
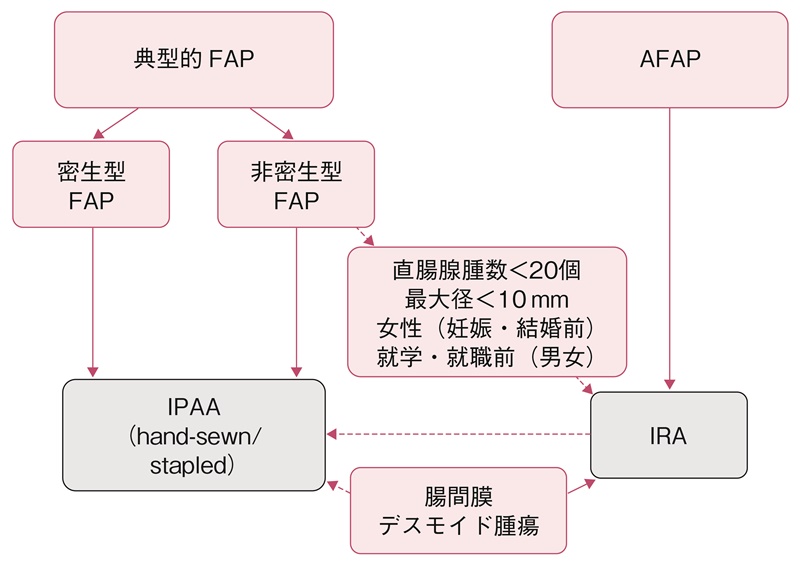
図20 FAPに対する予防的大腸切除の術式選択
AFAPや,非密生型で直腸腺腫数が20個未満かつ最大径10 mm未満の場合,若年女性で妊娠を希望するもの,就学・就職前の若年者などでは,IRAも考慮される92,148,149)(サイドメモ8:手術と妊孕性・妊娠・出産)。IPAAとIRAとの比較を表14に示す。腸間膜デスモイド腫瘍を合併する症例ではIPAAは困難な場合が多くIRAが選択されることが多いが,回腸囊が骨盤底まで届けばIPAAを行ってもよいとする見解もある12)。
表14 IPAAとIRAの比較
| IPAA | IRA | |
|---|---|---|
| 排便回数150) | 多い | 少ない |
| 夜間排便150) | 多い | 少ない |
| パッドの使用150) | 多い | 少ない |
| 便意切迫(fecal urgency)150) | 少ない | 多い |
| 術後性機能150) | 同等 | 同等 |
| 食事制限150) | 同等 | 同等 |
| 長期合併症150) | 同等 | 同等 |
| 再手術150) | 多い | 少ない |
| 残存直腸癌150) | 少ない | 多い |
| 術後デスモイド腫瘍発生58,67) | 多い | 少ない |
肛門温存術が普及する以前に行われていた大腸全摘・永久回腸人工肛門造設術は,予防的大腸切除の目的で施行されることはほとんどない93)。
大腸癌研究会の多施設共同研究によれば,予防的大腸全摘術を受けた患者の年齢は10歳代の割合が減少し,20~40歳代の割合が増えている151)。FAPの腺腫密度別(密生型,非密生型,AFAP)にみた大腸癌発生割合とその年齢は,10%が27歳,31歳,46歳で,50%が41歳,48歳,59歳であった。この結果から,典型的FAPでは,20歳を過ぎた頃より内視鏡所見を参考に予防的大腸全摘術について考慮する(各論Ⅱ 4-2):大腸腺腫の治療〔予防的大腸全摘術の手術時期〕参照)。また,AFAPにおける大腸癌の発生は比較的高齢であることから,内視鏡所見を参考に個別に決めてよい。
なお,わが国の一部の施設では手術拒否例に対し,大腸内視鏡治療によるサーベイランスが試みられている。(サイドメモ11)
サイドメモ11
FAPにおける大腸癌予防のための大腸ポリープの内視鏡的摘除
大腸内視鏡治療手技の進歩により,安全に多数の大腸ポリープを摘除することができるようになったため,手術拒否例について,多数の大腸ポリープを内視鏡的に摘除しつつ経過観察を行う研究が試みられた152)。この報告では,内視鏡治療における穿孔や重篤な出血は認められず,経過観察中に進行癌の発生も認めなかった。本研究は,単施設で行われたものであり,現在,多施設共同前向き研究が行われている。安全性と有効性をみる探索的臨床第Ⅰ・Ⅱ相試験であり,介入期間の大腸手術の有無をエンドポイントとしている。
CQ6:FAPに対する大腸全摘・回腸囊肛門(管)吻合術(IPAA)において一時的回腸人工肛門造設は推奨されるか?
FAPに対する大腸全摘・回腸囊肛門(管)吻合術(IPAA)において一時的回腸人工肛門を造設することを弱く推奨する。
IPAA術後の合併症を比較したメタアナリシスによると,一時的回腸人工肛門造設群は非造設群より縫合不全は少ないものの,吻合部狭窄,腸閉塞が多いことが報告されている153)。
一時的回腸人工肛門の造設を回避できる条件として,①器械吻合(stapled IPAA)である,②吻合部に緊張がかかっていない,③完全に吻合が行われた,④十分な止血が得られた,⑤吻合部からの空気の漏れがない,⑥栄養失調や感染,貧血,ステロイドの常用がない,などが挙げられている154)。このような観点から,IPAA術後の縫合不全や骨盤内膿瘍が生じても,なるべく軽微な状態に抑えるために,一時的回腸人工肛門を造設することは有用と考えられる。ただし,以上の報告は潰瘍性大腸炎とFAPの症例を合わせた報告であり,その内訳でもFAPの割合は少ないことに注意が必要である。
FAPのみを対象にしたIPAAの報告では,一部のstapled IPAAを除き,ほとんどの症例で一時的回腸人工肛門が造設されていた155,156)。20歳未満のFAP患者に対し一時的回腸人工肛門造設の有用性を検討した報告によると,一時的回腸人工肛門非造設例は長期的な排便コントロールは良好であるが,術後30日以内の縫合不全率は一時的回腸人工肛門造設例と比べて有意に高く(17.2% vs. 0%,p=0.002),再手術率も高かった(20.7% vs. 4.6%,p=0.02)157)。また,一時的人工肛門造設例は97例中21例にデスモイド腫瘍が発生し,一時的人工肛門非造設例は18例のみではあるが1例も認めなかったとする報告もある(22% vs. 0%)158)。ただし,対象のほとんどがstapled IPAAであり,hand-sewn IPAAにおける一時的回腸人工肛門造設についてはさらなる検討が必要である。
大腸癌研究会の多施設共同研究において,IPAAの際に一時的回腸人工肛門が造設されたのは55%であり,腹腔鏡下手術でより高率であった(77.8% vs. 38.1%,p<0.0001)94)。また,一部のhigh volume centerではhand-sewn IPAAが多く施行され,一時的回腸人工肛門造設例は少なかった159)。
一時的回腸人工肛門造設術後の人工肛門閉鎖術に関するシステマティック・レビュー160)では,人工肛門閉鎖術は安全であるが,腸閉塞を7.6%(再手術は全体の2.9%),縫合不全を2.0%,創部感染を4.0%,晩期合併症としてヘルニアを1.9%,腸閉塞を9.4%に認めるなど全体の16.5%に合併症を認めた。
以上を勘案すると,選択されたFAP症例に対し,IPAA時に一時的回腸人工肛門造設を回避することは可能であるが,その適応基準を決定するのは容易ではない。したがって,一時的回腸人工肛門造設のメリット,デメリットのバランスを考慮した上で,個別に対応するのが現実的である。
CQ7:FAPに対する腹腔鏡下手術は推奨されるか?
FAPに対する大腸切除術において腹腔鏡下手術で行うことを弱く推奨する。
近年,予防的大腸切除の術式として大腸全摘・回腸囊肛門(管)吻合術(IPAA)も結腸全摘・回腸直腸吻合術(IRA)も,ともに腹腔鏡下手術の割合が増加している(IPAA:23~53%,IRA:58~62%)119,161-163)。これまでの後方視的研究では,腹腔鏡下手術では手術時間が長いものの,術後合併症率,死亡率,再手術率,再入院率には差はなく162,164-167),整容性に優れ術中出血量も少なく,在院日数も短かった164,165,167)。また,腹腔内の癒着が少ないことから,術後腸閉塞も少なく,さらに女性では術後妊孕性の低下が少ないとの報告もある119)。術後の性機能,肛門機能も腹腔鏡下手術と開腹手術の間で差を認めなかった94,161)。また,特にIRAでは腹腔鏡下手術の方が,術後デスモイド腫瘍の発生が少ないという報告がある168,169)。2000~2012年の症例を集計した大腸癌研究会の多施設共同研究によれば,近年の腹腔鏡下手術の割合は70%を超え93),IPAAの171例中74例(43%),IRAの85例中52例(61%)に腹腔鏡下手術が行われていた94)。
大腸癌を合併するFAP患者に対する腹腔鏡下手術については,一般集団の大腸癌を対象とする開腹手術と腹腔鏡下手術を比較した大規模ランダム化比較試験が参考になる170,171)。FAP患者の進行大腸癌合併例における腫瘍学的見地からの安全性についての前向き試験は見当たらない。実際には,散発性結腸癌・直腸癌と同様のリンパ節郭清を伴う腹腔鏡下大腸全摘あるいは結腸全摘術が実地臨床では広く行われていると考えられるが,手術成績の詳細は不明である。
腹腔鏡下手術の手術時間は長いものの短期成績を含む安全性は担保されており,本疾患に対する腹腔鏡下手術は施設の習熟度(腹腔鏡下手術および本疾患に対する理解)に応じて十分なインフォームド・コンセントのもとに適応を決定する。大腸癌を合併する症例に対しても,腹腔鏡下手術は選択肢の一つになり得るが,癌の進行度,部位などを考慮の上適応を決定し,日本内視鏡外科学会の「内視鏡外科診療ガイドライン」172)などの各種ガイドラインを参考に実施する。
CQ8:FAPの大腸腺腫に対する化学予防は推奨されるか?
FAPの大腸腺腫に対する化学予防に関し,効果と安全性の面から有効な薬剤はないため,実施しないことを強く推奨する。
非ステロイド性抗炎症剤(NSAIDs)の一つであるsulindacについて,FAP患者に対する化学予防の効果を検証する研究が行われてきた。ランダム化比較試験において,sulindacの投与はFAP患者の大腸腺腫の発生を抑える効果はないが173),大腸腺腫数とサイズの増大を抑制する効果が示されている174-176)。しかし,sulindac中止後には大腸腺腫数もサイズも増大する174)。IRA後のFAP患者に対するsulindacの長期投与では,大腸腺腫数とサイズの増大,異型腺腫の発生を抑制するものの,半数に直腸粘膜障害が認められた177)。これまでにsulindacによりFAP患者の大腸癌発生リスクを低下させるというエビデンスはなく,sulindac中止後の増大や長期投与による粘膜障害を考慮すれば,sulindacの化学予防としての効果は限定的である。
COX-2選択的阻害剤であるセレコキシブによる化学予防のランダム化比較試験では178),大腸腺腫数とサイズの減少が認められたが,心血管イベントのリスク増加が問題となっている179)。魚油であるエイコサペンタエン酸はFAP患者の大腸腺腫の数とサイズを縮小したとするランダム化比較試験の報告があるが180),一般集団において大腸腺腫の発生リスクを下げる効果は認められていない181)。
CAPP1試験は,若年FAP患者(10~21歳)に対し,高用量アスピリン(600 mg/日)および難消化性デンプンによる化学予防の効果を検証するためのランダム化比較試験であるが,どちらもS状結腸~直腸の腺腫数の減少は認めなかった182)。我が国においては低用量アスピリン(100 mg/日,6~10カ月間投与)を用いた小規模な二重盲検ランダム化試験(J-FAPP StudyⅡ)が行われたが,主要評価項目である腺腫サイズの減少は見られなかった183)。FAP患者において,アスピリンにより大腸腺腫数とサイズの増大を抑制するとする報告はない。
CQ9:FAP患者において消化管外病変のサーベイランスは推奨されるか?
現時点では,FAP患者において消化管外病変のサーベイランスを行うことを弱く推奨する。
FAP患者では,甲状腺癌や脳腫瘍,副腎腫瘍などの消化管外悪性腫瘍を発生することがあり,注意が必要である。
甲状腺癌はFAP患者の2.6~11.8%に合併する60,184,185)。ほとんどが女性であり(男:女=1:44~80),平均年齢は25~33歳である。女性のFAP患者の11.1%,男性の0%に合併するという報告がある。大部分が乳頭癌であり,特に篩型(篩・モルラ型)cribriform-molula variantという特徴的な組織像を呈するものが50%以上を占める186,187)。篩型乳頭癌が見つかれば,FAPを疑い大腸内視鏡検査を行うべきである。多発性,両側性の頻度がそれぞれ28.6~69%,42~67%と高い。しかし,予後は良好であるため,必ずしも甲状腺全摘術が推奨されるわけではない188)。FAP患者のスクリーニングとして,触診に加えて超音波検査を推奨する報告がある。
FAP患者に脳腫瘍が合併することが知られている(ターコット症候群type 2)。脳腫瘍としては,髄芽腫が最も多く(約60%),星細胞腫,上衣腫,松果体芽腫,神経節膠腫,頭蓋内咽頭腫などが報告されている189)。FAP患者では,脳腫瘍を発症するリスクは一般集団の7倍(髄芽腫は92倍)であり,平均年齢は18.5歳と若い。
FAP患者の7.4~16%に副腎腫瘍が合併する190-192)。最近,Shirokyらは,FAP患者311例を調べ48例(16%)に副腎腫瘍を認め,診断時の平均年齢は45歳,両側性は23%であったと報告した190)。大部分はCT検査により偶然発見されたものであり,80%が腺腫,97%以上が良性(他に骨髄脂肪腫,過形成など),癌は1例(約2%)のみであった。
CQ10:FAPに対するカプセル内視鏡検査は推奨されるか?
FAPに対するカプセル内視鏡検査は,上部消化管内視鏡検査では観察できない範囲に悪性腫瘍の発生が疑われる場合,実施することを弱く推奨する。
FAPに対するカプセル内視鏡検査について,大腸手術後や若年者でも安全に完遂できることが報告されている193-196)。ただし,大腸手術後では,事前の通過障害の有無の確認や検査後のカプセル回収に注意しカプセル内視鏡検査を行うことが肝要である197)。乳頭部を含む十二指腸の観察に関しては,カプセル内視鏡検査よりも上部消化管内視鏡検査の方が優れている(上部消化管サーベイランスの項を参照)ことが2つの前向き試験観察研究195,196)により示されたため,可能な限り上部消化管内視鏡検査で観察することが望ましい。
FAPにおけるカプセル内視鏡検査での空・回腸ポリープの発見率は30.4~60%と報告されている193-196)。空・回腸ポリープの発生には十二指腸ポリープの発生と正の相関がみられることがメタアナリシスの結果により報告されている195)。カプセル内視鏡を用いた空・回腸ポリープの発生部位に関する研究では,29例のFAPのうち21例に小腸ポリープを認め,近位空腸では76%に認めたのに対して遠位空腸と回腸では3%であった198)。しかし,小腸ポリープからの発がん頻度は不明であり,本邦におけるFAPの空・回腸癌の報告は少なく,カプセル内視鏡検査を用いた小腸の検索の有用性は示されていないため,上部消化管内視鏡検査では観察できない範囲に悪性腫瘍の発生が疑われる場合,FAPに対するカプセル内視鏡検査を実施することを弱く推奨する。
CQ11:リンチ症候群の関連腫瘍に対し原因遺伝子ごとの異なるサーベイランスが推奨されるか?
リンチ症候群の関連腫瘍に対し原因遺伝子ごとの異なるサーベイランスを行うことを弱く推奨する。
MLH1やMSH2バリアント例はMSH6やPMS2バリアント例と比較して大腸癌発症のリスクは高い。一方,MLH1バリアント例とMSH2バリアント例の比較では大腸癌のリスクはほぼ同等である13,236)。MSH2バリアント例では大腸以外の関連腫瘍のリスクが高いとする報告が多く,特に尿路系のリスクが高い252)。MSH6バリアント例の大腸癌発症リスクはMLH1やMSH2バリアント例と比較して低いが,子宮内膜癌のリスクはMLH1やMSH2バリアント例と同等またはそれ以上である。MSH6バリアント例ではMLH1やMSH2バリアント例と比較して大腸癌(8~9年)や子宮内膜癌(3.9~5.7年)の発症年齢が高い253,254)。PMS2バリアント例の報告は限られているが,大腸癌,子宮内膜癌以外の関連腫瘍の発生は低率である255)(表20)。したがって,リンチ症候群では原因遺伝子別に関連腫瘍の発生頻度,発生時期が異なることに留意したサーベイランスを行うことが望ましい。
そこで,大腸内視鏡サーベイランスは一般に20~25歳から,または家系内で25歳未満に大腸癌が診断されている場合はその年齢より2~5年早い時期から,開始することが勧められるが,MSH6バリアント例に対しては,30歳または家系内で最も若い発症年齢より10歳早くからの開始を考慮する13,236)。PMS2については十分なデータがないが,35歳からの開始を考慮する236)。ただし,日本人における原因遺伝子別の関連腫瘍発生リスクについては十分には調べられていない。
表20 リンチ症候群関連腫瘍の70歳までの原因遺伝子別累積発症リスク
| MLH1 | MSH2 | MSH6 | PMS2 | 一般集団 | |
|---|---|---|---|---|---|
| 大腸癌 | 46~49% | 43~52% | 15~44% | 12~20% | 4.50% |
| 子宮内膜癌 | 43~57% | 21~57% | 17~46% | 0~15% | 2.70% |
| 胃癌 | 5~7% | 0.2~16% | 0~5% | ― | <1% |
| 卵巣癌 | 5~20% | 10~38% | 1~11% | ― | 1.30% |
| 腎盂尿管癌 | 0.2~5% | 2~18% | 0.7~7% | ― | <1% |
文献13)を改編
CQ12:リンチ症候群では婦人科癌に対するサーベイランスは推奨されるか?
リンチ症候群では婦人科癌に対するサーベイランスを行うことを弱く推奨する。
リンチ症候群関連婦人科癌としては子宮内膜癌と卵巣癌がある。子宮内膜癌に対するサーベイランスが,がん死低減効果を示すというエビデンスには乏しいものの,子宮内膜組織診は感度と特異度が高く,主たるサーベイランス法となり得る。検査間隔についてのエビデンスは乏しいが,1年毎の検査を考慮する256-261)。子宮内膜細胞診は正診率が高くないことから,一般的に内膜組織生検に代わるものではないが,生検と比較して検査時の侵襲が少ないため担当医の裁量で考慮してもよい。経腟超音波検査を用いた子宮内膜厚による子宮内膜癌サーベイランスについては,感度と特異度が示されていない。特に閉経前女性では月経周期に応じて子宮内膜厚が大きく変動するため,経腟超音波検査によるサーベイランスは推奨されない257-262)。主な自覚症状である不正性器出血を認めた場合には,婦人科受診を勧めるなどの啓発も重要である。
一般に卵巣癌には有効なサーベイランス法や間隔は提唱されてないが,経腟超音波断層法と血清CA-125は担当医の判断で考慮してもよい。しかし,前回の診察では陰性と判定されたにもかかわらず,次に予定された診察の前に自覚症状が出現してがんが発見される,いわゆるinterval cancerに留意が必要である。初期の自覚症状には乏しいが,下腹痛,腹部膨満感,腹囲増加,摂食困難,頻尿,尿意切迫などの症状を認めた場合には,腫瘍の増大に伴う可能性があるため,婦人科受診を勧めるなどの啓発が重要である。
近年,リンチ症候群を対象とした前向き研究で,婦人科癌に対するサーベイランスを行った場合の10年生存率が子宮内膜癌で98%,卵巣癌で89%と報告された254)。この結果が,サーベイランスの効果によるものか,リンチ症候群に発生する婦人科癌の悪性度が低いことによるものか,などについては現在のところ不明である。
CQ13:リンチ症候群では婦人科癌に対するリスク低減手術は推奨されるか?
海外では推奨されている女性リンチ症候群に対するリスク低減手術を本邦の診療体制のもとで実施するには慎重な対応が求められる。リンチ症候群女性に対しては,併存疾患や挙児希望などの状況を十分に検討した上で,リスク低減手術を行うことを考慮する。
リンチ症候群関連婦人科癌としては子宮内膜癌(子宮体癌)と卵巣癌があり,それぞれ別の臓器として検討する必要がある。
海外のガイドラインや報告では女性リンチ症候群で婦人科癌未発症者に対するリスク低減手術を,費用対効果の点を含め,推奨している13,126,237,256,258,263)。特に大腸癌の手術前は,婦人科癌のリスク低減手術の実施について検討する機会となる。
子宮全摘出術は子宮内膜癌の発生を防ぐことができるため,リスク低減手術として考慮すべき選択肢となるが,死亡率の低減効果は示されていない13,126,237,256,258,264,265)。子宮全摘出術を行う代わりに,子宮内膜生検を子宮内膜癌サーベイランスとして考慮してもよい。(CQ12)
リンチ症候群に伴う卵巣癌に対しては有効なサーベイランス法は提唱されていない。そのため遺伝性乳癌卵巣癌(hereditary breast and ovarian cancer:HBOC)に対するリスク低減法と同様の考え方から,リスク低減卵管卵巣摘出術(risk-reducing salpingo-oophorectomy:RRSO)が考慮すべき選択肢となる13,126,237,256,258,264,265)。なおリンチ症候群女性に対するRRSOは卵巣癌の発生率を低減させるものの,卵巣癌による死亡率の低減効果は示されていない13,126,237,256,258,264,265)。
子宮内膜癌・卵巣癌の発症リスクや発症年齢は,保持するMMR遺伝子の種類により異なる。現時点で本邦におけるリンチ症候群の年齢と子宮内膜癌・卵巣癌の罹患率の関係を示すデータがないが,挙児希望の有無,併存疾患(大腸癌などのリンチ症候群関連腫瘍のほか,全身性疾患も含む)や,原因となるMMR遺伝子の種類などに応じて個別化することが可能である。しかしながら,具体的な方法については標準化されていない。RRSO施行時期に応じて,卵巣欠落症状としての更年期症状,sexual activityの変化,脂質プロファイルや骨代謝への影響が危惧される。そのためRRSOを実施するには,女性医学専門家の関与も必要になる。また乳癌既往のない女性のRRSO施行後のヘルスプロモーションにホルモン補充療法が有用な場合がある。一般にリスク低減手術の施行時期は35~40歳以降が推奨されている126,235-237,256)。
近年,リンチ症候群を対象とした前向き研究で,婦人科癌に対するサーベイランスを行った場合の10年生存率が子宮内膜癌で98%,卵巣癌で89%とする報告もあり254),婦人科癌に対するリスク低減手術の有用性に関する評価には,本邦においても検証が必要である。
以上から,海外では推奨されている女性リンチ症候群に対するリスク低減手術を本邦の診療体制のもとで実施するには,施設の倫理審査委員会や診療体制について,事前に十分検討する必要がある。なおリンチ症候群に対するリスク低減手術は保険未収載である(2020年1月現在)。
CQ14:リンチ症候群を診断するためにMSIやIHCのユニバーサルスクリーニングは推奨されるか?
リンチ症候群を診断するためにMSIやIHCのユニバーサルスクリーニングを行うことを弱く推奨する。
ユニバーサルスクリーニングは年齢や家族歴によらず,全ての(あるいは70歳以下の)大腸癌や子宮内膜癌を対象としてMSI検査やミスマッチ修復タンパクに対する免疫染色を行うスクリーニング法である。ユニバーサルスクリーニングでは年齢や家族歴を利用したスクリーニングと比較して,より高い感度でリンチ症候群患者を同定することが可能である。ユニバーサルスクリーニングで同定されたリンチ症候群患者のうち,改訂ベセスダ基準を満たさない患者は12~28%と報告されている6,9,219,220,234,266)。ユニバーサルスクリーニングは,詳細な家族歴聴取の難しさや核家族化などの点からも有用で,海外のガイドラインで感度や費用対効果の点から推奨されている13,126,235-238)。
ただし,ユニバーサルスクリーニングから得られた大腸癌患者におけるリンチ症候群の頻度については,海外から2.4~3.7%8,9),わが国から0.7%と報告されており10),本邦ではリンチ症候群の頻度が海外と比べて低い可能性がある。さらに,発端者一人あたりの血縁者診断実施人数については,海外から3.6名と報告されているが267),わが国からはデータが乏しい。また,わが国では,高齢者大腸癌の頻度が増加しているが,70歳以上での初発大腸癌がリンチ症候群である可能性はきわめて低いこともあり10),わが国におけるユニバーサルスクリーニングの評価は定まっていない。
CQ15:リンチ症候群では血縁者に対する遺伝学的検査は推奨されるか?
リンチ症候群では,血縁者に対する遺伝学的検査を行うことを強く推奨する。
家系員の一人がリンチ症候群と診断された場合,その血縁者は高い確率でバリアント保持者となる。バリアントを保持していることが判明した血縁者にはサーベイランスなどによって健康リスクを低減することができる。さらに,病的バリアントを保持しないことが判明した家系員は過度な検診を避けることができる。したがって,家系内にリンチ症候群の既知の病的バリアントが認められる場合,血縁者に遺伝学的検査を検討することを強く推奨する。
第1度近親者,さらに第2度近親者と順にたどっていくと効率が良い。遺伝学的検査を受ける時期は,がんの若年(10歳代,20歳代)発症の家族歴がない限り,18歳以降である268)。自分の意思で遺伝学的検査を受けるかどうかを決定する。
すでに発症している患者の診断を目的として行われる遺伝学的検査の事前の説明と同意の確認は,原則として主治医が行うが269),発がんしていない血縁者の遺伝学的検査に際しては,その前後に遺伝カウンセリングが必要である。情報提供だけではなく,患者・被検者等の自律的選択が可能となるような心理的社会的支援が重要であることから,リンチ症候群の診療経験が豊富な医師と遺伝カウンセリングに習熟した者が協力し,チーム医療として実施することが望ましい269)(https://jams.med.or.jp/guideline/genetics-diagnosis.html)。
CQ16:リンチ症候群では初発大腸癌の術式として拡大手術(大腸亜全摘など)は推奨されるか?
リンチ症候群の初発大腸癌に対する術式として拡大手術を行うことを弱く推奨する。
リンチ症候群に対する術式では,結腸亜全摘あるいは結腸全摘を拡大手術として,散発性大腸癌の術式である大腸部分切除と比較した後方視的観察研究が主である。メタアナリシスでは大腸部分切除で22.4~22.8%,拡大手術で4.7~6.8%に異時性大腸癌が発生し,大腸部分切除は異時性大腸癌発生の危険性を有意に増加させる270,271)。このため,初発大腸癌の術式として拡大手術は異時性大腸癌発生の危険性を確実に低下する目的で推奨されている236)。一方,死亡率に関しては両手術間に差を認めない〔大腸部分切除の相対リスク1.65(95%信頼区間:0.90~3.02)〕271)との報告があるが,十分な議論がなされておらず,わが国からの初発大腸癌の術式に関連するデータは乏しい66,272)。
また,リンチ症候群の初発大腸癌の15%程度が直腸癌であるが,直腸切除(切断)術を施行された症例における異時性大腸癌は,ほとんどが右側結腸癌で,平均14カ月間隔で内視鏡サーベイランスを行った場合の異時性多発大腸癌の累積発生率は,10年:19%,20年:47%,30年:69%とする後方視的観察研究がある273)。直腸癌が初発の場合に,大腸全摘術を選択するかどうかのデータは乏しい。
MMR遺伝子に異常があると診断され,未だ大腸癌に罹患していないバリアント保持者に予防的大腸切除を行うか否かについてもコンセンサスは得られていない。リンチ症候群の大腸癌の生涯発生リスクは男性で54~74%,女性で30~52%であり,生涯を通じて大腸癌を発生しないバリアント保持者が少なからず存在することから,FAPのように一律に予防的大腸切除を勧めることはできない。
したがって,リンチ症候群の異時性大腸癌のリスク,サーベイランスの必要性とその限界,予防的切除の意義,術後のQOL,併存疾患の状態などをバリアント保持者に説明し,バリアント保持者自身が対応を決定するのが望ましい。
CQ17:リンチ症候群では大腸癌に対する術後補助化学療法は推奨されるか?
リンチ症候群では,StageⅢ大腸癌に対する術後補助化学療法を行うことを強く推奨する。
リンチ症候群の大腸癌について,特異的な化学療法のエビデンスはほとんどないため,散発性MSI-H大腸癌に準じて考えられる場合が多い。ただし,リンチ症候群の大腸癌と散発性MSI-H大腸癌にはBRAF V600Eバリアントの頻度やメチル化の状態など,既知の相違点があることを認識しておく必要がある。実際,5-FUベースの術後補助化学療法が,散発性MSI-H大腸癌には有用性がないが,リンチ症候群が疑われる50歳未満のMSI-H大腸癌においては有用性があるとする報告もあり274),散発性MSI-H大腸癌とリンチ症候群の大腸癌を別に考える必要性も示唆されている。なお,リンチ症候群および散発性MSI-H直腸癌に対する術後補助化学療法に関する有用なデータはほとんどない。
Stage Ⅱ/Ⅲの散発性大腸癌を対象に,MSIの状態と5-FUベースの術後補助化学療法の有効性について行われたメタアナリシスでは,MSI-H大腸癌はMSS大腸癌より予後は良いが,術後補助化学療法により生存期間および無再発生存期間の改善が認められなかった275,276)。しかし,第Ⅲ相試験であるNSABP-C07試験,MOSAIC試験において,術後補助化学療法におけるオキサリプラチンの上乗せ効果はMSI-H,MSS結腸癌のいずれにも認められた277)。したがって,現状ではStage Ⅲ結腸癌においてMSIの状態により術後補助化学療法の適応を判断することは推奨されない。Stage Ⅱ大腸癌における術後補助療法の有用性は確立されておらず,特にMSI-Hの場合は予後良好であるため,その有用性は低いと考えられている。
CQ18:リンチ症候群の進行・再発大腸癌に対する化学療法は推奨されるか?
リンチ症候群の進行・再発大腸癌に対し化学療法を行うことを強く推奨する。
Stage Ⅳの散発性大腸癌においてはStage Ⅱ/Ⅲに比べてMSI-Hを示す頻度が低いことが示されている278,279)。リンチ症候群あるいはMSI-Hの進行・再発大腸癌に特異的な化学療法に関し,十分な検討は行われておらず結論は得られていない。したがって,散発性大腸癌に一般的に選択されるレジメンが適応となり得る。なお,散発性MSI-H大腸癌において,5-FUに抵抗性となった後の二次治療としてイリノテカンの奏効率がMSI-Hの場合に有意に良好であるとする報告がある280)。CALGB/SWOG80405試験は進行再発大腸癌に対し,一次治療で化学療法+ベバシズマブまたはセツキシマブ併用療法の有効性を比較した第Ⅲ相試験であり,両者のOSに有意差が得られなかった。この試験に対し,網羅的遺伝子解析が行われた結果,MSI-H大腸癌において,セツキシマブを併用するよりもベバシズマブを併用する方が有意差をもって生存期間を延長し,MSS大腸癌においてはどちらの併用療法でも有意差がつかなかった281)。原発部位の影響による可能性もあるため,MSI-H大腸癌と分子標的薬の有効性に関しては今後の臨床研究の結果を待って判断する必要がある。
CQ19:リンチ症候群では進行・再発大腸癌に対する免疫チェックポイント阻害剤は推奨されるか?
リンチ症候群では,進行・再発大腸癌に対し免疫チェックポイント阻害剤の治療を行うことを強く推奨する。
MSI-H/dMMR*大腸癌,MSI-H/dMMRの大腸癌以外の固形癌,MSS大腸癌を対象とし三次治療以降におけるペムブロリズマブの有効性を解析した第Ⅱ相試験(KEYNOTE-016)では,奏効率はそれぞれ40%,71%,0%でありMSI-H/dMMR固形癌に対する抗PD-1抗体の有効性が示された282)。12種類の癌腫に対象を広げた全86例のMSI-H/dMMR固形癌に関する続報において奏効率53%(大腸癌52%,大腸癌以外54%)と良好な結果であった。また,そのうちリンチ症候群に関連する癌での奏効率は46%,関連しない癌では59%であり,同等の結果であった283)。
MSI-H/dMMR大腸癌を対象とし三次治療以降におけるニボルマブ単剤あるいはニボルマブ+イピリムマブ併用の有効性を検討した第Ⅱ相試験(CheckMate142)においては,ニボルマブ単剤の奏効率は31%であり,ニボルマブ+イピリムマブ併用の奏効率は55%であった。Grade 3/4の治療関連有害事象はそれぞれ20%および32%であった284,285)。このうち臨床データからリンチ症候群に関連する癌はそれぞれ36%,29%含まれており,奏効率は33%,71%と全体の結果と同等であった。
また,リンチ症候群の大腸癌は約90%がMSI-H/dMMRを呈することが知られている。したがって,リンチ症候群では進行・再発大腸癌に対し免疫チェックポイント阻害剤の治療を行うことを強く推奨する。
* dMMR:免疫染色でMMRタンパク発現消失
CQ20:リンチ症候群では発がんに対する生活習慣の改善は推奨されるか?
リンチ症候群では発がんに対する生活習慣の改善を行うことを強く推奨する。
リンチ症候群の場合,大腸癌のリスクを低下させるには,適正体重の維持,禁煙の他に,食生活,飲酒,運動に関わるリスク因子がいくつか示されている。
Body mass index(BMI)高値は,腺腫や大腸癌の発症リスクを増大させることが示され,平均体重の範囲内で留めることが推奨されている235)。後方視的観察研究で特に,BMI>25 kg/m2の男性では大腸癌のリスクが増加することが示されている286)。さらに,ランダム化比較試験で肥満はMLH1バリアントを有する場合大腸癌リスクが3.72倍となるが,アスピリンを服用している場合やMSH2またはMSH6バリアントを有する場合にはリスク増加はみられないこと287),などが報告されている。症例対照研究や後方視的観察研究で喫煙は大腸癌リスクを増加させるため235,288,289),禁煙が推奨されている。特に過去ではなく現在喫煙している方が大腸腺腫のリスクを高くすることが示されている290)。その他,後方視的観察研究でマルチビタミンとカルシウムのサプリメントの摂取が大腸癌のリスクを低下させること291),症例対照研究や前方視的観察研究で果物の摂取量を増やすと大腸癌リスクが減少すること292,293),症例対照研究や前方視的観察研究でアルコール摂取による大腸癌リスクの増加や若年発症化がみられること293-295),後方視的観察研究で身体活動が増えると大腸癌リスクの減少が示唆されること296),などが報告されている。
CQ21:リンチ症候群では発がんに対する化学予防(アスピリン)は推奨されるか?
リンチ症候群では,現時点で発がんに対する化学予防としてアスピリン投与を行わないことを弱く推奨する。
CAPP2試験はリンチ症候群の関連腫瘍と大腸腺腫の発生率に関し,アスピリン(600 mg/日)の予防効果を二重盲検で評価した初めてのランダム化比較試験である。4年間の介入直後の大腸腺腫の発生予防においては有意な差は得られなかったが,長期間の経過観察の結果的,大腸癌の発生および大腸癌以外のリンチ症候群関連腫瘍の発生について,2年以上アスピリンが投与された群において有意な予防効果が示された297)。さらなるCAPP2の解析により,肥満のリンチ症候群患者の大腸癌発生リスクは1 kg/m2増加するごとに7%増加することがわかったが,アスピリンの投与によりこのリスク増加は消失した287)。
ただし,アスピリンの長期内服は胃腸障害などのリスクが高まる。また,一般集団に対するアスピリンの大腸癌リスク低減効果に関して,体重依存性,すなわち特定の用量に固定した場合,至適体重でなければ不利益が利益を上回る可能性も報告されている298)。このため,現時点で発がんに対する化学予防としてアスピリンの投与を行わないことを弱く推奨する。
現在リンチ症候群を対象としたCAPP3試験において低用量アスピリン(100 mg/日)を含むアスピリンの至適用量および投与期間が検討されている。
CQ22:リンチ症候群では下部消化管内視鏡サーベイランスは推奨されるか?
リンチ症候群では,下部消化管内視鏡サーベイランスを行うことを強く推奨する。
リンチ症候群では,大腸癌の術後で大腸が残存している例を含め大腸癌の発生リスクが高いことが示されており,前癌病変である腺腫の摘除と大腸癌の早期発見を目的とした定期的かつ生涯にわたる内視鏡サーベイランスが必要である13,236)。サーベイランスの開始年齢は,20~25歳を推奨する報告が多い13,236)。
検査の間隔に関しては,Järvinenらの前向き研究で,3年間隔の内視鏡サーベイランスにより大腸癌による死亡が65%抑制されることが報告されたが299),いくつかの観察研究で3年毎の内視鏡検査の間に進行癌の発生が確認されたことから,検査間隔を1年に短縮することも提唱されてきた126,300,301)。しかし,1年から3年までの検査間隔で比較したところ,大腸癌の発生率やその病期に有意差を認めなかったとする報告もあり302,303),コンセンサスは得られていない。ただし,これらの海外の術後の大腸内視鏡サーベイランスの報告では,内視鏡検査の品質保証に関する指標となり得る腸管洗浄度,盲腸到達率,腺腫発見率,観察時間などに関する記載に乏しい。またStageⅠ以外で発見されるinterval cancerの割合も高いことを考慮する必要がある。今後,精度の高い大腸内視鏡でのサーベイランスの報告が待たれる。
リンチ症候群の大腸腺腫の特徴として,数は多くなく(一般に十数個以内),若年(40歳未満)発症で,サイズが大きく,しばしば絨毛状を呈し,MSI-Hを示すことがあり,通常の腺腫より小さくても異型度が高く,癌化までの期間が短い,などが挙げられている300,304-306)。発がんメカニズムもいくつかの経路が想定されているが307),大腸内視鏡検査時に区別することは困難であるため,腫瘍性病変の発見時には大きさに関わらず積極的な内視鏡的摘除の対象とする。









