
総論
1 目的
厚生労働省の「全国がん登録の概要」によれば,わが国における2016年の大腸癌罹患数は158,000人と部位別がん罹患数の第1位,「人口動態統計」によれば2018年の大腸癌死亡数は5万人を超えており第2 位となっている。このような状況のなかで,大腸癌の治療成績を向上させることは国民にとって非常に重要な課題となっている。そこで大腸癌治療ガイドライン(以下,本ガイドライン)は,さまざまな病期・病態にある大腸癌患者の診療に従事する医師(一般医および専門医)を対象として,以下の(1)から(4)を目的として作成された。
| (1) | 大腸癌の標準的な治療方針を示すこと |
| (2) | 大腸癌治療の施設間格差をなくすこと |
| (3) | 過剰診療・治療,過小診療・治療をなくすこと |
| (4) | 一般に公開し,医療者と患者の相互理解を深めること |
本ガイドラインの作成効果として,①日本全国の大腸癌治療の水準の底上げ,②治療成績の向上,③人的・経済的負担の軽減,④患者利益の増大に資すること,が期待される。
2 使用法
本ガイドラインは,文献検索で得られたエビデンスを尊重するとともに,日本の医療保険制度や診療現場の実状にも配慮した大腸癌研究会のコンセンサスに基づいて作成されており,診療現場において大腸癌治療を実践する際のツールとして利用することができる。具体的には,個々の症例の治療方針を立てるための参考となることのほかに,患者に対するインフォームド・コンセントの場でも活用できる。ただし,本ガイドラインは,大腸癌に対する治療方針を立てる際の目安を示すものであり,記載されている以外の治療方針や治療法を規制するものではない。本ガイドラインは,本ガイドラインとは異なる治療方針や治療法を選択する場合にも,その根拠を説明する資料として利用することもできる。ただし,その際には患者および家族に十分な説明を行って同意を取得すること。第三者にも受け入れられるような論理性・倫理性を担保することが重要である。
本ガイドラインの記述内容については大腸癌研究会が責任を負うものとするが,個々の治療結果についての責任は直接の治療担当者に帰属すべきもので,大腸癌研究会およびガイドライン委員会は責任を負わない。
3 対象
本ガイドラインの利用対象者は,大腸癌診療に携わる全ての臨床医が中心である。
4 作成法
1)作成の経過
2003年に大腸癌研究会のガイドラインプロジェクト研究として,大腸癌治療ガイドラインの作成作業が開始された。作成されたガイドライン(案)は評価委員会での評価を経て,2005年7月に『大腸癌治療ガイドライン医師用2005年版』として刊行された。その後,改訂版として2009年7月に『大腸癌治療ガイドライン医師用2009年版』,2010年7月に『大腸癌治療ガイドライン医師用2010年版』,2014年1月に『大腸癌治療ガイドライン医師用2014年版』,2016年7月に化学療法領域のみを改訂した『大腸癌治療ガイドライン医師用2016年版』が刊行された。2019年1月に全領域に及ぶ改訂作業が行われた『大腸癌治療ガイドライン医師用2019年版』が刊行された。その後,新型コロナウイルス感染症によるパンデミックの中,本邦において「切除不能な遠隔転移を有する症例の原発巣切除に関する臨床試験」「肝転移治癒切除後の補助化学療法に関する臨床試験」などの結果が明らかになるとともに,免疫チェックポイント阻害薬,BRAF阻害薬などが相次いで保険収載された。2021年7月の第95回大腸癌研究会で公聴会を開催し,その後大腸癌研究会ホームページでパブリックコメントを募集,広く意見を求めた。それらを参考に修正を加え評価委員会へ提出,評価委員会の意見を参考にさらに修正を加え2022年1月に『大腸癌治療ガイドライン医師用2022年版』を刊行するに至った。
2)作成の原則
本ガイドラインは,大腸癌の標準的な治療方針の理解を助けるために各種治療法と治療方針の根拠を示すが,各治療法の技術的問題には立ち入らない。
3)記載方法
治療方針のアルゴリズムを提示し,それに関する解説を簡潔に記載し,さらに解説が必要な事項に関してはコメントを追加するという,初版のコンセプトを継承した。2009年版より,ガイドライン作成委員会の合議のもとに,議論の余地のある課題をclinical question(CQ)として取り上げ,推奨文を記載する形式も併用した。2019年版では,この形式を継承し,かつ,薬物療法領域のCQについて2016年版,他の領域においては2014年版刊行以降の知見を踏まえ,CQの修正・追加を行った。
2022年版では,この形式を継承し,「Stage Ⅳ大腸癌の治療方針」および「薬物療法」の本文およびそれに関連するCQについて2019年版刊行以降の知見を踏まえ,修正・追加を行った。
また,CQに用いる表現は,明瞭で,あいまいでないように努め,複数の介入を比較する場合は,すべてに順位付けすることに固執せず,臨床の現場でも役立つように,柔軟な表現を心がけた。
CQの解説においては,理解しやすく過不足のない長さであることを重視し,多数の臨床試験に言及する場合は,研究結果に関する具体的な数値等の記載は簡略化した。
臨床病理学的用語については,『大腸癌取扱い規約第9版』に準拠した。
4)CQのエビデンスのレベル・推奨の強さ
CQに対する推奨文には,下記の作業によって決定したエビデンスのレベル,推奨の強さを付記した。
4-1)エビデンスのレベル
CQに関する論文を網羅的に収集し,CQが含む重大なアウトカムに関して個々の論文が提示するエビデンスを研究デザイン1)でグループ分けし,GRADE*システムを参考にして文献レベル・エビデンス総体を評価し(表1),最終的にCQ のエビデンスのレベルを決定した(表2)。
*GRADE:The Grading of Recommendations Assessment, Development and Evaluation


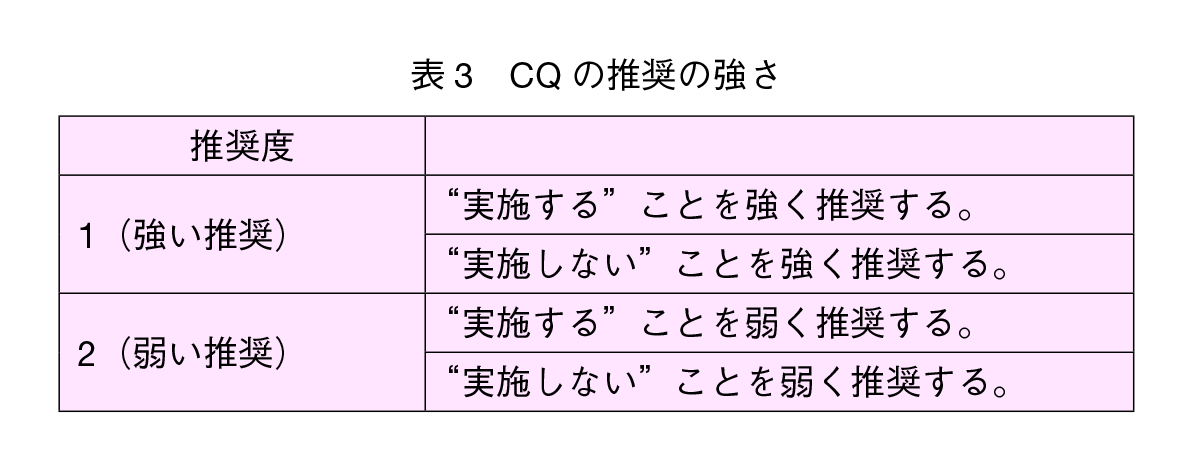
4-2)推奨の強さ
上記の作業によって得られたアウトカムとエビデンスのレベルをもとに推奨文案を作成し,ガイドライン作成委員によるコンセンサス会議において推奨文案を評価し,推奨の強さを決定した(表3)。CQ本文においては決定した推奨を直截に表現し,多様な表現を排除した。
推奨の強さは,推奨文案について,①エビデンスの確かさ,②患者の嗜好,③益と害,④コストの4項目に分けて評価し,GRADE Grid法に準じた投票に基づいて決定した。
- 〔方法〕
-
- 1.
- 下記の5つの選択肢から1つ選び投票
①「行うことを強く推奨する」,
②「行うことを弱く推奨する」,
③「行わないことを弱く推奨する」,
④「行わないことを強く推奨する」,
⑤「推奨度なし(推奨度がつけられない,Not graded)」 - 2.
- 1回の投票で,①~⑤のいずれかに,全体の70%以上の投票が得られれば,そのまま決定した。
この条件に該当しない場合,
- ①+②が50%を超え,③+④が20%を超えていない場合,「行うことを弱く推奨する」。
- ③+④が50%を超え,①+②が20%を超えていない場合,「行なわないことを弱く推奨する」。
- 3.
- 1回目の投票では2の条件をいずれも満たさなかった場合は,「合意に至らなかった」として,投票結果を開示しつつ日本の医療状況を加味した再協議を行い,再投票を行った。
- 4.
- 2回目の投票でも合意に至らない場合は「推奨度なし」とした。
5 文献検索法
はじめに各CQについて文献検索した後,必要に応じて検索式を立て直して検索を行った。2019年版においては,前版の採択文献に加える最新の文献を調査するため,PubMedおよび医学中央雑誌インターネット版を検索データベースとし,両データベースの2012年6月より2017年2月までの英語および日本語の文献を検索した。ただし,薬物療法領域については,検索期間の始点を2016年8月とした。
検索は医学図書館員が行い,2017年3月を検索日として各項目の担当委員と相談しながら検索式を立てて文献を抽出した。また,必要に応じてUpToDateなどの二次資料および用手検索で抽出した文献も追加して批判的に吟味し,会議録やガイドラインなども適宜採用した。
2022年版においては部分改訂であるため,上記の方法に則って,CQ6,9,15,17‒19,21‒24に関連する論文について2017年3月より2021年2月までの英語および日本語の文献を検索した。追加検索数2,037,追加選択数529であった。
2019年版および2022年版の文献検索,選択結果を合わせたものを表1に示した。文献検索で抽出された17,862文献(PubMed 10,925文献,医中誌6,937文献,用手検索623文献)から選択した3,824文献を入手して全文を批判的に吟味した。
6 改訂
本ガイドラインは,原則として4年を目途に大腸癌研究会のガイドライン委員会を中心組織として改訂を行う。ただし,治療方針に重大な影響を及ぼす新知見が確認された場合は,改訂に先んじて速報を出すなどの対応を考慮するものとする。
7 公開
本ガイドラインが日本全国の診療現場で広く利用されるために,小冊子として出版し,学会等のホームページで公開する。
2019年1月現在公開されているウェブサイト。
・大腸癌研究会
・日本医療機能評価機構医療情報サービス(Minds)
・日本癌治療学会
8 一般向けの解説
一般人が大腸癌治療の理解を深めること,患者・医師の相互理解や信頼が深まることを期待して,2006年1月に『大腸癌治療ガイドラインの解説』を出版し,2009年1月には『大腸癌治療ガイドラインの解説』の改訂版を出版した。2014年7月には『患者さんのための大腸癌治療ガイドライン2014年版』を出版し,大腸癌研究会のホームページで公開している。2022年1月には『患者さんのための大腸癌治療ガイドライン2022年版』を出版した。
9 資金
本ガイドラインの作成に要した資金は大腸癌研究会の支援によるものであり,その他の組織や企業からの支援は一切受けていない。
10 利益相反
1)ガイドライン作成委員,ガイドライン評価委員の自己申告により利益相反の状況を確認した結果,申告された企業は下記の如くである。
アッヴィ合同会社,Array Biopharma Inc.,EAファーマ株式会社,MSD株式会社,秋田住友ベーク株式会社,アステラス製薬株式会社,インテュイティブサージカル合同会社,エイツーヘルスケア株式会社,エーザイ株式会社,大塚製薬株式会社,小野薬品工業株式会社,オリンパス株式会社,カイゲンファーマ株式会社,株式会社MRP,株式会社島津製作所,株式会社JIMRO,株式会社メディサイエンスプラニング,株式会社ヤクルト本社,協和発酵キリン株式会社,ギリアド・サイエンシズ株式会社,コヴィディエンジャパン株式会社,サノフィ株式会社,塩野義製薬株式会社,シスメックス株式会社,ジョンソン・エンド・ジョンソン株式会社,生化学工業株式会社,第一三共株式会社,大日本住友製薬株式会社,大鵬薬品工業株式会社,武田薬品工業株式会社,田辺三菱製薬株式会社,中外製薬株式会社,テルモ株式会社,ナノキャリア株式会社,ニプロ株式会社,日本イーライリリー株式会社,日本ケミファ株式会社,日本ベーリンガーインゲルハイム株式会社,日本臨床研究オペレーションズ株式会社,バイエル薬品株式会社,パレクセルインターナショナル株式会社,ファイザー株式会社,富士フイルム株式会社,ブリストル・マイヤーズ スクイブ株式会社,メルクバイオファーマ株式会社,持田製薬株式会社
2)利益相反に対する対策
委員会は,外科,内科,放射線科,病理等の多分野の構成とし,意見の偏りを最小限にした。さらに,すべての推奨決定は各担当ではなく議長(委員長)を除く全員投票とし,コンセンサスを重視した。また,CQの投票に際してはCQごとに経済的利益相反および学術的利益相反について確認し,当該CQに利益相反のある委員は投票を棄権した。
11 ガイドライン委員会
ガイドライン委員会
| 委員長 | |||||
| 橋口陽二郎 | |||||
| 副委員長 | |||||
| 山口研成 | |||||
| 薬物療法領域責任者 | |||||
| 山口研成 | |||||
| 内視鏡領域責任者 | |||||
| 斎藤 豊 | |||||
| 外科領域責任者 | |||||
| 金光幸秀 | |||||
| 放射線領域責任者 | |||||
| 室伏景子 | |||||
| 病理領域責任者 | |||||
| 味岡洋一 | |||||
| 委員(五十音順) | |||||
| 石川敏昭 | 石黒めぐみ | 石原聡一郎 | 上野秀樹 | 上原 圭 | 岡 志郎 |
| 加藤健志 | 絹笠祐介 | 塩澤 学 | 篠崎英司 | 谷口浩也 | 中島貴子 |
| 長谷川潔 | 堀田欣一 | 松田圭二 | 村田幸平 | 森田智視 | 山﨑健太郎 |
| 吉田雅博 | |||||
アドバイザー
吉野孝之
ガイドライン評価委員会
| 委員長 | |||||
| 板橋道朗 | |||||
| 委員(五十音順) | |||||
| 植竹宏之 | 坂巻顕太郞 | 佐野圭二 | 島田安博 | 田中信治 | 山口茂樹 |
協力者
| 小林宏寿 | 小澤毅士 | ||||
| 文献検索 | |||||
| 山口直比古 | |||||









