患者さんのための大腸癌治療ガイドライン 2022年版
ガイドラインを理解するための基礎知識
1 大腸とは
解剖学的位置
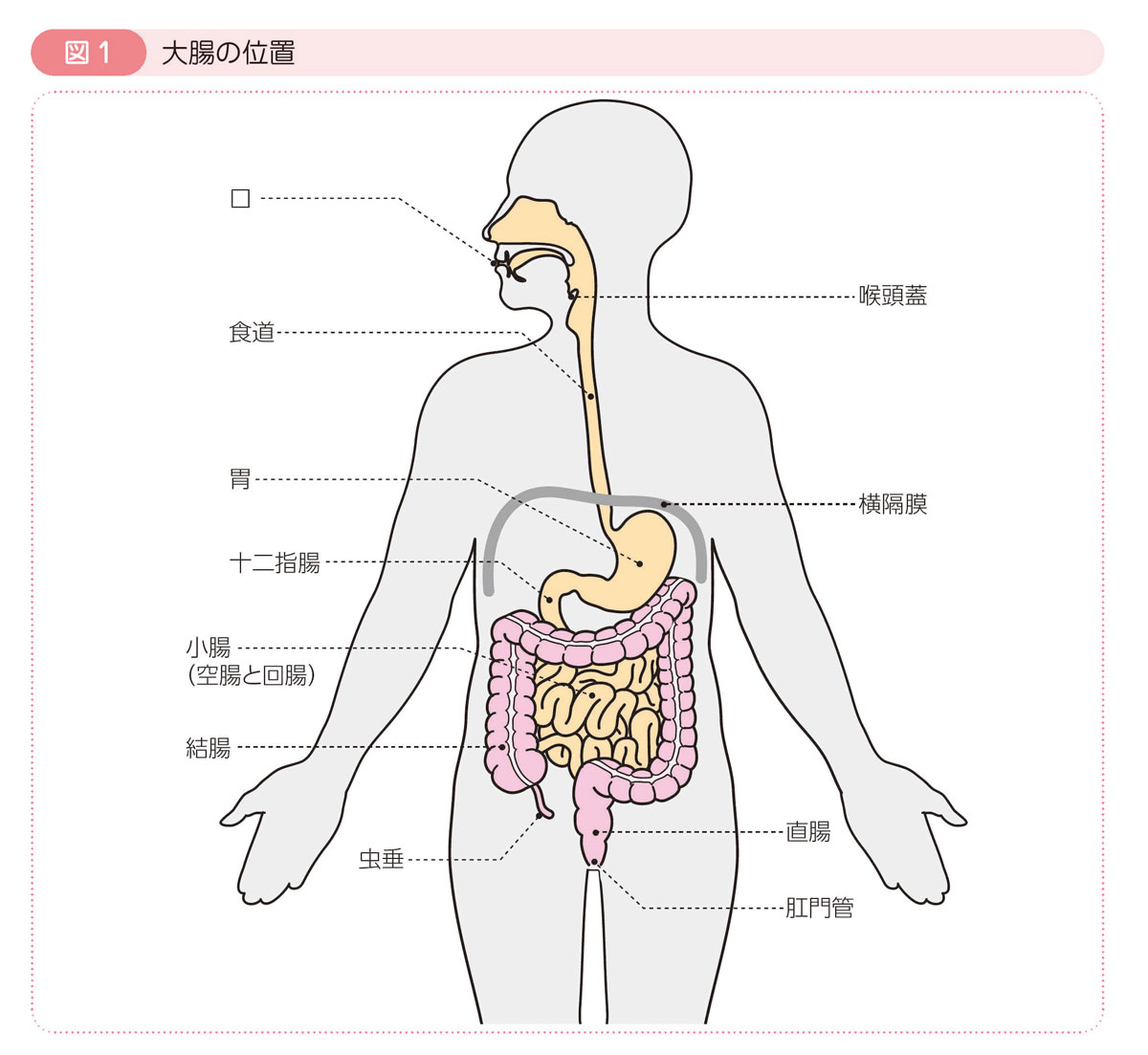
大腸は1.5~2mほどの長さの臓器で,結腸と直腸に分けられます。
大腸は小腸に続いて,右下腹部から始まり,右上腹部→左上腹部→左下腹部へ至り,肛門へつながります。
各部位の名称
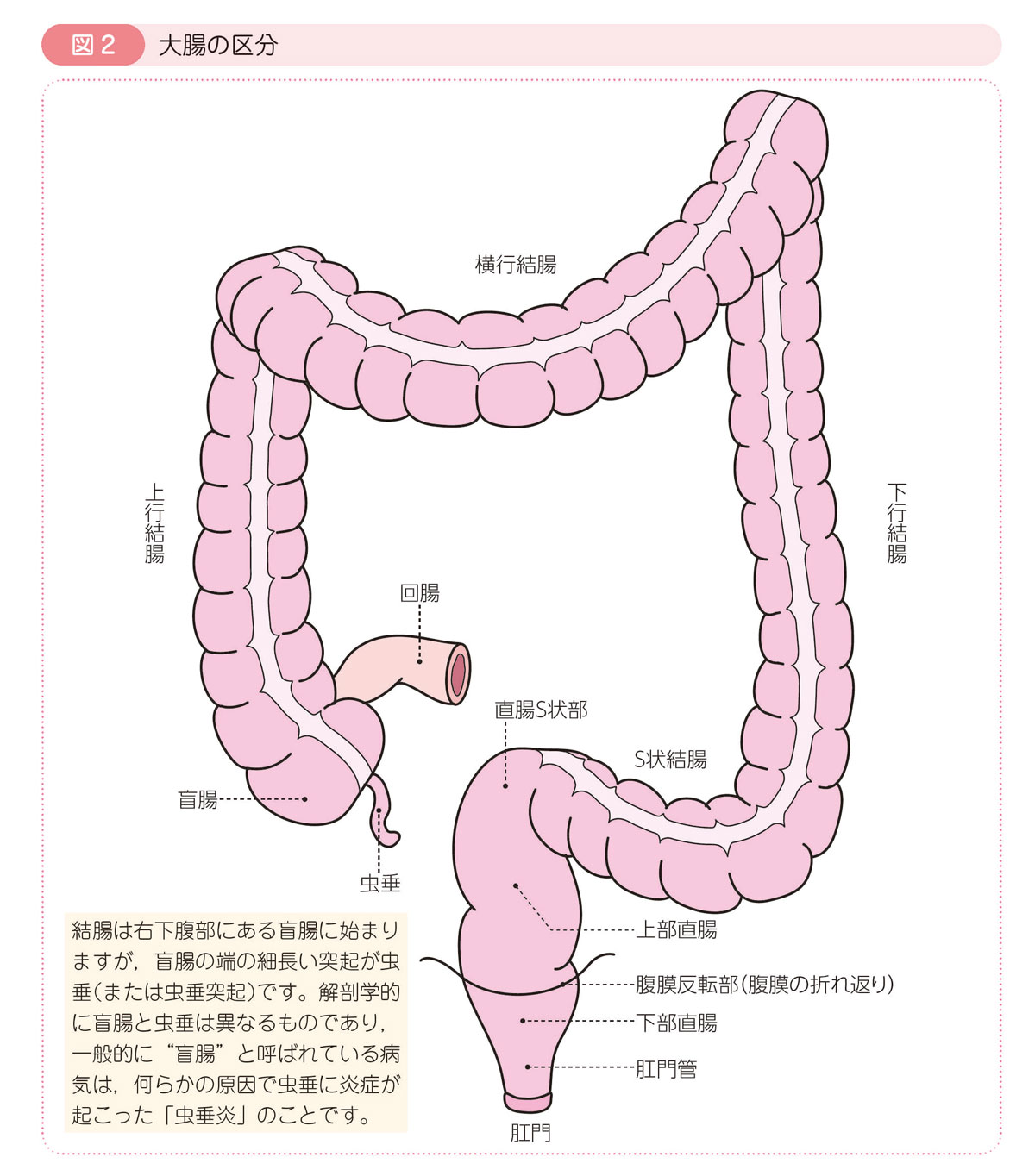
結腸は盲腸,上行結腸,横行結腸,下行結腸,S状結腸に分けられます。
直腸は直腸S状部,上部直腸,下部直腸に分けられます。
なお,虫垂と肛門管は大腸とは区別して取り扱われます。虫垂と肛門管に発生した癌のなかには,大腸癌とは生物学的な性格が異なるために,大腸癌の治療方針が当てはまらないものがあります。
血液の流れ
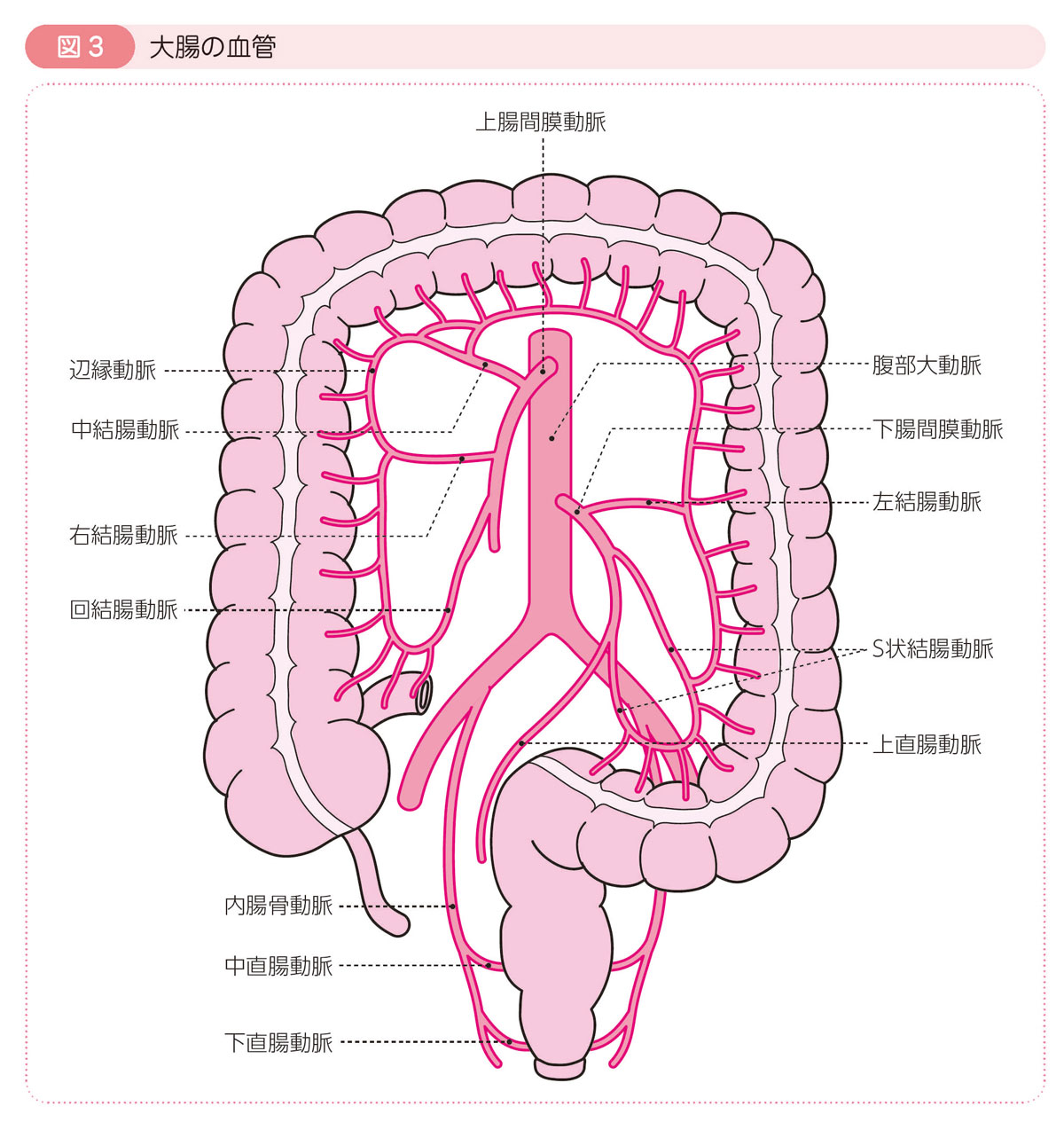
右側の大腸(盲腸,上行結腸,横行結腸)は上腸間膜動脈,左側の大腸(下行結腸,S状結腸,直腸S状部,直腸)は下腸間膜動脈から分かれた動脈から血液の供給を受けています。
リンパの流れ(リンパ系)
リンパ管の中にはリンパ液が流れています。
リンパ液は,血管の外へ染み出した血液中の血漿という成分やたんぱく質が,全身にはりめぐらされた毛細リンパ管に再吸収されたものです。
リンパ液は古くなった細胞や不要となった物質をリンパ管を通して運びます。
リンパ液の中のリンパ球は,からだに侵入したウィルスや細菌などに対抗する働きがあります。
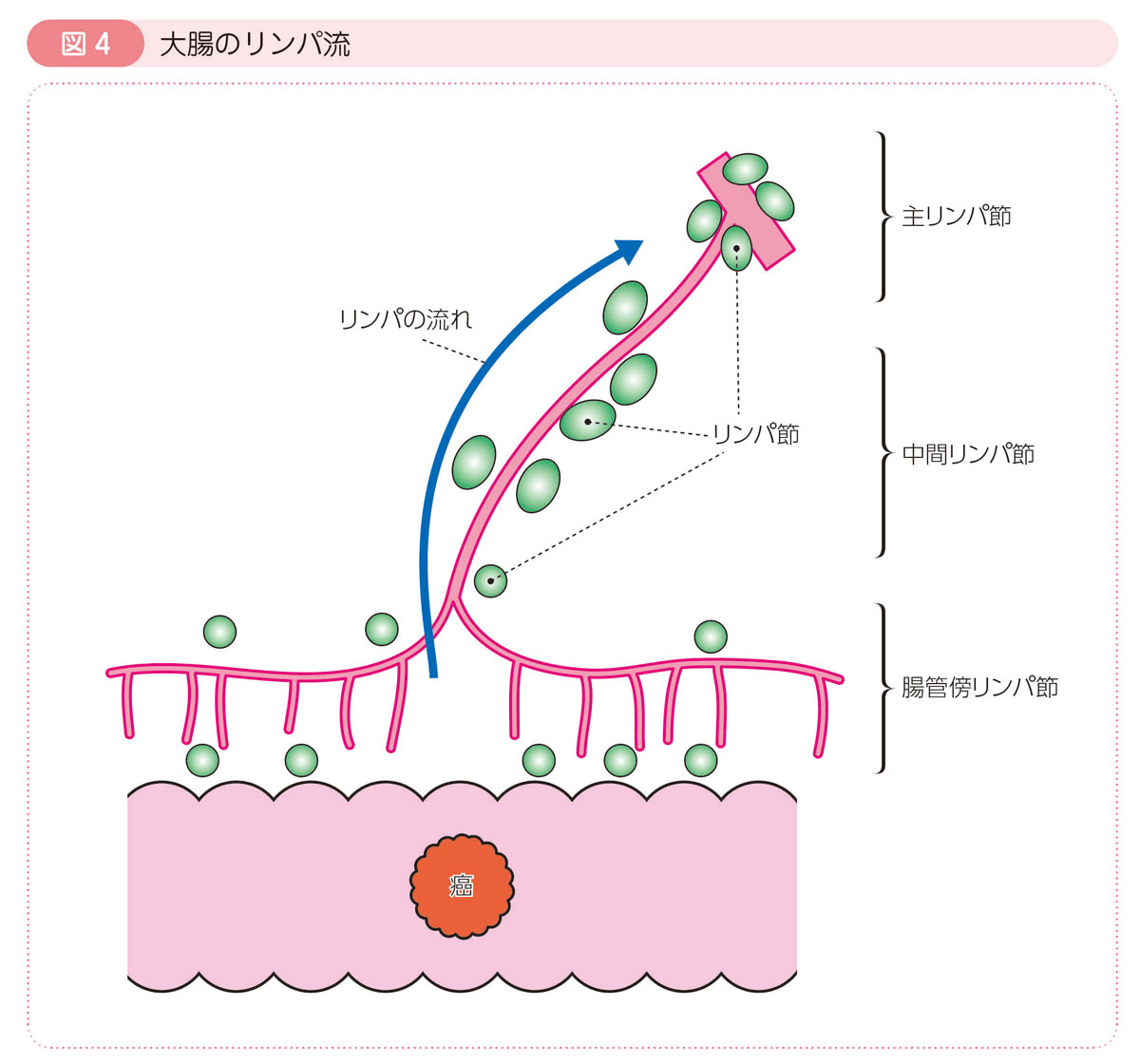
大腸から出るリンパ管は,大腸の近くの動脈に沿って存在しており,中継地点としていくつものリンパ節を伴っています(Q4-1参照)。
癌のある腸管の近くのリンパ節を腸管傍リンパ節,動脈に沿ったリンパ節を中間リンパ節,動脈の起始部にあるリンパ節を主リンパ節といいます。
これらのリンパ節は,手術の際にリンパ節の郭清(「手術治療」,Q4-2参照)を行うための指標となります。
神経の走行(神経支配)
大腸は,胃や小腸などと同様に,交感神経と副交感神経によりその働きが調整されています。
特に,肛門に近い直腸の周囲には,交感神経と副交感神経が密にネットワークを形成した領域(骨盤内神経叢)があり,直腸だけでなく膀胱,前立腺などの働きも調整しています。手術の際に神経を切除すると排尿障害や性機能障害を起こすことがあります(Q5-2参照)。
- 自律神経:
- 自律神経は自分の意思とは無関係に内臓や血管などを調節する神経で,体の活動性をあげる交感神経と休息・回復させる副交感神経からなり,両者がバランスを取りながら働いています。腸管については,腸の動き(蠕動)は副交感神経が優位に働くと活発になります。
- 排尿障害:
- 排尿を自分の意志で調節できなくなること。
- 性機能障害:
- 直腸がんの術後には,神経の障害により男性では勃起や射精が困難となることがあります。女性については性交渉への影響などが想定されますが,データは乏しく明らかとはなっていません。
大腸壁の構造
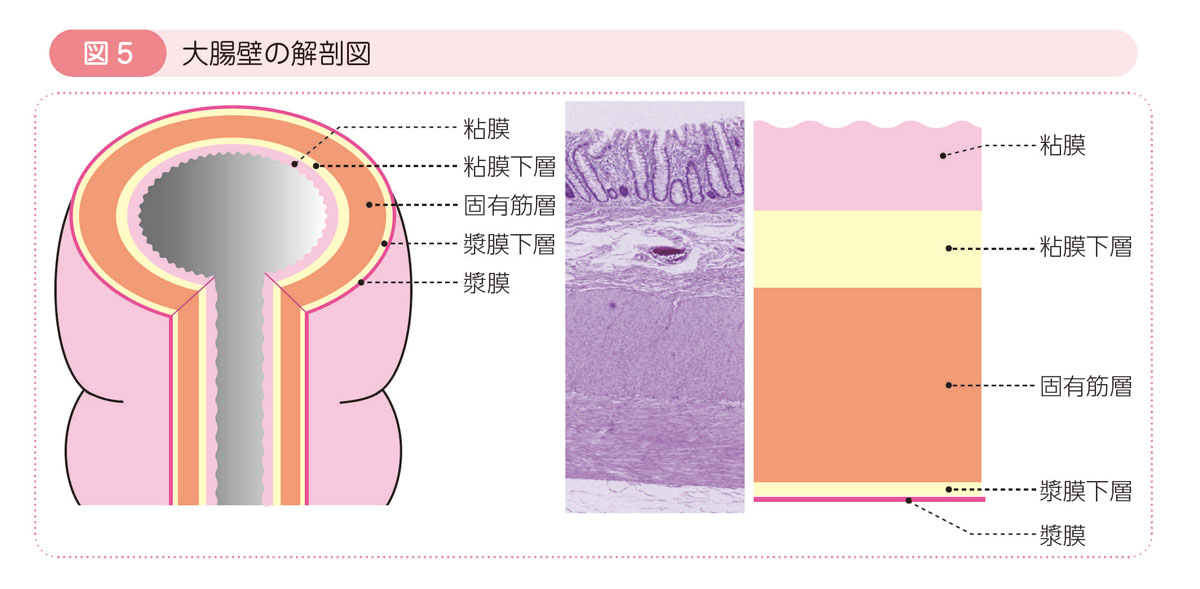
大腸の壁は内側から順に,粘膜,粘膜下層,固有筋層,漿膜下層,漿膜の5つの層で構成されています。
大腸の働き
大腸は,回腸から流入した液状の便から,水分,脂肪酸の一部,ナトリウムなどを吸収し,固形の便にして肛門に運びます。
2 大腸癌とは
大腸に発生した腫瘍(細胞が異常に増えて塊になった状態のもの)で,周囲の組織に浸潤や転移(「大腸癌の広がり方」参照)を起こすものが大腸癌です。大腸癌は悪性腫瘍であり,浸潤や転移を起こす能力のない腺腫などの良性腫瘍とは区別されます。
大腸癌が発生するしくみ
大腸癌が発生するしくみには2つの経路があると考えられています。一つは腺腫という良性のポリープが悪性化して発生する場合(腺腫–癌連関),もう一つは正常粘膜から直接癌が発生する場合(デノボ癌)で,多くは前者の経路と考えられています。上記の経路には,多くの遺伝子の異常(変異)が関与しており(多段階発癌),発癌を促進する癌遺伝子や,発癌を抑制している癌抑制遺伝子の異常により癌は発生します。腺腫—癌連関においては癌抑制遺伝子であるAPC 遺伝子に異常が起こることにより腺腫が発生し,そこに癌遺伝子であるK-ras 遺伝子や癌抑制遺伝子であるp53 遺伝子の異常が加わり癌化していくと考えられています。デノボ癌の遺伝子異常の詳細は明らかとはなっていません。癌細胞は分裂を繰り返し,何十億から何百億にまで増えると目に見える大きさになります。
遺伝的素因
全大腸癌の患者さんの約70%は上記のように遺伝子異常(変異)が重なって発生すると考えられ,これを散発性大腸癌といいます。一方で,生まれながらに持っている遺伝子の異常が原因で大腸癌が発生することがあり,これを遺伝性大腸癌といいます。大腸癌全体の約5%と頻度は低いですが,血縁者に大腸癌が多く発生します。残りの約20~30%の患者さんでは,明らかな原因は不明ですが何らかの遺伝的素因の関与が推察され,血縁者にしばしば大腸癌を認めることから家族集積性大腸癌と呼ばれます。
原因遺伝子が判明している代表的な遺伝性大腸癌には,リンチ症候群と家族性大腸腺腫症(FAP)があります。原因遺伝子によって,大腸癌発症のリスク,合併する腫瘍の種類や頻度は異なりますが,この2つの疾患はいずれも「常染色体優性遺伝」といって,親から子へ50%の確率で原因となる遺伝子の異常が受け継がれます。この生まれながらに受け継いだ遺伝子の異常に,のちに何らかの別の遺伝子異常が加わることで癌化すると考えられています。
リンチ症候群
- 遺伝子の異常を修復する遺伝子(ミスマッチ修復遺伝子)の異常が原因の,常染色体優性遺伝の疾患です。
- 関係する遺伝子としては,MLH1,MSH2,MSH6,PMS2,EPCAMなどが分かっています。
- 大腸癌全体の約4%を占めます。
- 大腸癌だけでなく子宮内膜癌,卵巣癌,胃癌,小腸癌などの癌のリスクが高く,一般的な大腸癌より若年で発症することが特徴の一つです。
- 血縁者に上記の癌が多い場合や若年発症の方がいる場合には,より詳細な検査(スクリーニング検査:MSI検査,または免疫染色)でリンチ症候群の可能性を絞り込み,最終的には遺伝子診断で診断確定となります(「遺伝カウンセリング」参照)。
- 他の癌の合併も念頭において,早期発見を目的とした検査が推奨されます。
家族性大腸腺腫症(FAP)
- 癌抑制遺伝子であるAPC遺伝子の変異が原因の,常染色体優性遺伝の疾患です。
- 大腸癌全体の約1%を占めます。
- 大腸に100個以上の腺腫(良性のポリープ)があるか,100個未満でもFAPの家族歴がある場合(家族にFAPの患者さんがいる場合)に疑われ,遺伝子診断で診断確定となります(「遺伝カウンセリング」参照)。
- FAPの患者さんでの大腸癌の発生は,40代で約50%,60歳頃にはほぼ100%と報告されています。
- 大腸以外にも,デスモイド腫瘍(線維腫症),十二指腸癌などを伴うことがあります。
- FAPと診断された場合には大腸癌の早期発見のため10歳を過ぎたころから1~2年間隔での大腸内視鏡検査が推奨されています。
- 治療としては,大腸癌が発生する前に大腸をすべて切除すること(予防的大腸全摘術)が標準的で,20代での手術が推奨されています。
- 遺伝カウンセリング:
-
- 遺伝カウンセリングとは,患者さんが持っている遺伝に関わる悩み,不安,疑問などを相談できる場です。科学的根拠に基づいて正確に,わかりやすく説明するとともに,心理的ケアも行いながら,問題解決への支援を行うことを目的としています。
- 遺伝性大腸癌と診断された場合,あるいは疑われる場合には,患者さんご本人のほかに家族(血縁者),特に第1度近親者(親,子,兄弟姉妹)にも遺伝カウンセリングを行ったうえで,診断確定のための検査を相談する必要があります。
- 遺伝性大腸癌は,通常の大腸癌と異なり様々な他の病変を伴うことがあるため,複数の診療科で長期間の経過観察が必要となります。
- 遺伝性大腸癌の検査は遺伝カウンセリングの体制のある医療機関での実施が推奨されます。
大腸癌の肉眼的形態
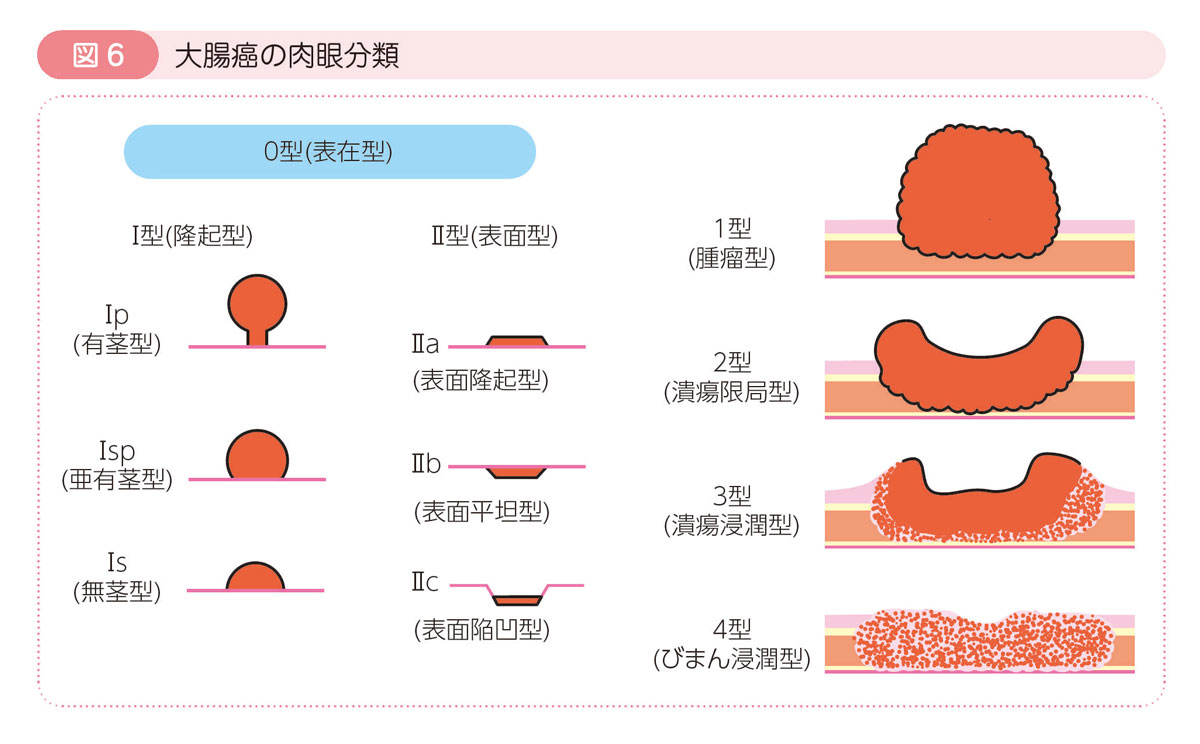
大腸癌は見た目の形(肉眼形態)により,0型~5型に分類されています。
- 表在型(0型):
- 粘膜または粘膜下層までにとどまる癌で,隆起型と表面型に分けられます。
- 腫瘤型(1型):
- 腫瘍全体が塊状となり,腸の内側に出っ張っているもの。
- 潰瘍限局型(2型):
- 腫瘍の中央が陥凹し,周りの盛り上がり(周堤)の境界がはっきりしているもの。
- 潰瘍浸潤型(3型):
- 2型よりも周堤がくずれて,正常な粘膜との境界がはっきりしない部分があるもの。
- びまん浸潤型(4型):
- 癌が周囲に不規則に広がっているもの。スキルス型と呼ばれることもあります。
- 分類不能(5型)
0 型は,さらに以下のように細分類されています。
-
隆起型(Ⅰ)
- 有茎型(Ⅰp)
- 亜有茎型(Ⅰsp)
- 無茎型(Ⅰs)
-
表面型(Ⅱ)
- 表面隆起型(Ⅱa)
- 表面平坦型(Ⅱb)
- 表面陥凹型(Ⅱc)
3 大腸癌の患者数
日本人の死因の第1位は悪性新生物(癌)であり,一生のうちに癌と診断される確率は2人に1人,癌で亡くなる確率は4~6人に1人といわれています。
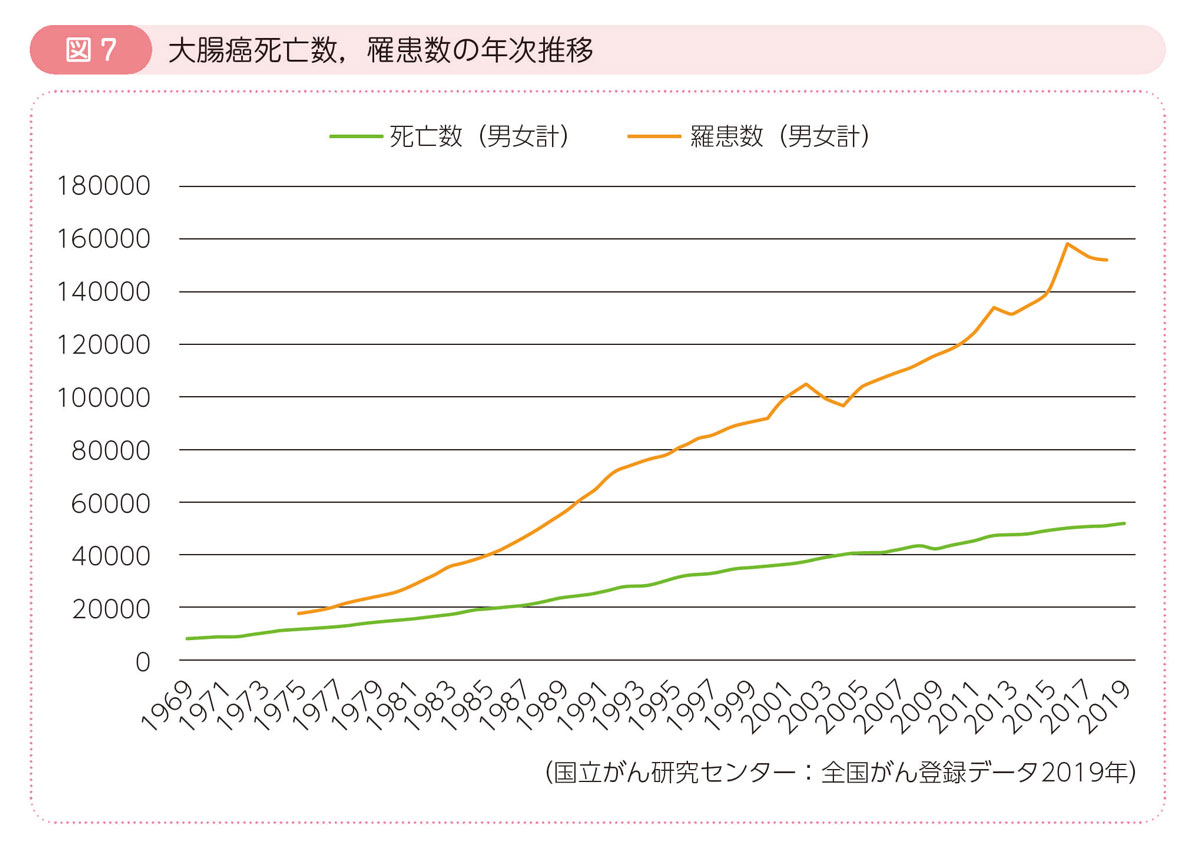
国立がん研究センターの全国がん登録データによると,2019年に癌で亡くなった人の数は約37万6千人と報告されており,癌の種類別にみると,大腸癌の死亡数は女性では第1位,男性では肺癌,胃癌に次いで第3位,男女を合わせると第2位となっています。過去との比較では,1969年には男性4,083人,女性4,201人でしたが,2019年には男性27,416人,女性24,004人と,半世紀で約6倍になっています(図7)。この理由としては,食生活の欧米化や運動量の減少などが関係していると考えられています。
また,2018年に新たに診断された癌患者さんの数(罹患数)は約98万人と非常に多く,癌の種類別にみると,大腸癌の罹患数は女性では乳癌に次いで第2位(65,840人),男性では前立腺癌,胃癌に次いで第3位(86,414人),総数では胃癌,肺癌をおさえ,第1位となっています。年齢別の罹患率では40歳を超えたあたりから上昇し,中高年に多く認められています。
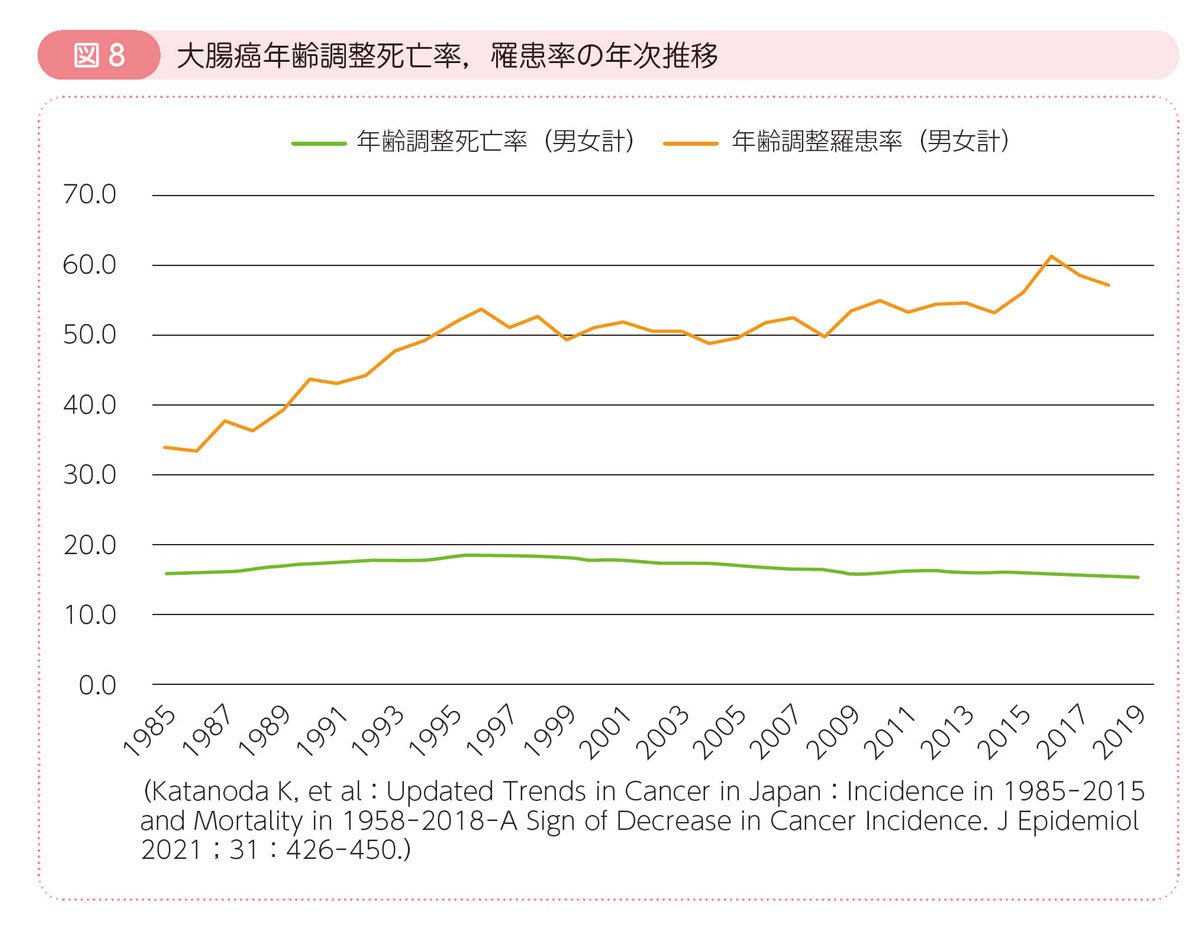
医療の進歩にも関わらず,死亡数,罹患数とも増え続けているのはなぜでしょう?その理由の一つは高齢化社会です。癌は年齢があがるほど発症しやすいため,高齢化社会である日本ではその影響を強く受けていることが考えられます。つまり高齢者が増えれば大腸癌で亡くなる方も,大腸癌になる方も増えるということです。そこで,高齢化の影響を除く“年齢調整”を行った統計で見てみると,大腸癌の死亡率は男女とも減少傾向にあり,罹患率は男性で横ばい,女性でゆるやかな増加にとどまっているとの報告もあります(図8)。まだまだ大腸癌の治療成績は満足できるものではありませんが,がん検診の普及,内視鏡技術の進歩,手術技術の向上,薬物療法の開発など,さまざまな取り組みが良好な結果に結びつくことが期待されます。
4 大腸癌の広がり方
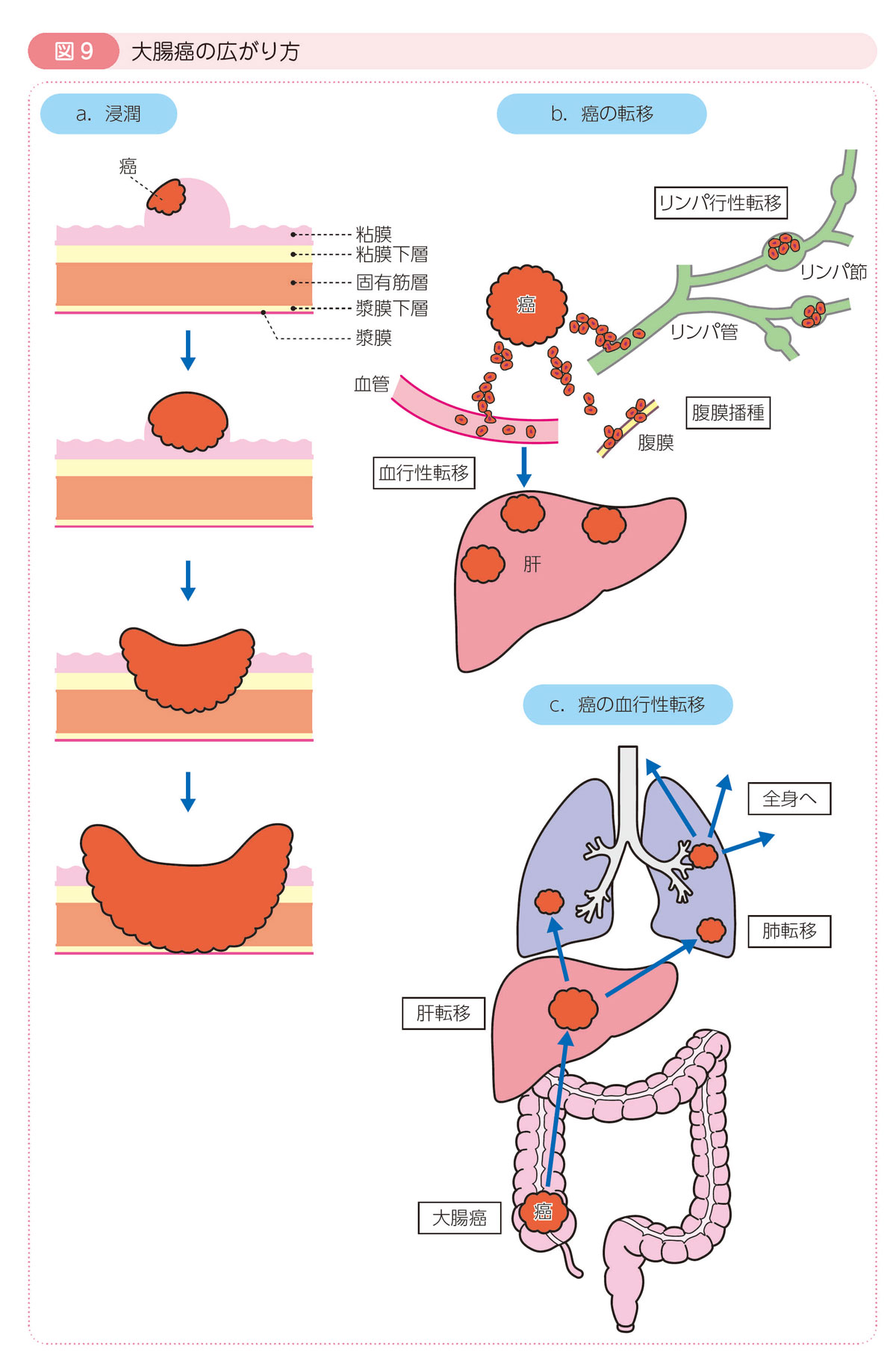
大腸癌は大腸の粘膜に発生した後,大腸で増殖して大きくなるとともに,転移により全身に広がっていきます。
転移とは,最初に癌が発生したところから離れた場所に飛び火して増殖することです。最初に癌が発生したところを原発巣,飛び火したところを転移巣といいます。
大腸癌の広がり方には,浸潤,リンパ行性転移,血行性転移,腹膜播種があります。
浸潤
大腸癌は腸の一番内側の粘膜にできて,腸の壁を破壊しながらだんだん大きくなり,最後に腸の壁を突き破って周囲の臓器に広がっていきます。このような癌の広がり方を浸潤といいます。
リンパ行性転移
リンパ管は,血管のようにからだ中に張り巡らされています。
リンパ管は途中にリンパ節という節目があり,そこからさらに枝分かれしていきます。このように,リンパ管とリンパ節は,線路と駅の関係に似ています。
リンパ管に侵入した癌細胞は,途中のリンパ節に流れ着いて増殖します。これをリンパ行性転移といいます。癌細胞は次のリンパ節に流れていき,次第に遠く離れたリンパ節にも転移していきます。
リンパ節転移の仕方には,一定の規則性があり,リンパ液の流れに沿って,近くから遠くのリンパ節に広がっていきます。
血行性転移
癌細胞が腸の細い静脈に侵入し,大腸から離れた臓器に流れついて,そこで増殖することを血行性転移といいます。
大腸からの血流は,まず肝臓に集まることから,大腸癌で最も血行性転移の頻度が高いのが肝臓です。次に頻度が高いのは肺転移です。癌が進行すると,骨や脳などの全身の臓器に血行性転移を起こすこともあります。
腹膜播種
“播種”という文字が表すように,種が播かれるように癌が転移することです。
増大した癌は腸の壁を突き破って,腸管を覆う腹膜に顔を出します。
そこから腹腔内に散らばった癌細胞は,芽を出すように大きくなります。
進行すると,腹膜播種がお腹の中全体に広がり,腹水,発熱,嘔吐などの症状がみられる癌性腹膜炎となります。
ステージ分類(病期分類)
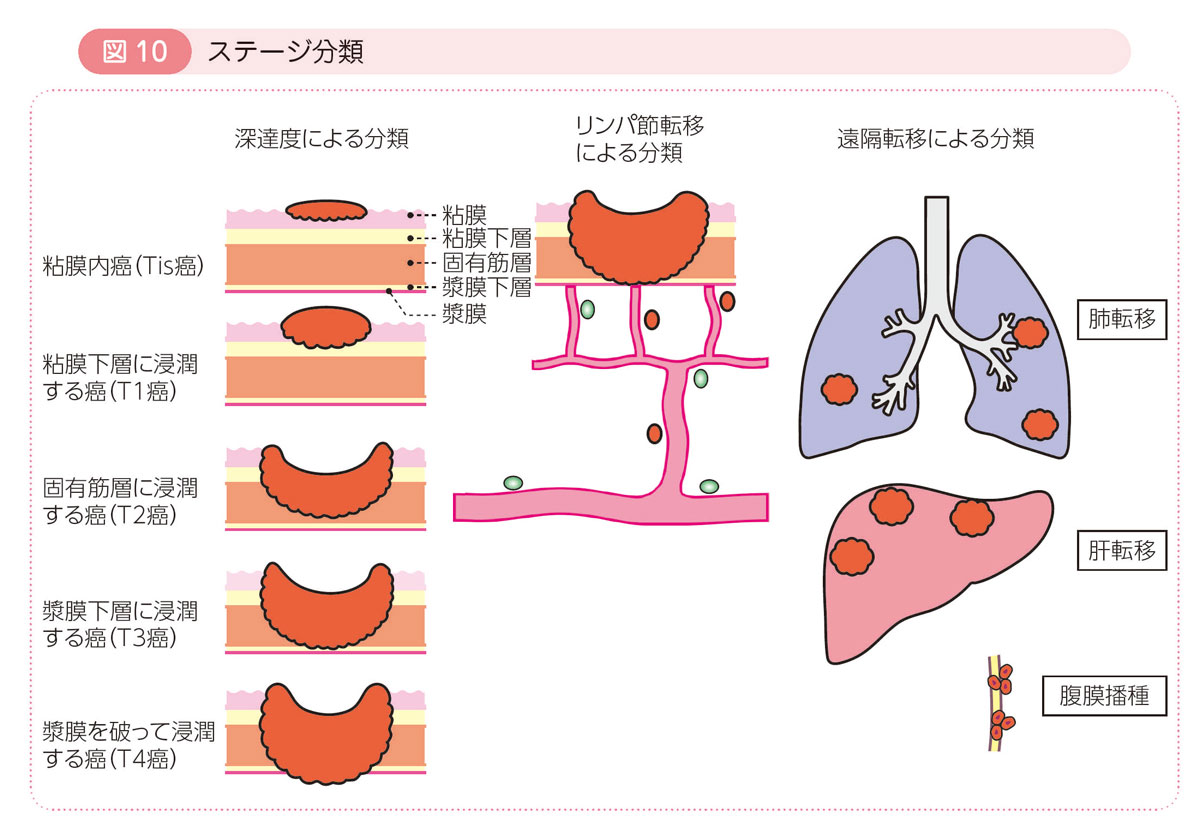
癌の広がり具合(進行度)をステージ(病期)で表します。
ステージは,癌が大腸の壁に入り込んだ深さ(深達度),どのリンパ節までいくつの転移があるか(リンパ節転移の程度),肝臓や肺など大腸以外の臓器や腹膜への転移(遠隔転移)の有無によって決まります(表1)。

ステージ0が最も進行度が低く,ステージIVが最も進行度が高い状態です。
治療方針を立てる上で,治療前にステージを正確に予測することが重要です。
ステージ分類には,治療前にCTなどの画像診断で予測する臨床分類ステージと,切除された大腸などの組織を顕微鏡で調べた結果をあわせて判断する病理分類ステージがあります。手術前に補助療法が施行された場合などには,治療前後でステージがかわることもあります。一般に,病理分類ステージが最終的なステージとして,術後補助療法導入の指標などに用いられます(Q2参照)。
5 大腸癌による症状
早期大腸癌では,ほとんど症状はありません。
進行すると,下血,血便,便秘・下痢,便が細くなる,貧血,腫瘤(しこり),腹痛,腸閉塞などの症状が現れます(図11)。
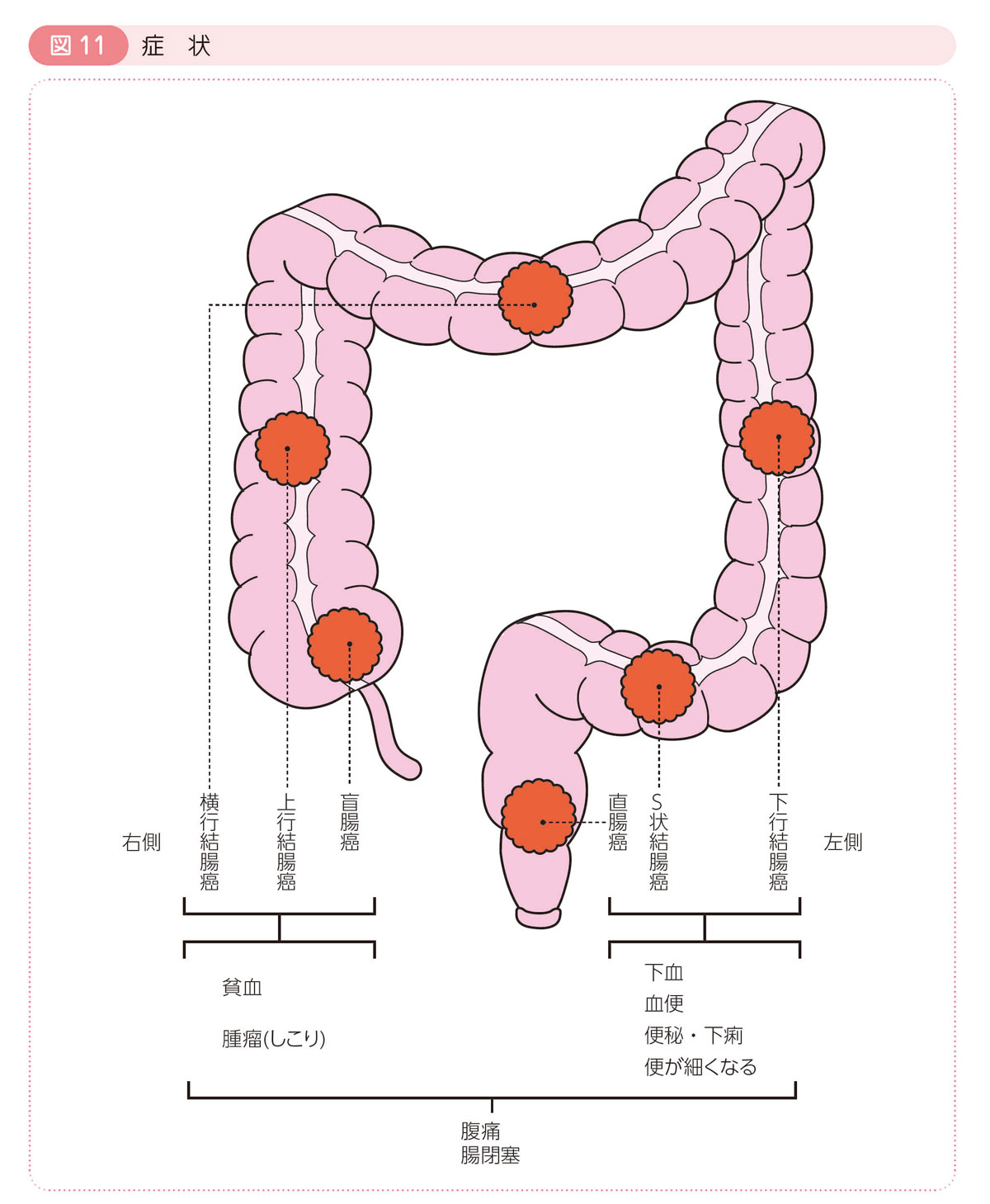
これらの症状は癌の部位によって差があります。
右側の大腸癌は大きくなるまで症状がでにくく,腫瘤(しこり)として見つかることが多く,慢性的な出血による貧血も見られます。一方,左側の大腸癌は出血(下血,粘血便),便秘・下痢,便が細くなるなどの症状をきっかけに診断されることが多いのが特徴です。
6 大腸癌の検査法
1 検診法
症状がない人から大腸癌の可能性のある人をひろい上げる方法。
● 便潜血検査
便の中に混じった血液を検出する検査法です。大腸癌に対する集団検診(対策型検診)として行われています。便潜血検査で陽性であれば,大腸内視鏡検査や注腸造影検査を行い,病気の有無を調べます。
「有効性評価に基づく大腸がん検診ガイドライン(2005年版)」において死亡率減少効果を示す十分な証拠があることから,大腸がん検診として,便潜血検査(とりわけ免疫法)が強く推奨されています。全大腸内視鏡検査(およびS状結腸内視鏡検査,S状結腸内視鏡検査と便潜血検査の併用法,注腸X線検査)には死亡率減少効果を示す根拠はあるものの,苦痛や合併症が起こりえますので任意型検診(人間ドックなど)として実施されています。
2 診断法
● 直腸指診
肛門から直腸内に指を挿入し,直腸内の腫瘍(良性ポリープや癌)を検索します。
直腸指診で直腸癌が見つかることも少なくありません。
● 注腸造影検査
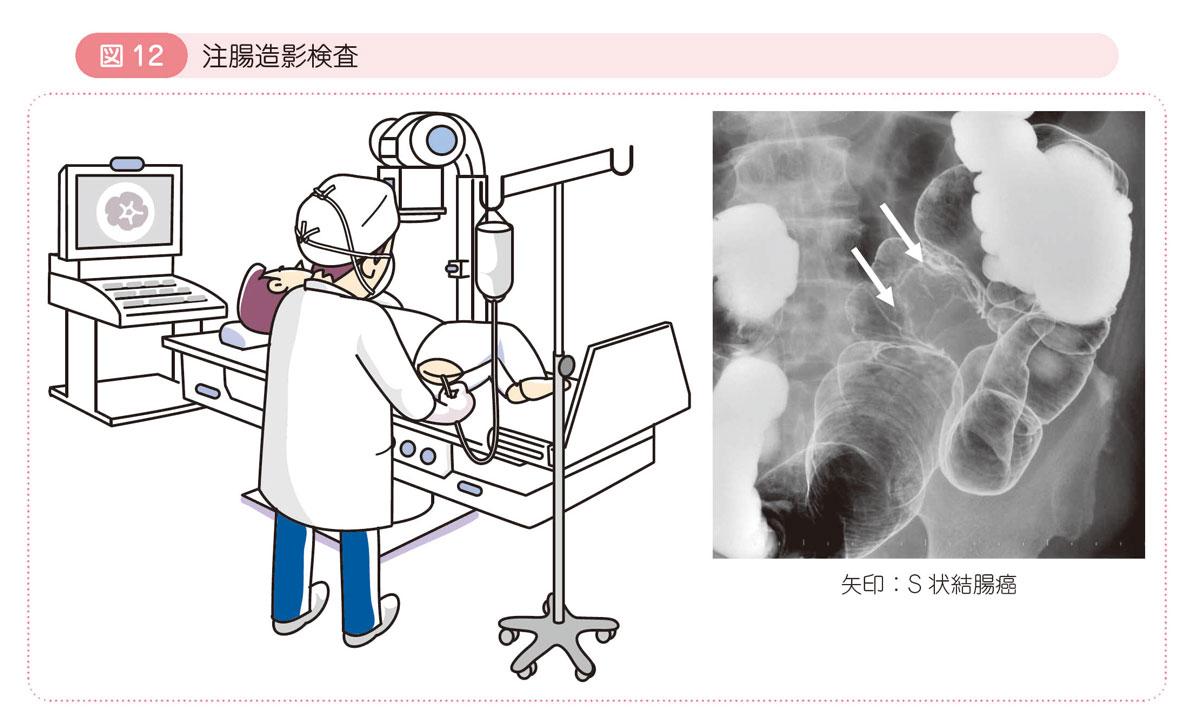
肛門からX線に写る液体(バリウムなど)を空気とともに流し込んで大腸の壁に付着させて,大腸の形の変化から病変を診断する方法です。あらかじめ下剤を使って大腸を空にします。
癌の位置や大きさを評価したり,周囲の臓器との位置関係を把握します。
● 大腸内視鏡検査
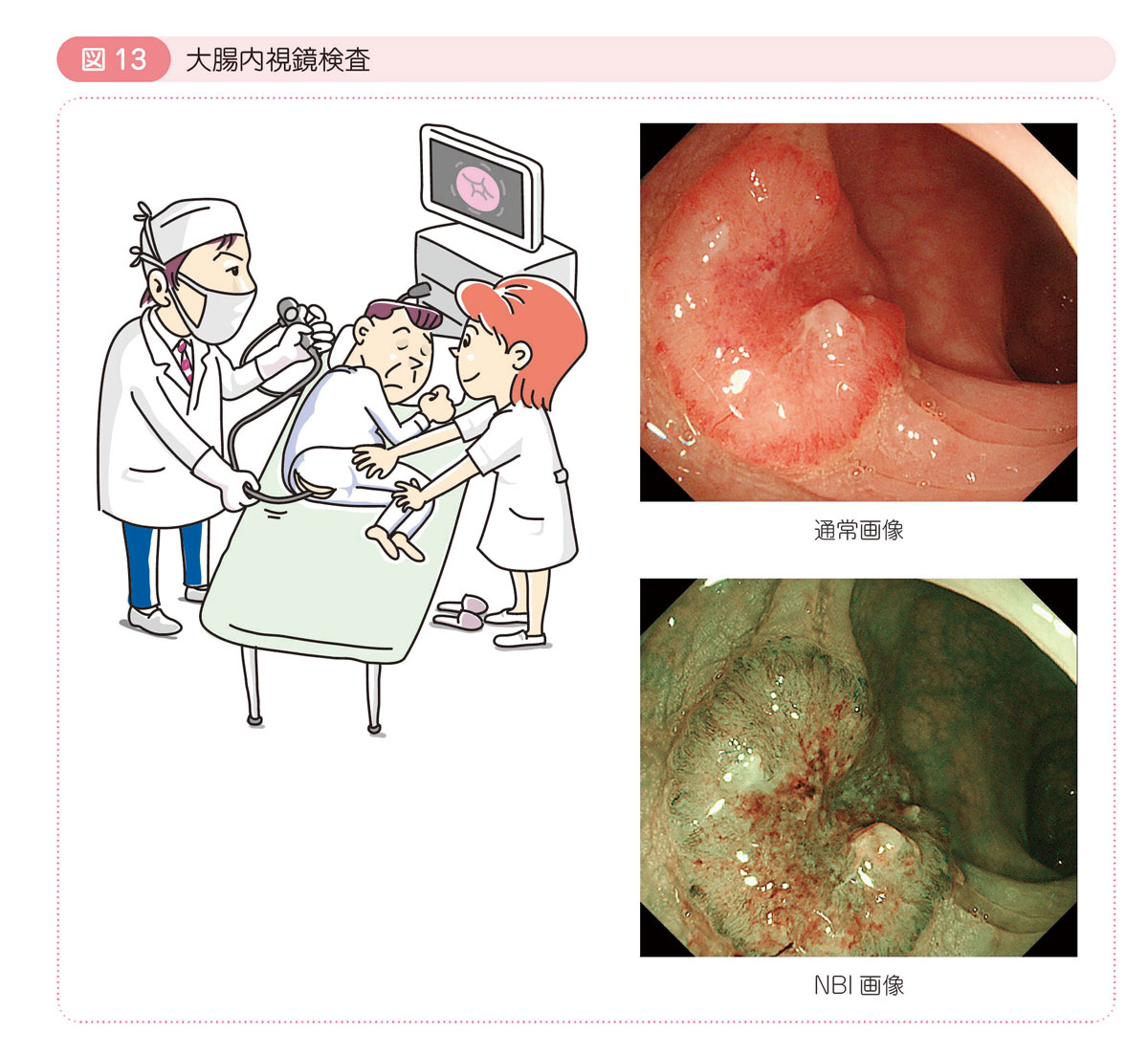
内視鏡を肛門から挿入し,全大腸を内側から観察します。あらかじめ下剤を使って大腸を空にします。
良性ポリープ(腺腫)や癌を直接観察することができます。良性ポリープ(腺腫)や早期癌を切除することもできます。
最近では,波長の違う光を当てたり(NBI:Narrow Band Imaging,狭帯域光観察),色素をかけて病変の表面の細かい模様や血管の形を観察することで(クリスタルバイオレットを用いたピットパターン診断),良性・悪性の診断や,癌の深さの診断の参考になる情報を得ることもできるようになりました。
3 治療方針を決めるために必要な検査
● 胸部腹部CT:computed tomography
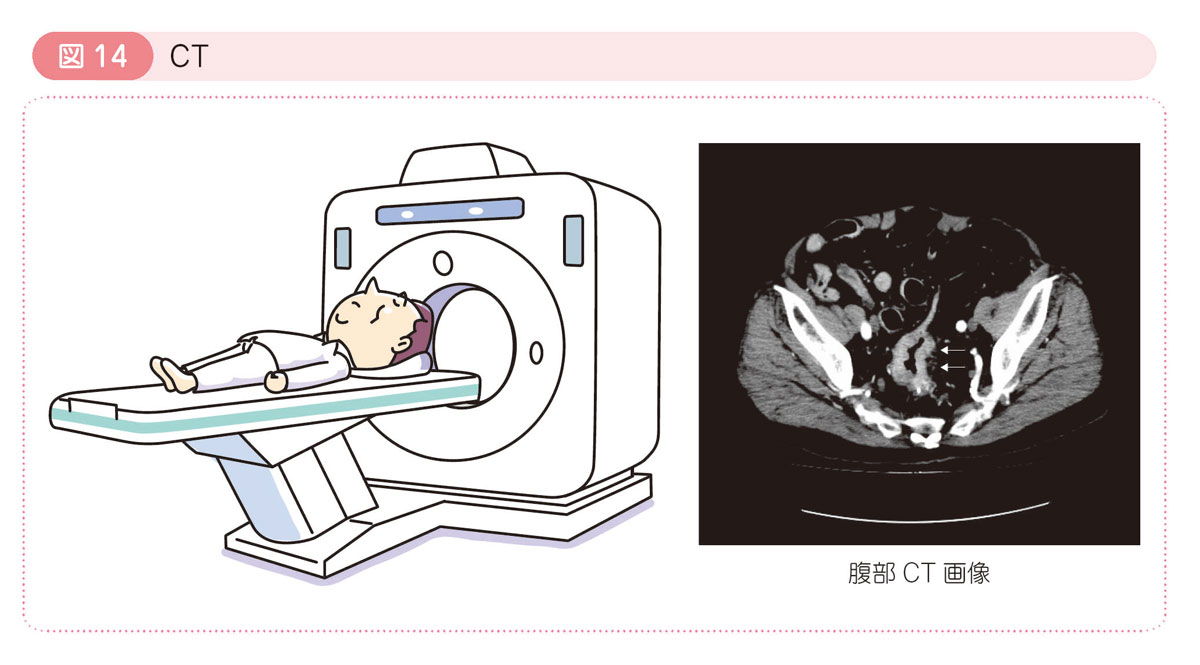
X線を使って身体の断面を撮影する検査です。大腸癌と周囲の臓器との位置関係,リンパ節転移や腹膜播種の有無を調べます。また,大腸癌は血行性転移が起こりやすいので,肺転移・肝転移の有無を調べます。
● 腹部超音波検査
大腸癌と周囲の臓器との位置関係,肝転移やリンパ節転移,腹膜播種の有無を調べます。
● MRI:magnetic resonance imaging
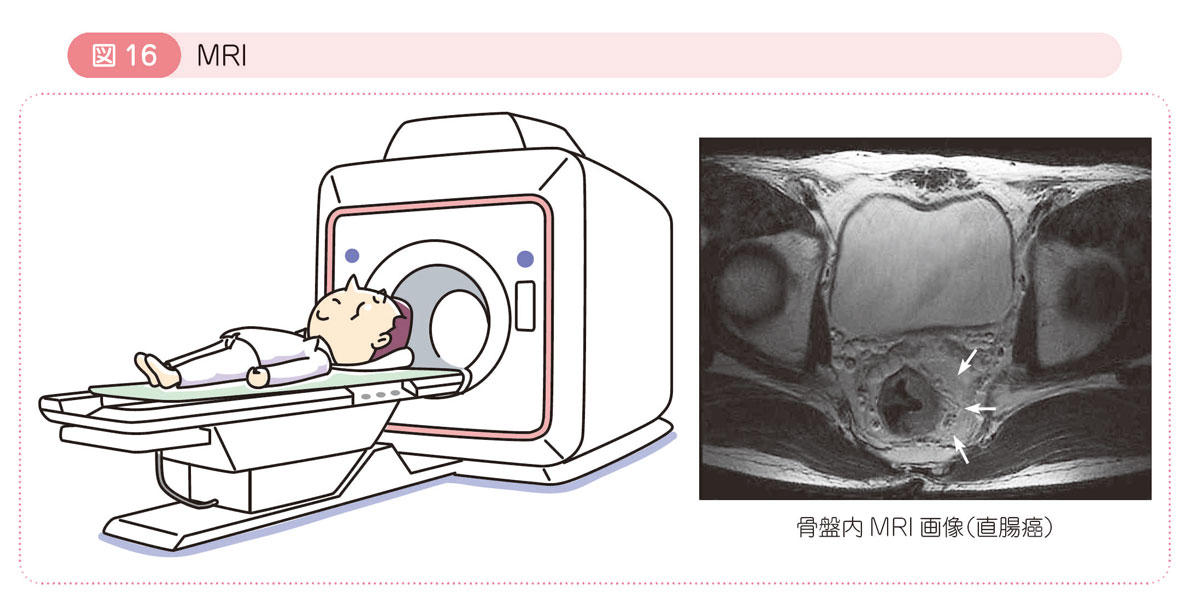
MRI検査は,強い磁場が発生するトンネル状の装置の中に入り,磁石と電波を使って検査を行います。大腸癌と周囲の臓器との位置関係,特に直腸癌の周囲への広がりや肝転移を詳細に調べることに適しています。
-
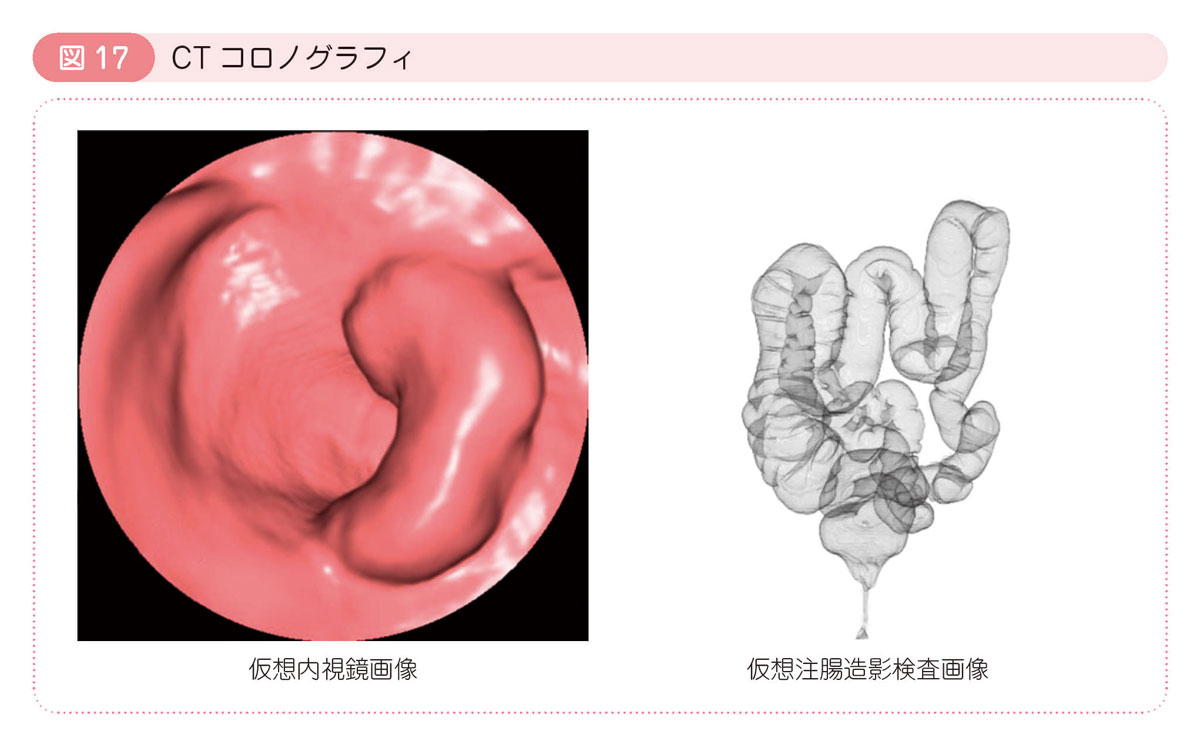
CTコロノグラフィ(図17)
肛門から炭酸ガスを注入して大腸を拡張させてから,CTを用いて全腹部を撮影し,大腸の3次元デジタル画像を用いて病変を発見します。3次元画像表示には,仮想内視鏡画像・仮想注腸画像があります。仮想内視鏡画像は,画像解析ソフトを用いて仮想的に大腸の内腔を作成し内視鏡検査に類似したものです。あらかじめ下剤を使って大腸を空にします。 -
カプセル内視鏡
長さ約3cm,直径約1cmのカプセル型の内視鏡を飲み込んで,内蔵されている小型カメラで撮影が行われて病変を発見します。カプセルは数時間後に便といっしょに出てきます。 -
PET(positron emission tomography:陽電子断層撮影)
癌細胞は正常の細胞よりもブドウ糖をたくさん取り込む性質があります。そこで,ブドウ糖に似た化学物質に微量の放射線物質をつなげた薬を注射後,1~2時間経過した時点での薬の集まり具合から,癌細胞を検出する方法です。
しかし腫瘍の全てに薬が集まるわけではなく,特に囊胞病変や小さな病変などは描出(撮影した画像にうつしだされること)が難しく,この検査のみでの腫瘍の存在診断,鑑別診断,病期診断は困難です。
7 大腸癌の治療法
1 内視鏡治療
大腸内視鏡は本来,大腸の中を観察して病気を発見するための機器です。
内視鏡を使って大腸の良性ポリープや癌を切除する治療を内視鏡治療といいます。
内視鏡で癌を切除する代表的な方法には,ポリペクトミー,内視鏡的粘膜切除術(EMR:endoscopic mucosal resection)および内視鏡的粘膜下層剥離術(ESD:endoscopic submucosal dissection)があります。腫瘍(良性ポリープや癌)の形と大きさに応じて使い分けます。
● ポリペクトミー
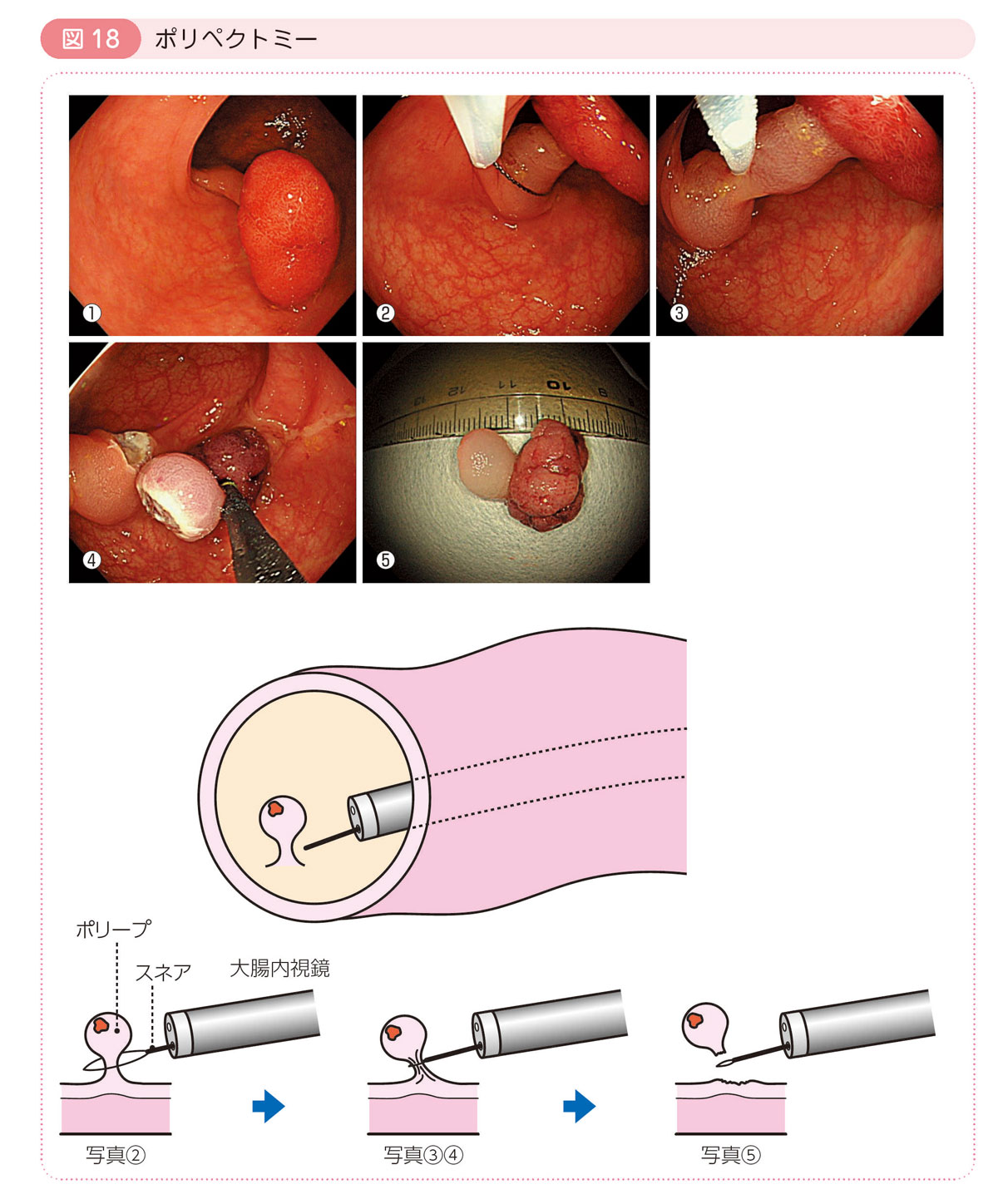
きのこ型の茎をもったポリープに対して用いる方法です。
ポリープの茎にスネアという金属製の輪をかけて,高周波電流を流して茎を焼き切ります。
● 内視鏡的粘膜切除術(EMR)
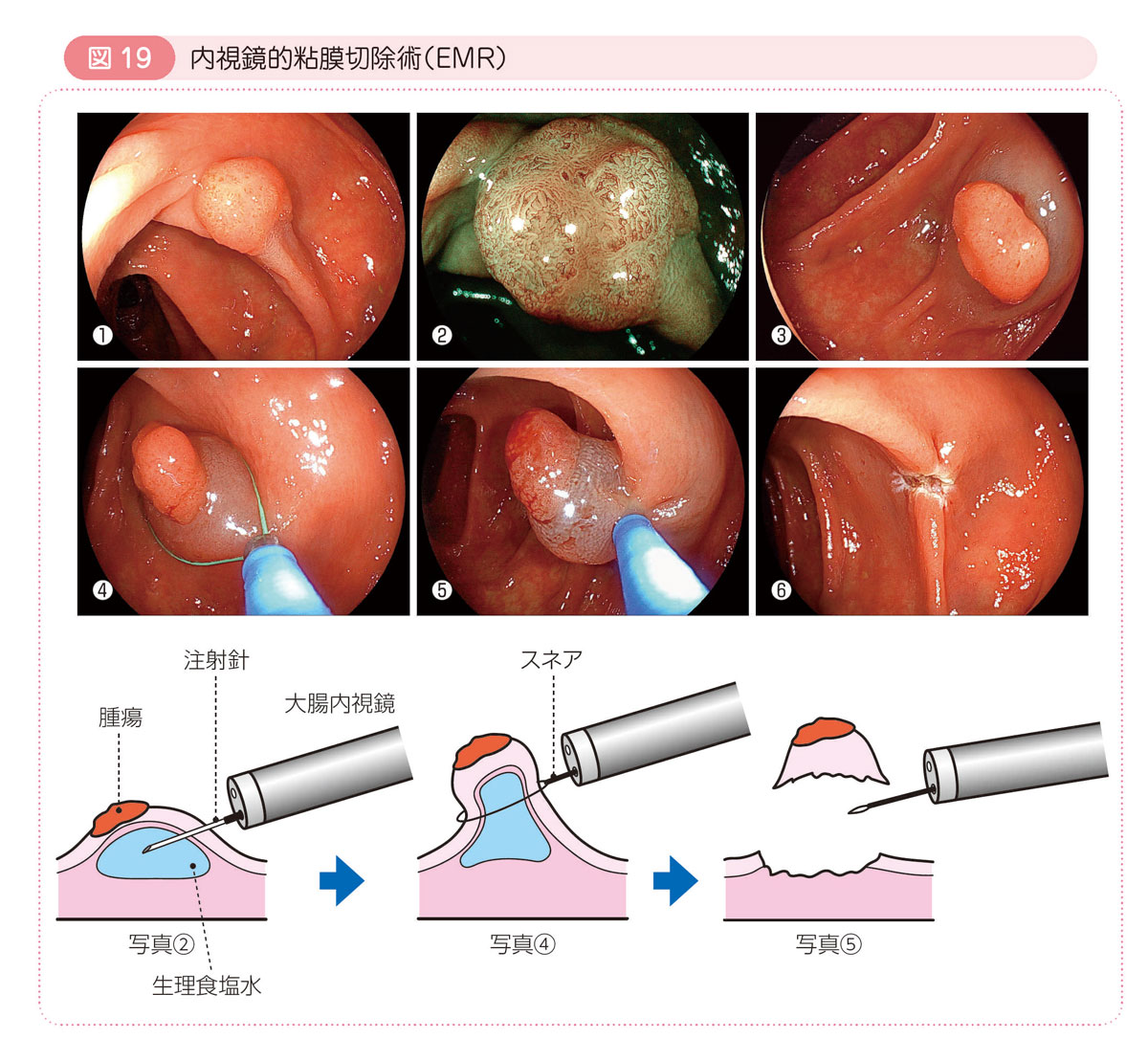
茎をもたない平たい腫瘍に対して用います。
粘膜下層に生理食塩水などを注射して腫瘍を固有筋層から持ち上げてから,ポリペクトミーと同じようにスネアを使って腫瘍を切り取ります。
● 内視鏡的粘膜下層剝離術(ESD)
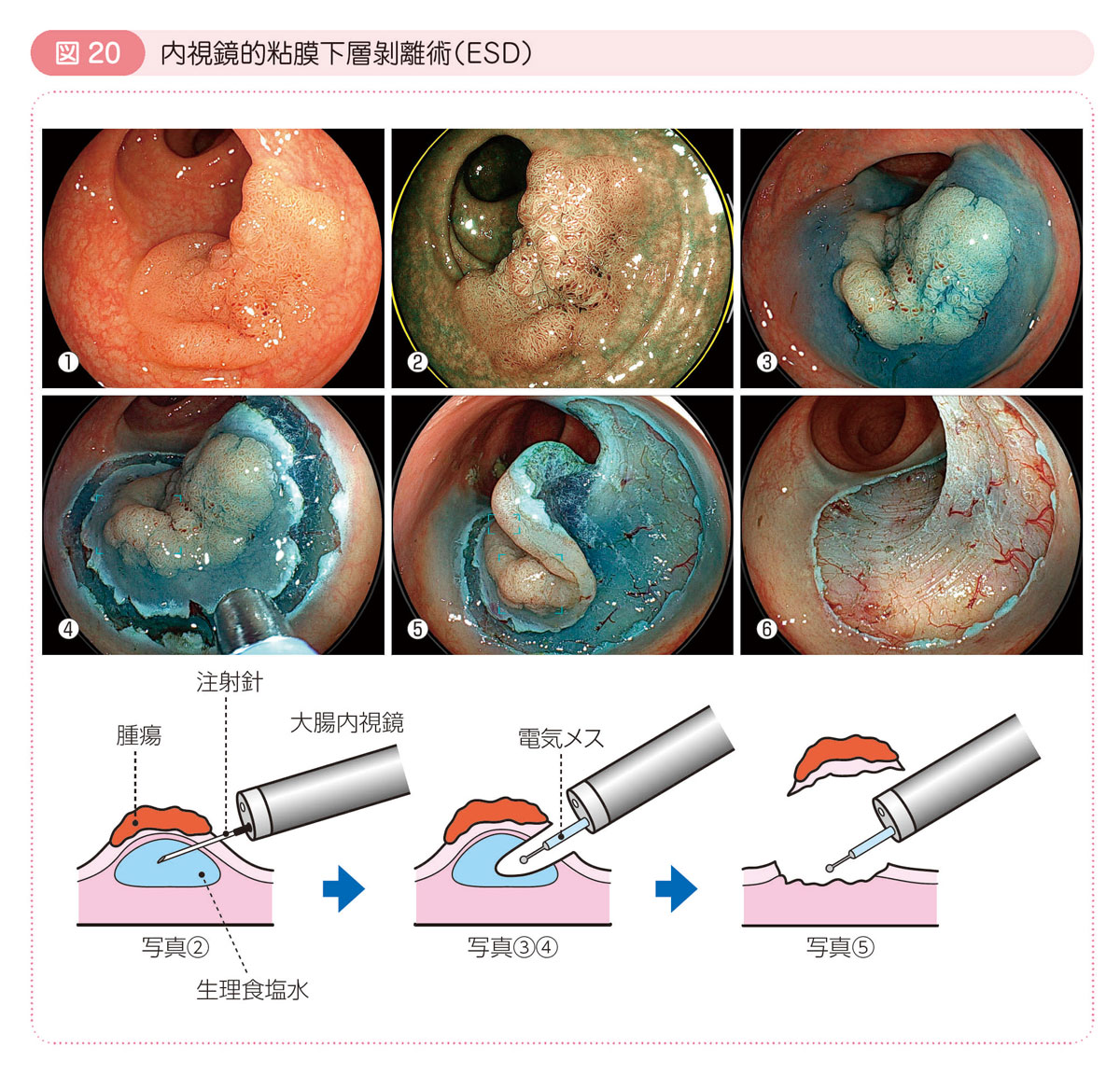
一括切除が困難な大きな早期癌に対して用います。現在は,最大径2cm以上の早期大腸癌,2cm以下で線維化を伴う早期大腸癌が保険適用の対象です。
粘膜下層に特殊な液を注射して腫瘍を固有筋層から持ち上げてから,電気メスを使って粘膜下層を剝離していき腫瘍を切り取ります。
● 内視鏡治療の適応
リンパ節転移の可能性がほとんどない粘膜内癌(Tis癌)と粘膜下層浸潤癌(T1癌)のうち浸潤程度が軽いものが内視鏡治療の適応で,大きさは問いません。
ただし,大きさが2cm以上の病変では,内視鏡的粘膜下層剝離術(ESD)を行う場合もあります。
切除した癌の病理検査の結果によっては,手術による切除が必要となる場合があります。
● 内視鏡治療の合併症
内視鏡治療の大きな合併症として,出血と穿孔(大腸に穴が開く)があります。
- 合併症の発生頻度はポリペクトミー,EMR,ESDで,それぞれ術中穿孔率0.05%,0.58~0.8%,2~14%,後出血率1.6%,1.1~1.7%,0.7~3.1%と報告されています(大腸ESD/EMRガイドライン 第2版:日本消化器内視鏡学会)。
- 出血に対しては,出血部を電気的に焼いたり,クリップで挟んだりして止血します。
- 穿孔に対しては,手術による処置が必要なこともあります。
2 手術治療
手術治療では,とり残しのないように,癌が広がっている可能性のある腸管とリンパ節を切除します。
リンパ節を切除する範囲(リンパ節郭清)は,癌の部位と手術前に予測した癌の進行度を考慮して決定します。
癌の浸潤が周囲臓器にまでおよんでいる場合は可能であればその臓器も一緒に切除します。
腸管を切除した後,残った腸管をつなぎあわせます(つなぎあわせることを「吻合」といいます)。
直腸癌が肛門近くにあって,肛門括約筋を切除する必要がある場合は人工肛門が必要です(肛門括約筋は排便機能を保つのに必要です)。
● リンパ節郭清(D1,D2,D3郭清)
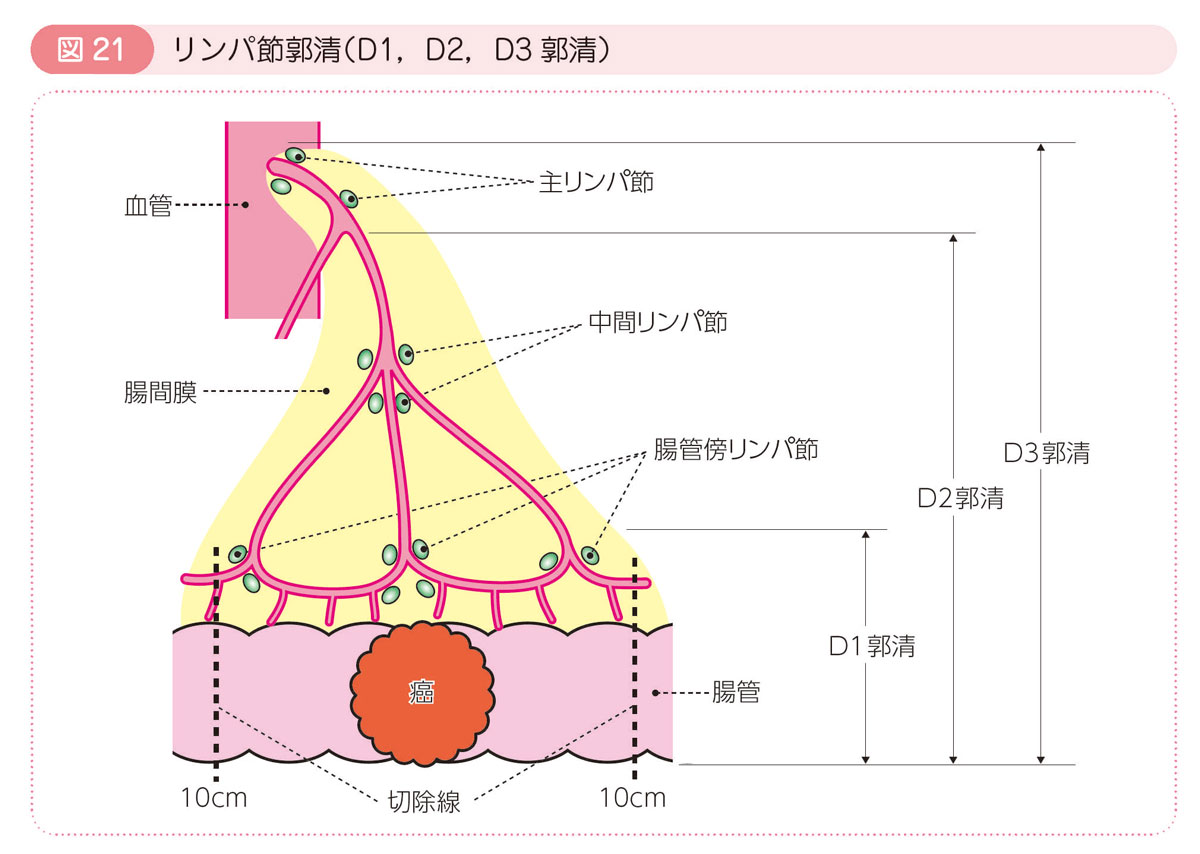
癌は近くのリンパ節から順に遠くへ転移していきます。リンパ節郭清は以下の3種類に区分されます。
D1郭清
- 腸管の近くにあるリンパ節(腸管傍リンパ節)を切除します。
D2郭清
- 癌のある腸管に流入する血管(栄養血管)に沿ったリンパ節(中間リンパ節)も切除します。
D3郭清
- 栄養血管の根元にあるリンパ節(主リンパ節)も切除します。
● 結腸癌の手術
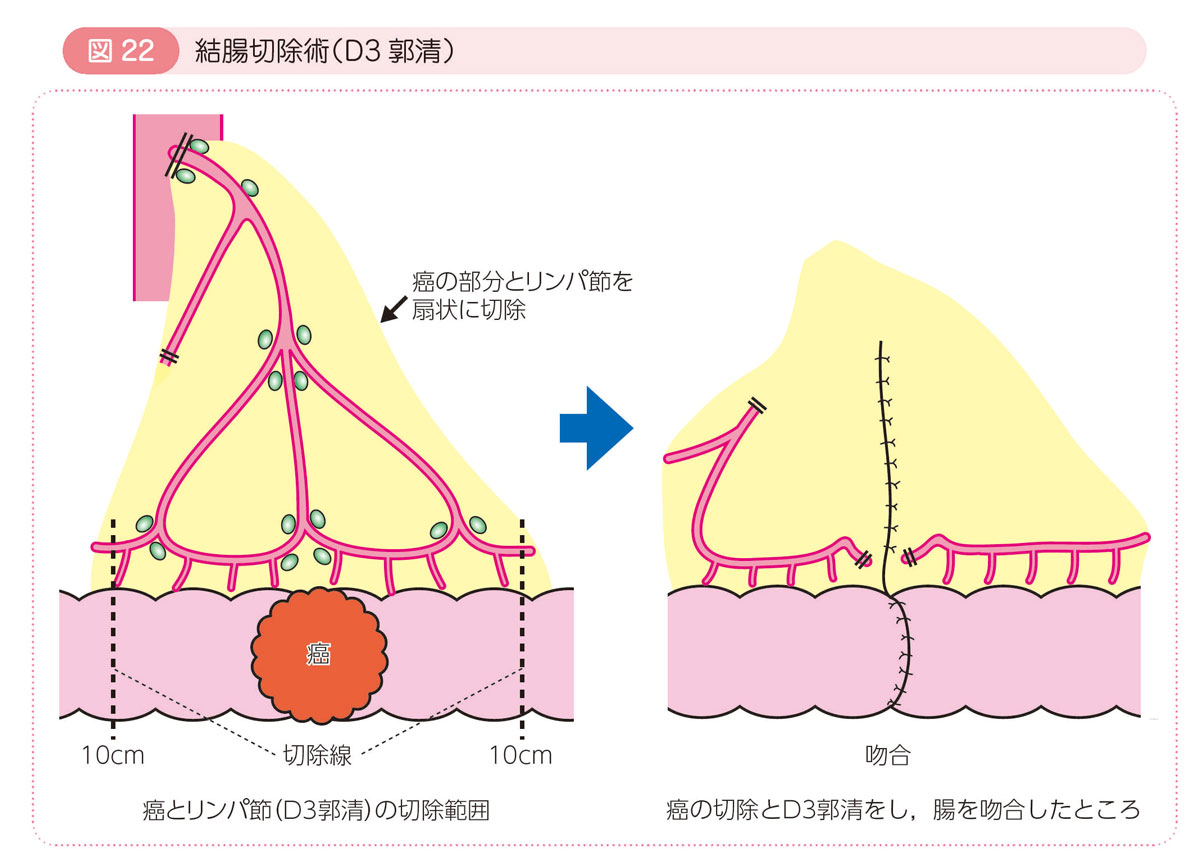
癌から10cmほど離れた部位で腸管を切ります。
腸管を切除した後,腸管を吻合します。
手術名には以下のようなものがあります。
- 回盲部切除術,結腸右半切除術,横行結腸切除術,結腸左半切除術,S状結腸切除術。
● 直腸癌の手術
直腸局所切除術
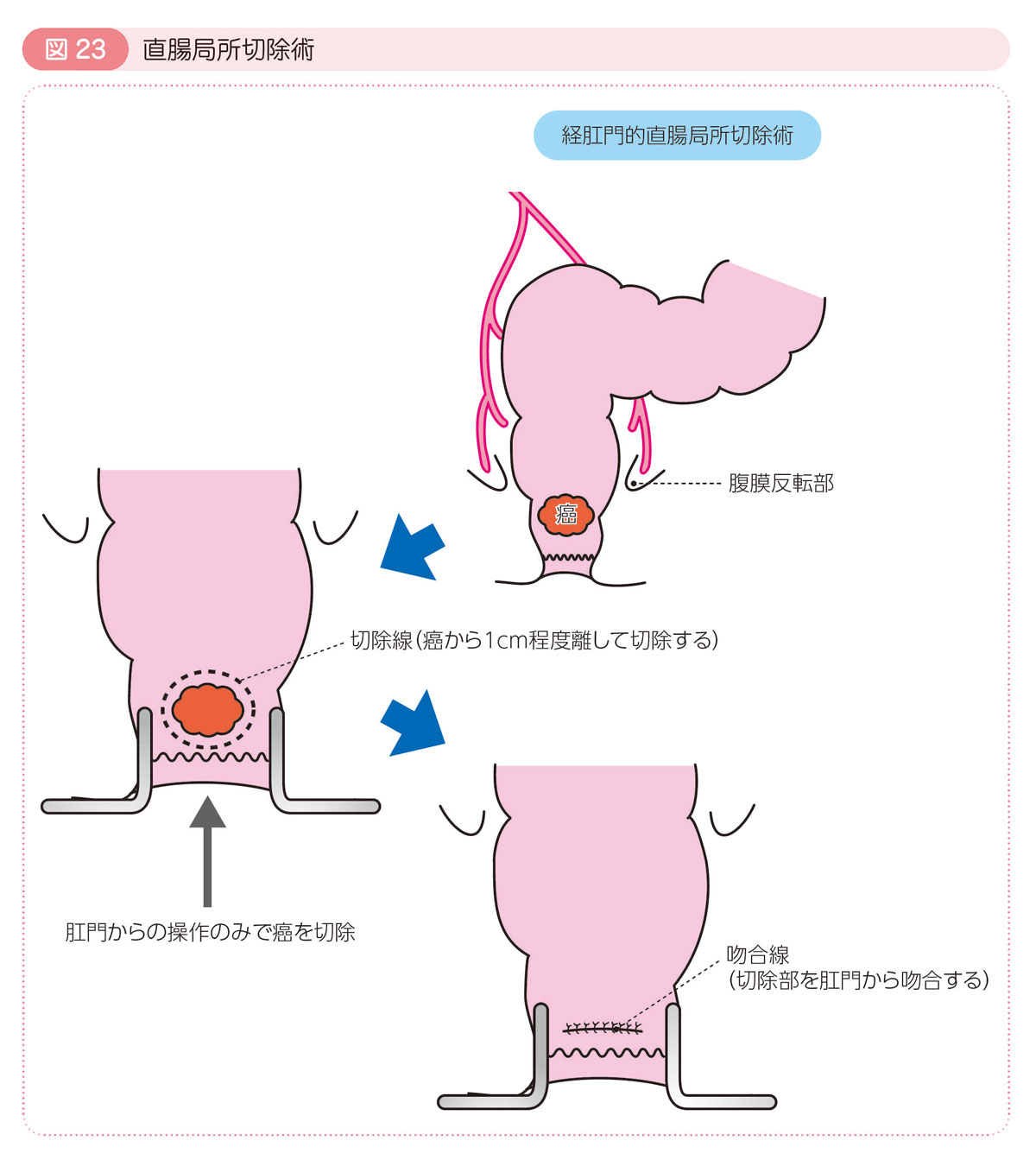
- 早期癌の場合,癌だけを切除し,リンパ節郭清は行わない場合があります。
- 肛門に近い直腸癌に対して,肛門からアプローチして癌を切除する方法(経肛門的切除)と,うつ伏せの状態でお尻側にメスを入れ,仙骨の横からアプローチして癌を切除する方法(経仙骨的切除および経括約筋的切除)があります。
高位前方切除術・低位前方切除術
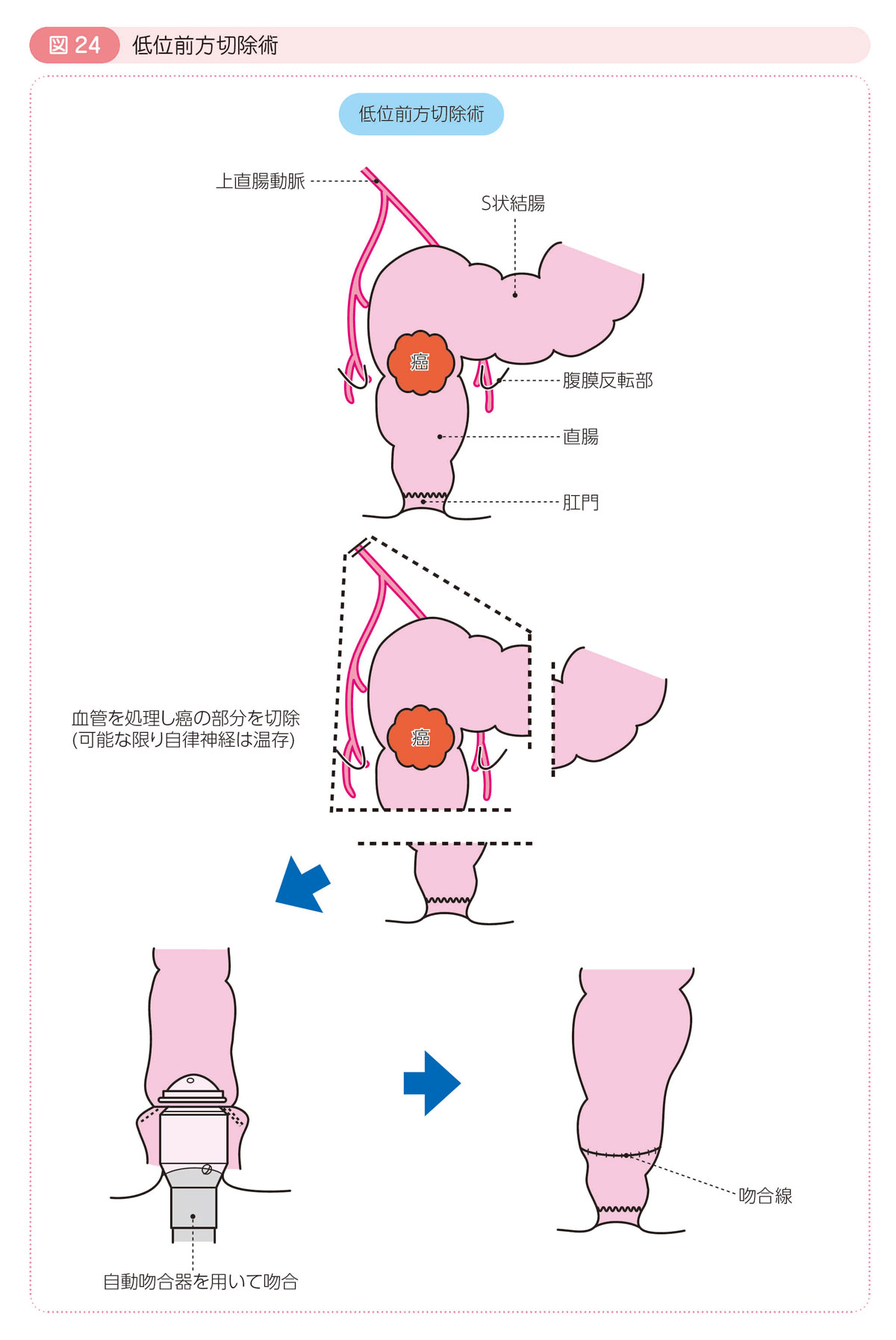
- 腹膜反転部(図2参照)より上で腸吻合するのが高位前方切除術で,下で吻合するのが低位前方切除術です。
- お腹から直腸にアプローチして直腸を切除する方法です。
- 肛門側は癌から2~3cm離れた部位で直腸を切ります。
- 直腸を切除した後,結腸と直腸を吻合します。
- 通常,器械(自動吻合器)を使って吻合します。
直腸切断術
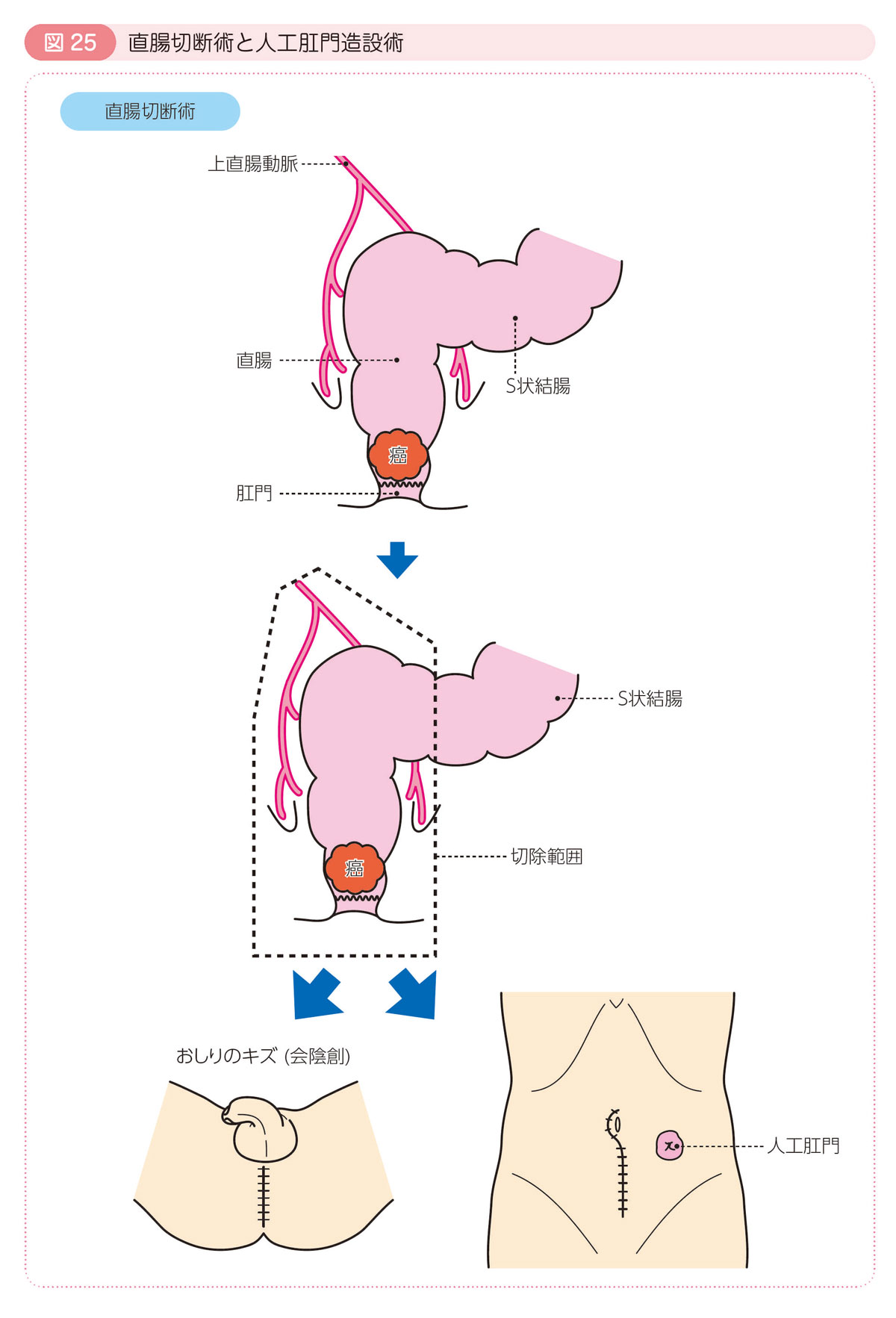
- 癌が肛門近くにある場合,肛門を含めて癌を切除する必要があり,その場合は人工肛門になります(Q9-1〜Q9-4参照)。
- 人工肛門の管理は非常に進歩しています。
- 看護師による人工肛門の管理・教育や,患者会(オストメイト)など,ケアシステムに対するさまざまな取り組みが行われています。
直腸の近くには膀胱の機能や性機能の働きを調整する神経があり,これらの神経を残す手術が行われます(自律神経温存術)。
癌が,膀胱や子宮,膣,前立腺に浸潤している場合,可能であればそれらの臓器を一緒に切除します(合併切除)。
特殊な肛門温存手術 ISR(括約筋間直腸切除術)
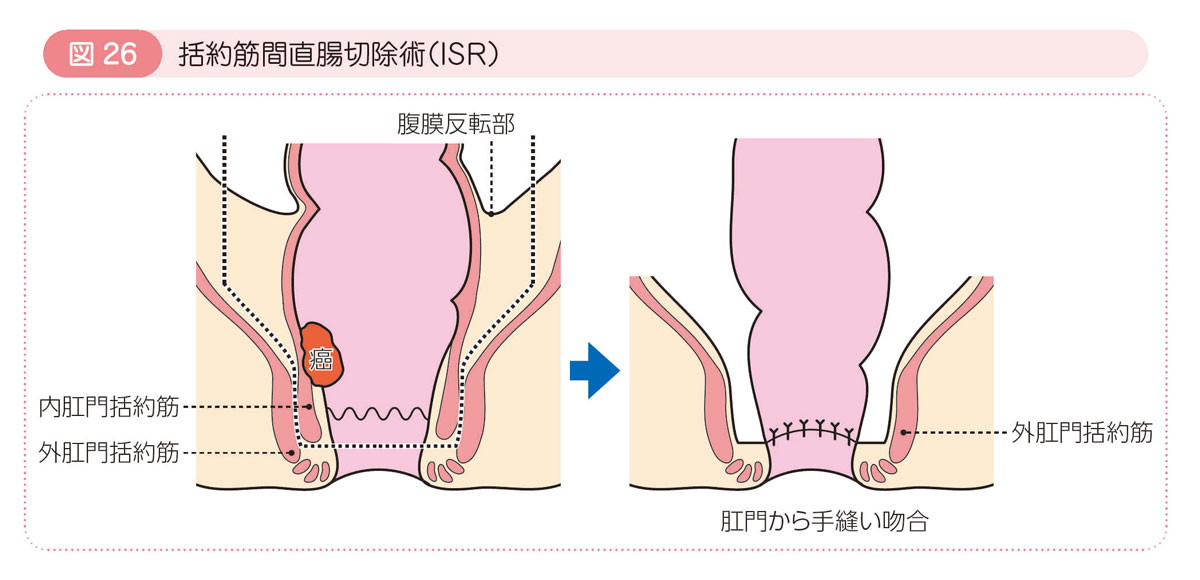
肛門の筋肉の一部を切除して根治性を保ちつつ,肛門を温存する手術です。直腸癌とともに内肛門括約筋を切除して肛門を温存します。この手術の問題点は,再発が増えないか,排便障害により日常生活が脅かされないか,という点です。大腸癌研究会ではデータを集積,解析して,ともに現時点で大きな問題はないことがわかってきましたが,失禁の増加など排便の様子は手術前と大きく変わります。この手術には高度な技術が必要であり,主治医の先生とよく相談して手術の方法を決定する必要があります。
● 腹腔鏡下手術
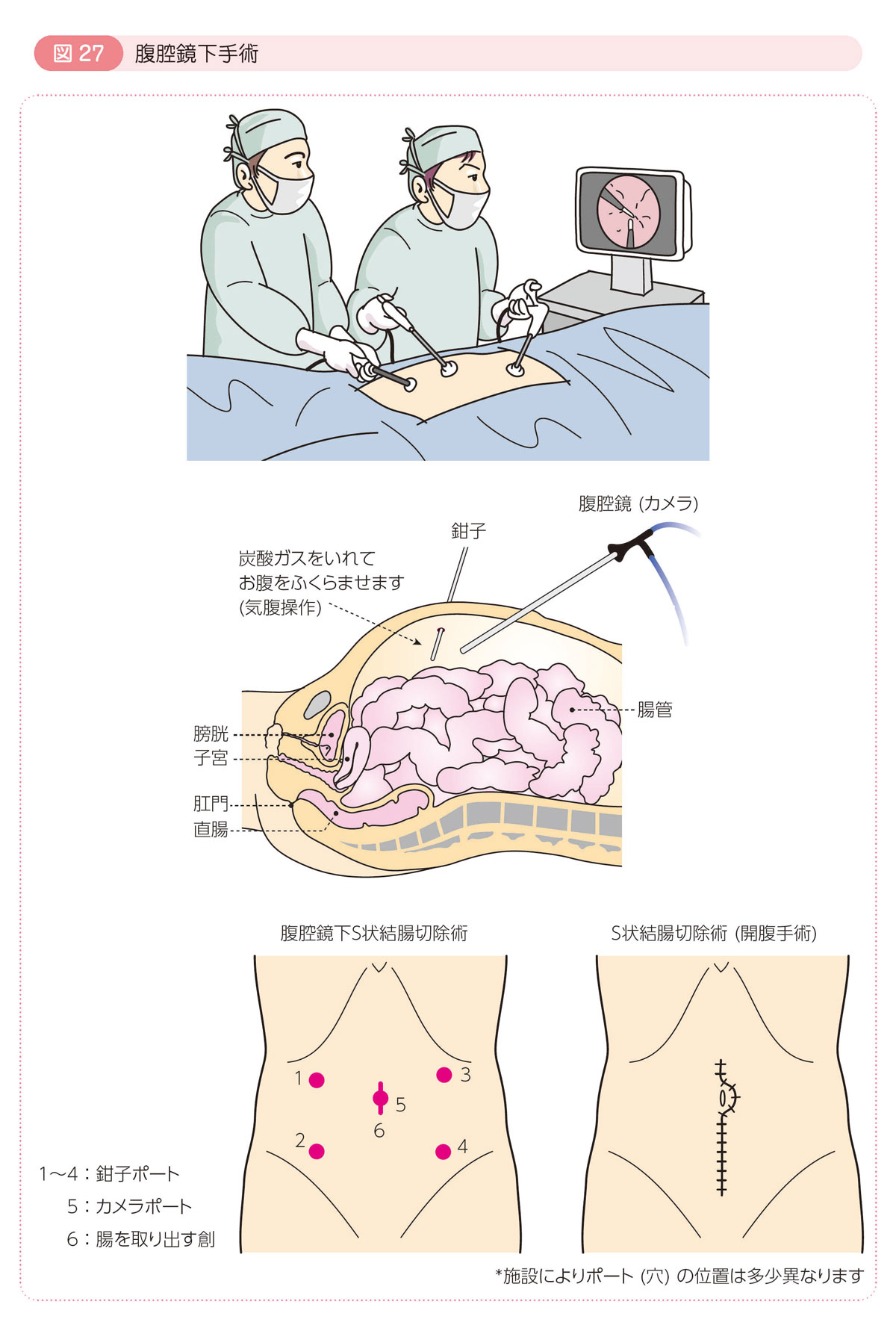
炭酸ガスで腹部をふくらませ(気腹操作),おなかの中を見る内視鏡(腹腔鏡)で観察しながら,数カ所の小さな創から器具(鉗子)を入れて手術を行う方法です。1990年頃からこの方法で大腸の手術が行われはじめ,創が小さく体の負担が少ないために急速に普及してきました。開腹手術とは異なった技術が必要なので,主治医との相談が必要です。現在まで,結腸癌については多くの臨床試験で腹腔鏡下手術の安全性が検証されましたが,直腸癌については海外で試験中の状況です。
通常の開腹手術とは異なる点
- 創が小さいために手術後の痛みが少なく回復が早いので,早期の退院,早期の社会復帰が可能です。
- 一般に出血量は少なくなりますが,手術時間が長くなります。
- 開腹手術とは異なる技術であるため,医師はトレーニングが必要です。
- 手術費用は開腹手術より若干高くなります。
腹腔鏡下手術で行えるかどうかは,癌の進行状況や体格,以前に行った手術や治療中の病気などで異なるので,主治医と十分相談の上で決定する必要があります。
3 手術治療の合併症
● 手術操作に直接関係して発生する合併症(Q7参照)
出血
- 手術により出血することがあります。手術による出血量が多い場合には輸血を行います。
- 術後に出血することもあり,まれに再手術により出血を止める必要があります。
縫合不全
- 吻合部から便が漏れだすことを縫合不全といいます。周囲に感染や炎症が広がり,場合によっては重篤な状況に陥ります。
- 炎症が軽度であれば食事制限や点滴治療で治ることもありますが,吻合部の上流の腸管をお腹の外に出した便の出口,すなわち人工肛門を作成し破は綻たんした吻合部の治癒を図ります。このタイプの人工肛門は縫合不全が治れば,閉鎖することが可能です。
吻合部狭窄
- 吻合部が狭くなる(狭窄する)ことがあります。内視鏡や再手術により吻合部を広げる処置が必要になることがあります。
腸閉塞
- 手術後,腸の動きが回復するとガスや便が出ます。しかし腸の動きが悪かったり腸のどこかが狭くなったりすると,お腹の張りや嘔吐を伴うようになり,これを腸閉塞といいます。
- 食事を中止し点滴を行い,腸を安静にすること,また鼻からのチューブで胃液や腸液を排出することで多くが改善します。
- こうした保存的治療で改善しない場合は,手術治療を行います。
創感染・腹腔内膿瘍
- 手術の創(きず)に細菌が付着することにより創が化膿し,腫れ,痛み,発熱などが起こります。これを創感染といいます。創の抜糸や切開により,膿を排出することで,徐々に治ります。
- おなかの中に膿のたまり(膿瘍)ができることもあります。これを腹腔内膿瘍といいます。抗菌薬による点滴治療やおなかに管を入れて膿を排出する治療を行います。状況によっては,手術でおなかの中を洗浄する治療が必要になる場合があります。
腹壁瘢痕ヘルニア
- お腹の傷の部分が弱くなり,この部分からおなかの臓器が皮膚の下まで出てくることがあります。お腹の部分が膨らんで見えますが,多くの場合はそのまま様子を見て構いません。しかし,場合によっては手術による修復が必要になります。人工肛門の周囲に起こることもあります。
● 手術操作とは直接関係なく発生する合併症
肺炎
- 手術後の痛みなどで呼吸が十分にできなくなったり,痰をうまく出せなかったりして,肺炎を起こすことがあります。また,ご高齢の方では誤嚥性肺炎を起こすことがあります。誤嚥性肺炎とは,食べ物を飲み込む機能が低下すると,食べ物などの本来気管に入ってはいけない物が気管に入ることで生じる肺炎のことです。抗菌薬などにより治療を行います。
肺塞栓症
- 手術中に足の静脈の中に生じた血液の塊(血栓)が,血管壁からはがれて心臓を経て肺動脈に詰まることで起こります。太い肺動脈に血栓が詰まると突然死することもあります。飛行機に長く乗っていると足に血栓ができるいわゆるエコノミークラス症候群と同じ病態で,長時間手術や足を低くした体位で行われる直腸癌手術では,肺塞栓症が発生する危険性が高まります。
- 血栓ができにくくする薬剤を用いたり,フットポンプで足をマッサージして血流を良くしたりすることもあります。手術翌日から歩いたり足を良く動かしたりすることで予防になります。
その他の血栓症
- 術中,術後は血圧の変動などにより血栓が生じやすい状態になります。心筋梗塞,狭心症などの虚血性疾患や脳梗塞などが発症する可能性があり,まれな合併症ではありますが,生命にかかわる重篤な合併症です。
せん妄
- 入院や手術のストレスにより一時的に認知症のような症状がでることがあります。ご高齢の方で起こりやすく,数日で元に戻ることが多いですが,自分がどこにいるか分からなくなってしまい,術後の大事な管を抜いてしまったり,勝手に歩いて転倒したりして生命に危険が及ぶこともあります。
- 鎮静剤を使用したり,抑制したりすることがあります。
下肢コンパートメント症候群
- 手術時の姿勢が原因で足の筋肉内圧が異常に高くなり,足の麻痺や筋力低下を来すことがあります。長時間の手術で起こりやすく,重症の場合は緊急手術や血液透析が必要となることもあります。
その他
- 手術による負担により心不全や腎不全となることや,麻酔薬など手術前後に投与された薬剤により肝臓の機能障害などが起こることがあります。
- 多くの薬剤を使用するためアレルギーを起こすことや,しばらく食事が取れないために胆囊炎になることもあります。
● 手術治療の後遺症
排尿障害
- 直腸癌手術時の自律神経の損傷による障害です。癌の進行によってはやむを得ず自律神経を切除することもあります。
- 残尿増加や尿閉(尿が出せなくなること)が主な症状で,必要に応じて自己導尿(患者さん自身で細い管を尿道から膀胱に挿入して尿を出すこと)を行います。時間とともに改善することもしばしばあり,また薬により改善する場合もあります。
性機能障害(特に男性)
- 排尿障害同様,直腸癌手術時の自律神経の損傷による障害です。特に男性の射精障害や勃起障害が多くみられ,排尿障害よりも頻度が高くなります。
- 現状ではあまり有効な治療はありません。
排便障害
- 直腸癌で肛門を温存した手術を行った方でも,排便の様子はかなり変わってしまいます。排便回数の増加がもっともよく見られ,一度排便に行くと3回ほど続く場合や,毎食後に便意をもよおす場合があります。
- 肛門の近くで吻合した場合には,便汁や粘液のシミだし,失禁が起こることもあります。
- 一時的なものと永久のものがあります。癌とともに肛門を取り除いた場合は,永久の人工肛門となります。
- 便の処理や装具の交換など,ケアに慣れる必要がありますが,生活の制限は特にありません。
4 薬物療法(抗がん剤療法)
抗がん剤は,癌細胞を死滅させたり,癌が大きくなるのを抑える作用をもっています。
抗がん剤を用いる治療を薬物療法(化学療法,抗がん剤療法)と言います。使用する薬によって注射(点滴)する方法や飲む(内服する)方法が用いられます。
● 薬物療法の目的
大腸癌に薬物療法を行う目的は2つあります。
1つは手術後の再発を予防することで,補助化学療法といいます(Q13参照)。
もう1つは手術では癌が取りきれない場合に大きくなるのを抑えたり,癌による痛みなどの症状を緩和したりすることです。
- なお,大腸癌の治療は手術による切除が最も有効ですから,薬物療法を手術の代わりとすることはできません。
● 薬物療法の副作用
抗がん剤は癌細胞だけでなく,正常の細胞にも少なからず障害を与えます。
このため,抗がん剤による副作用がでてきます。
副作用は,患者さん自身が身体で感じるものと血液検査や診察でしかわからないものとがあります(表2)。
副作用の種類や程度は,抗がん剤の種類により異なり,個人差もあります。
副作用を予防する薬も開発されており,特に吐き気・嘔吐や便通異常はコントロールができるようになってきました。
薬物療法を受ける場合は,どのような副作用(種類や時期,期間など)がでるのか,担当医からよく説明を受けてください。
治療中の患者さんの状態は治療を継続していく上で大変重要です。担当医に気になる点を遠慮せずに話してください。
抗がん剤の副作用の多くは,治療を中止すると数日から数週間の間に回復することが多いです。しかし,オキサリプラチンによる感覚性の末梢神経障害(しびれ,指先や足底の違和感など)や,免疫チェックポイント阻害薬によるホルモン異常などは治療を止めても,数か月から数年以上残ることもあります。

● 薬物療法の効果判定
「抗がん剤が効いた」とは,癌の大きさがある程度小さくなったことを指します。癌が完治したことを意味するのではありません。
抗がん剤が効いたか効かないかは,2~4か月ごとにCT,MRI,内視鏡などの検査で癌の大きさを測り,治療の前後で比較して判断します。
また,1~3か月ごとに血液検査により腫瘍マーカー(CEA,CA19-9など)の変動を観察して,薬物療法の効果判定に用いることもあります。ただし,腫瘍マーカーの変化が必ずしもがんの大きさの変化を反映する訳ではないことに注意が必要です。
5 放射線治療
放射線とは,目に見えない小さな粒子が非常に大きなエネルギーを持って飛び出す状態,あるいはX線などの電磁波が広がる状態のことをいいます。
放射線治療は,癌細胞のDNAを傷つけて細胞分裂を止める作用により腫瘍を縮小させる治療で,体の外から放射線を照射する外照射と,放射線を出す小さな線源を病巣付近に入れて体の中から照射する内部照射があります。また,従来のX線や電子線を用いた治療に加えて,保険診療の適用外ですが陽子線や重粒子線を用いた治療も行われています。
放射線治療は,手術治療と同様に,局所治療(治療を行った部分だけに直接的に効果を示す治療)に位置付けられます。
脳や骨盤内に広く照射する方法(全脳照射,骨盤内照射)以外に,CT,MRI,PETなどの画像をもとに癌の大きさや形,部位を特定し,限られた部位に放射線を照射する方法があります。
● 放射線療法の副作用
- 早期副作用:
- 全身倦怠感,吐き気,嘔吐,食欲不振,白血球減少,腸炎,皮膚炎,膀胱炎など晩期副作用:腸出血,潰瘍・穿孔,瘻孔形成,頻便,腸閉塞など
- 晩期副作用:
- 腸出血,潰瘍・穿孔,瘻孔形成,頻便,腸閉塞など
6 緩和医療
● 緩和医療とは
生命をおびやかす病気に伴うからだのつらさ,気持ちのつらさ,生きている意味や価値についての疑問,治療を受ける場所や医療費のことなど,患者さんやその家族が直面するさまざまな問題に対し援助する医療のことをいいます。
緩和ケアともいわれます。
従来,緩和医療は「看取りの医療」ととられがちでしたが,2002年,世界保健機関(WHO)は緩和医療を「生命をおびやかす疾患に伴う問題に直面する患者さんとその家族に対し,痛みや身体的,心理社会的,スピリチュアル(霊的)な問題を早期から正確に評価し解決することにより,苦痛の予防と軽減を図り,クオリティ・オブ・ライフ(QOL:quality of life,生活の質)を向上させていく手段である」と新たに定義しました。
- QOL:
- 人々の生活を物質的な面から量的にのみとらえるのではなく,精神的な豊かさや満足度も含めて,質的にとらえる考え方。医療や福祉の分野で重視されている。生活の質。
緩和医療の目的は,がんによって起こるさまざまな苦痛を緩和することにあります。苦痛とは「痛み」に代表される身体的苦痛にとどまらず,社会的苦痛,精神的苦痛,霊的苦痛などが含まれ,これらをまとめて全人的苦痛(トータルペイン)といいます。
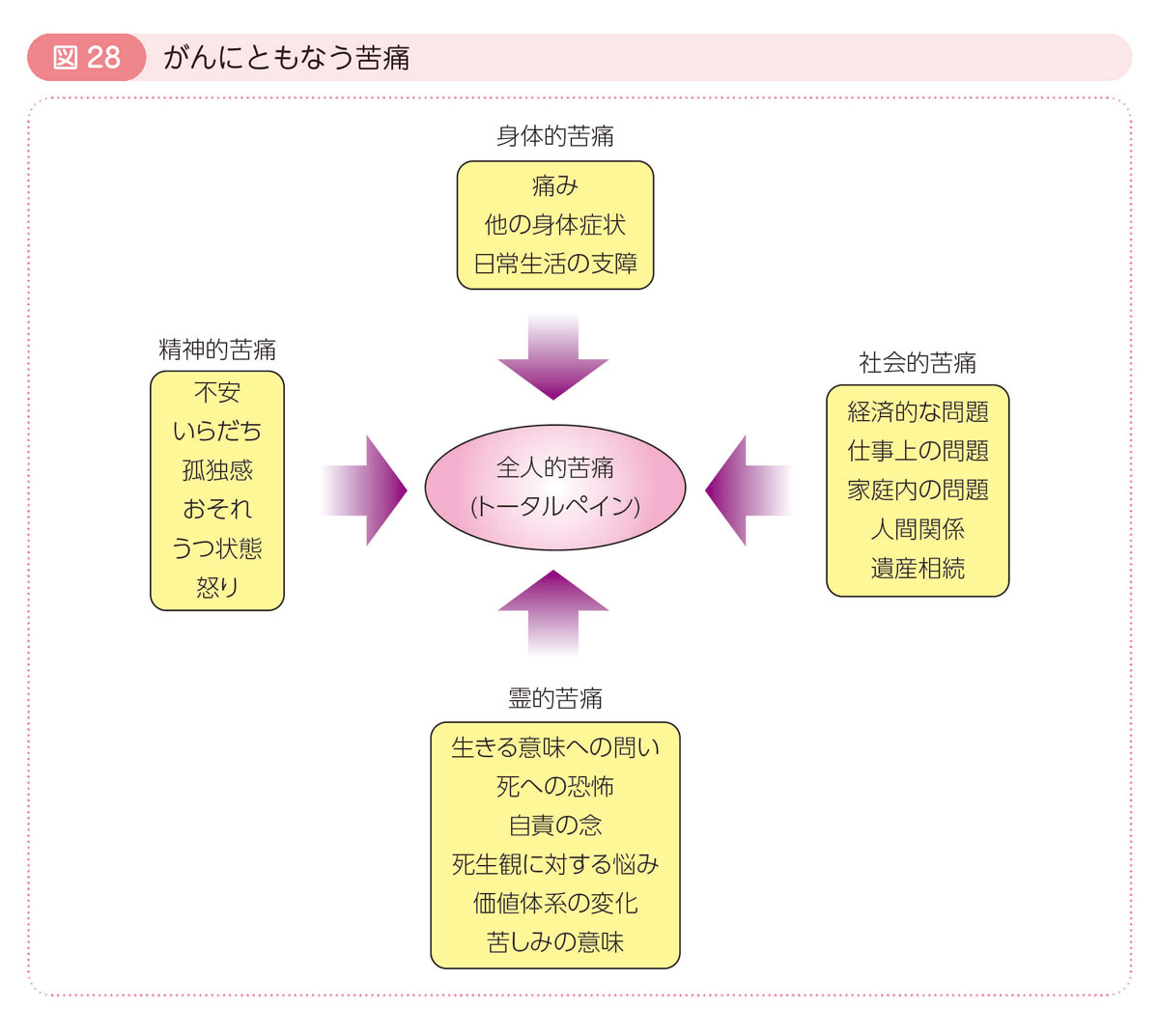
全人的苦痛を緩和するためには終末期だけでなく,それ以前の早い時期の患者さんに対してもがんの治療が始まると同時に行うこと,患者さんと死別した後も家族の苦悩に対する配慮が大切であるとされています。
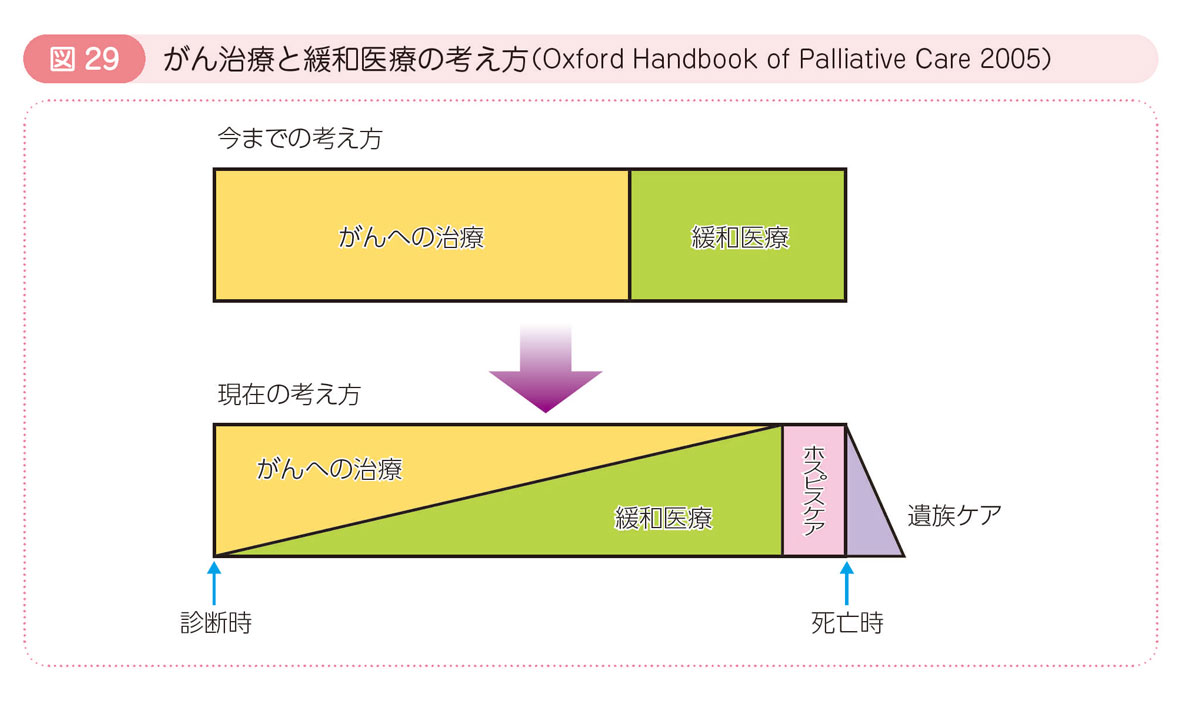
2006年「がん対策基本法」が成立し,癌緩和医療の普及が国策として取り入れられるようになりました。2007年6月には,がん対策基本法に基づく「がん対策推進基本計画」が閣議決定されました。その主な目標は,国民が安心して,質の高い癌緩和医療を受けられることです。
緩和医療は,さまざまな職種の専門スタッフが,患者さんの視点を配慮し,患者さん一人一人にあった医療を進める「チーム医療」です。
さらに患者さんの療養を継続して支援するためには,在宅・介護・病院などの役割分担と地域連携が必要であり,実施可能な地域がん緩和医療連携モデルの構築を目指した研究も進んでいます。









