第35回
内視鏡切除後の再発:水平方向断端陽性,垂直方向断端陽性上杉憲幸(岩手医科大学医学部病理診断学講座)ほか
監修コメント
切除断端における癌浸潤,癌遺残,根治度の判定は,『大腸癌取扱い規約 第9版(2018年7月)』のp25に記載されている。内視鏡摘除標本における切除断端の評価は,水平断端(粘膜断端:HM)がHMX:水平断端の癌浸潤の有無が不明,HM0:水平断端に癌浸潤を認めない,HM1:水平断端に癌浸潤を認める,垂直断端(粘膜下層断端:VM)もHMと同様に,VMX,VM0,VM1に分けられている。注釈には,「癌と腺腫成分が共存する病変で腺腫が切除端にある場合,癌と分けて腺腫成分陽性と記載する」とある。HM0(adenoma(+))は,癌の水平断端陰性であるが,腺腫の水平断端は陽性という意味である。
一方,垂直断端は,「垂直断端までの距離が500μm以内の例で局所再発が報告されている」との注釈がある。したがって,VM0の場合,断端から癌までの距離を記載することが望ましい(必ずしも記載する必要はない)。
また,内視鏡摘除後の癌遺残(ER)については, ERX:HMXまたはVMX,ER0:HM0かつVM0,ER1(ER1a〔HM1,VM0〕,ER1b〔HM0,VM1またはHM1,VM1〕)とER2(明らかな癌遺残)に分けることになっている(病理診断で評価する場合は,pHMの如くpathologyのpを所見記号の前に付して表すことになっているが,字数の関係で本稿では省略した)。
著者らのグループは,これらの内視鏡摘除後の癌遺残もしくは再発についての研究を大腸癌研究会のプロジェクト研究で行っている。それらで集められた症例の一部を症例1~4で提示している。実際の症例で上記記載から癌遺残が考慮されたとしても追加切除した結果,遺残再発のなかった症例も多くみられ,その一方でリンパ節転移や遠隔転移がみられた症例もあった。早期大腸癌の内視鏡摘除後の治療方針の決定は今後ますます重要であるが,その為には摘除標本の緻密な組織学的検索が必須であることに留意する必要がある。
深達度,HM,VM以外にも簇出(budding:BD1~3),V(Victoria Blue/Elastica van Gieson染色,VX,V0,V1a,V1b,V1c,V2),Ly(D2-40などの免疫染色),の診断精度管理も重要である。
さらに,私見として疑問に思うことがある。種々の内視鏡摘除後の追加治療の基準について,追加外科治療された標本の病理診断で癌遺残やリンパ節転移がない場合,“over-surgery” と評価される場合があるが,“over-surgery” とは何か。
仮に,早期大腸癌や早期胃癌で外科治療された結果,リンパ節転移がない場合に,リンパ郭清は “over-surgery” と評価されるのであろうか。
また,これらの基準の一つである病理診断の均霑化といっても限界がある。未来展望としてさらに優秀な目と分析能力をもった機器が開発されることを祈念するが,現状としては所詮,顕微鏡下で行われる,人間の目と経験(教育と感性=頭脳)で判定される病理診断である。
現状では,できるだけリスクの少ない治療基準での,完治を目標にした臨床医と病理医の協力が大事であると思う。現状の対応と未来に向けての試みでの基準づくりを,今は混同してはいけない。
(監修コメント=社会医療法人神鋼記念会神鋼記念病院病理診断センター 藤盛孝博,市川一仁)
症例1 側方切除断端陽性となった腺腫症例
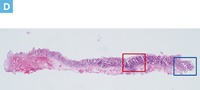
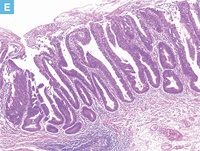
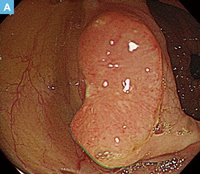
55歳男性。便潜血反応陽性の精査のため下部消化管内視鏡検査を施行した。上行結腸に3cm大のLST型病変を認めた。拡大色素内視鏡ではⅢL型pitが主体であり,腺腫の診断にて内視鏡的粘膜切除術(EMR)が施行された。切除標本では管状構造を示す異型腺管の増生を認めた。腫瘍細胞は紡錘形で重積の目立つ核を有し,極性の乱れは目立たず,低異型度(中等度異型)管状腺腫と診断した。側方切除断端では熱変性を伴う腺腫腺管がみられ,側方断端陽性と判断した。内視鏡切除後3ヵ月経過後の内視鏡検査では再発を認めない。
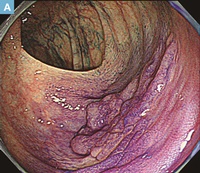
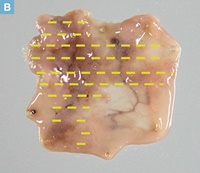
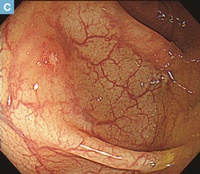
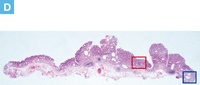
【Caption】
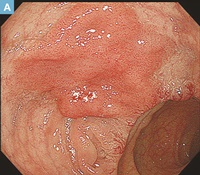
A:クリスタルバイオレット散布通常観察内視鏡所見。扁平な隆起を示す側方進展型の病変を認める。
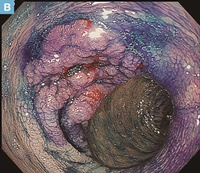
B:固定後切除標本の肉眼像およびマッピング。25×25mmのLST-NG-F型の病変を認める。側方切除断端に病変が及んでいる。
C:内視鏡切除後3ヵ月経過後の内視鏡所見。びらんを伴う発赤調の領域が認められる。
D:内視鏡切除標本のルーペ像。
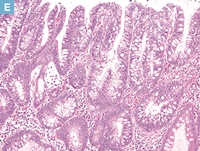
E:病変中心部の拡大像(D:赤枠内)。管状構造を示す腫瘍腺管の増生を認める。
F:側方切除断端部の拡大像(D:青枠内)。側方切除断端部では熱変性を伴う腺腫腺管が認められる。
症例2 内視鏡切除後に再発をきたした側方切除断端陽性の早期癌症例
59歳男性。S状結腸癌切除後の経過観察の下部消化管内視鏡検査にて上部直腸に25mm大のLST型病変を認めた。色素内視鏡でⅤi型のpit patternを示し早期直腸癌の診断にてEMRが施行された。切除標本で腫瘍組織は強い異型を示す腫瘍細胞が不規則な管状腺管構造を示し増殖しており,高分化型腺癌と診断した。粘膜下層への浸潤は認められない。病変内には腺腫成分は明らかではなかった。側方切除断端では熱変性を伴う癌腺管がみられ,側方断端陽性と判断した。内視鏡切除後3ヵ月経過後の内視鏡検査では組織生検で粘膜内に異型上皮がみられ,再発もしくは遺残と考えた。

【Caption】
A:白色光観察。
B:クリスタルバイオレット散布通常観察内視鏡。扁平な隆起を示す側方進展型の病変を認める。
C:固定後切除標本の肉眼像およびマッピング。25×20mmのLST-NG-F型の病変を認める。側方切除断端に病変が及んでいる。
D:内視鏡切除標本のルーペ像。
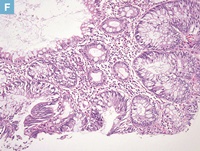
E:病変中心部の拡大像(D:赤枠内)。不規則な管状腺管形成を示す癌細胞の増殖を認める。
F:側方切除断端部の拡大像(D:青枠内)。側方切除断端部では熱変性を伴う癌腺管が認められる。
症例3 粘膜下層浸潤大腸癌症例
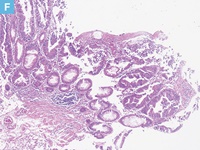
61歳男性。血便の精査の下部消化管内視鏡検査にて上行結腸に10mm大の0-Ⅱaの病変を認めた。クリスタルバイオレット染色を用いた拡大観察ではⅤiないしはⅤn型pitを認め,粘膜下層浸潤の可能性も否定できず,診断目的も兼ねてEMRが施行された。切除標本では不規則な腺管形成を示す中分化型腺癌の浸潤性増殖が認められた。癌細胞の浸潤は粘膜下層に及んでおり,粘膜下層浸潤距離は表層から計測して1,800μm(SM2)であった。深部断端では組織の熱変性が強くみられたが,癌の浸潤先進部から深部断端までの距離は700μmであり,VM(―)と診断した。内視鏡切除後36ヵ月経過しているが,再発は認められない。
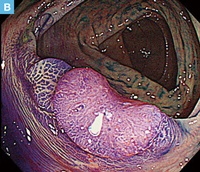
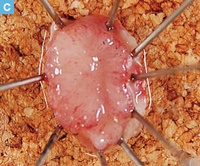
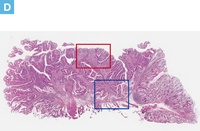
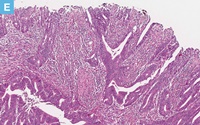
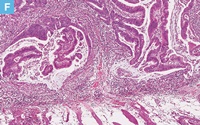
【Caption】
A:白色光観察。
B:クリスタルバイオレット散布通常観察。やや発赤調の0-Ⅱa病変を認める。
C:切除標本の肉眼像。11×10mmの0-Ⅱa型の病変を認める。
D:内視鏡切除標本のルーペ像。粘膜下層に浸潤する癌細胞の増殖を認める。
E:表層部から粘膜下層浸潤部の拡大像(D:赤枠内)。不規則な管状構造を示す腫瘍腺管の増生を認める。間質には強いdesmoplastic reactionを伴う。
F:深部切除断端部の拡大像(D:青枠内)。強い熱変性の加わった深部切除断端に近接する癌細胞を認める。癌腺管周囲に粘液の貯留を伴う。
症例4 リンパ節再発をきたした粘膜下層浸潤癌症例
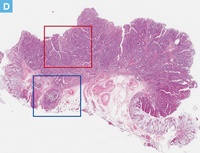
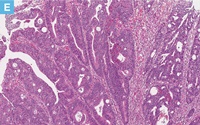
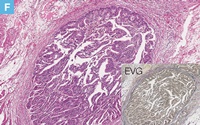
71歳男性。血便の精査の下部消化管内視鏡検査にてS状結腸に20mm大の0-Ⅱa病変を認めた。クリスタルバイオレット染色を用いた拡大観察ではⅤi型pitを認め,早期大腸癌の診断にてEMRが施行された。切除標本では癒合状の腺管形成を示す中分化型腺癌の浸潤性増殖が認められた。癌細胞の浸潤は粘膜下層に及んでおり,粘膜下層浸潤距離は表層から計測して4,350μm(SM2)であった。深部切除断端部では癌の静脈侵襲が認められ,深部断端に近接していたが,癌の浸潤先進部から深部断端までの距離は430μmであり,VM(―)と診断した。内視鏡切除後3ヵ月に追加腸切除術が施行された。癌組織の遺残はみられなかったが,リンパ節に癌細胞の転移を認めた。
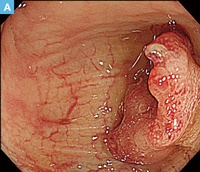
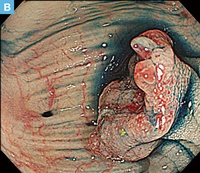
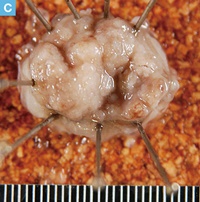
【Caption】
A:白色光観察。
B:クリスタルバイオレット散布通常観察。中心に陥凹様の領域を伴う0-Ⅱa病変を認める。
C:固定後切除標本の肉眼像。20×10mmの0-Ⅱa型の病変を認める。
D:内視鏡切除標本のルーペ像。粘膜下層に浸潤する癌細胞の増殖を認める。
E:表層部から粘膜下層浸潤部の拡大像(D:赤枠内)。癒合状の腺管形成を示す癌細胞の増殖を認める。間質のdesmoplastic reactionは軽度である。
F:深部切除断端部の拡大像(D:青枠内)。癌の静脈侵襲を認める(枠内はEVG染色)。









