
Clinical Questions
CQ 2:最大径2cm以上の腫瘍性病変に対する内視鏡的切除としてESDは推奨されるか?
CQ 3:早期大腸癌の内視鏡的切除後にサーベイランスは推奨されるか?
CQ 4:大腸癌に対して腹腔鏡下手術は推奨されるか?
CQ 5:直腸癌に対して側方郭清は推奨されるか?
CQ 6:切除不能な遠隔転移を有する症例に原発巣切除は推奨されるか?
CQ 7:腹膜転移を認めた場合,原発巣と同時に切除することは推奨されるか?
CQ 8:肝転移と肺転移の双方を同時に有する症例の転移巣の切除は推奨されるか?
CQ 9:切除可能な肝転移に対する術前・術後補助化学療法は推奨されるか?
CQ 10:薬物療法が奏効して切除可能となった肝転移,肺転移に対する切除は推奨されるか?
CQ 11:薬物療法が奏効して画像上消失した肝転移巣の切除は推奨されるか?
CQ 12:大腸癌肝転移に対する腹腔鏡下手術は推奨されるか?
CQ 13:肝転移巣に対する熱凝固療法は推奨されるか?
CQ 14:直腸癌局所再発の切除は推奨されるか?
CQ 15:StageⅢ結腸癌に術後補助化学療法は推奨されるか?
CQ 16:StageⅢ大腸癌術後補助化学療法の治療期間は6カ月が推奨されるか?
CQ 17:70 歳以上の高齢者に術後補助化学療法は推奨されるか?
CQ 18:StageⅡ大腸癌に術後補助化学療法は推奨されるか?
CQ 19:肝転移以外の遠隔転移巣切除後の補助化学療法は推奨されるか?
CQ 20:切除不能大腸癌に対する一次・二次治療として分子標的治療薬の併用は推奨されるか?
CQ 21:切除不能大腸癌に対する後方治療は推奨されるか?
CQ 22:切除不能大腸癌に対する免疫チェックポイント阻害薬は推奨されるか?
CQ 23:BRAFV600E変異切除不能大腸癌に対するBRAF 阻害薬は推奨されるか?
CQ 24:切除不能大腸癌に対する包括的がんゲノムプロファイリング検査は推奨されるか?
CQ 25:R0 切除可能な直腸癌に対して術前治療は推奨されるか?
CQ 26:遠隔転移のない切除不能な局所進行再発直腸癌に対する化学放射線療法は推奨されるか?
CQ 27:閉塞性大腸癌にステント治療は推奨されるか?
CQ 28:大腸癌治癒切除後に多重がん(多発癌および重複がん)のサーベイランスは推奨されるか?
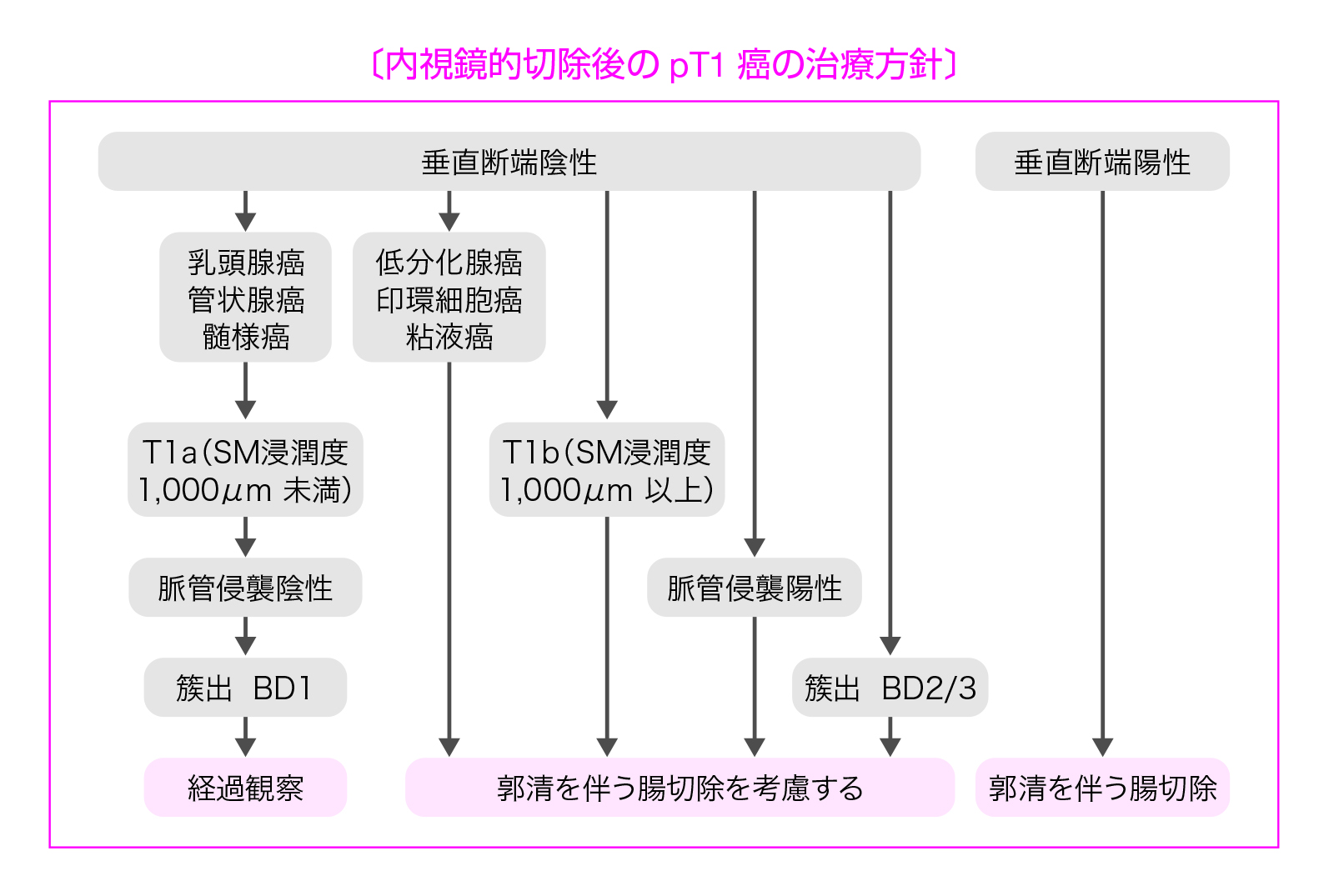
CQ 1:内視鏡的切除されたpT1 大腸癌の追加治療の適応基準は何か?
(2)脈管侵襲陽性
(3)低分化腺癌,印環細胞癌,粘液癌
(4)浸潤先進部の簇出(budding)BD2/3
注)
・垂直断端陽性とは,癌が粘膜下層断端に露出しているものである。
・脈管侵襲とは,リンパ管侵襲と静脈侵襲をいう。
垂直断端陽性の場合は断端陰性と比べて,癌の局所遺残や,切除標本による浸潤先進部の正確な病理組織診断ができないなどの問題から,経過観察した場合の再発リスクが高いと考えられる。エビデンスレベルはCであるが,害と益のバランスを考慮し,委員の投票の結果「強い推奨」に決定した。
浸潤癌であるpT1癌の治療の原則はリンパ節郭清を伴う腸切除である。しかし,転移リスクが極めて低いpT1癌が存在することも事実であり,そのような症例に対して結果的には過剰治療となる追加切除を可及的に減じることが本基準の作成目的である。現在のところ,リンパ節転移(pN)を確実に予知できる診断法は存在しないが,転移リスクの高低を追加治療実施の判断材料として利用することが可能である。
pT1癌の所属リンパ節転移リスク因子として,粘膜下層の浸潤距離(SM浸潤度),低分化腺癌・印環細胞癌・粘液癌などの組織型,浸潤先進部の低分化領域・粘液結節の存在,簇出,脈管侵襲などが報告されている。
上記の追加治療の適応基準は,『大腸癌取扱い規約』(第2版,1980年)に記載されてきたpT1癌の追加腸切除の3項目(①明らかな脈管内癌浸潤,②低分化腺癌あるいは未分化癌,③断端近傍までのmassiveな癌浸潤)をもとに作成されたものであり,「massiveな癌浸潤」は『大腸癌取扱い規約』の第5版(1994年)において「たとえば約200~300μmを超えた程度の“きわめて浅い浸潤”より深い浸潤」と具体的記述に改訂された。
その後の本邦における症例集積研究から,この基準線は1,000μmまで拡大することが可能であることが示された。大腸癌研究会のプロジェクト研究によればSM浸潤度1,000μm以上のリンパ節転移率は12.5%であった(表11)。しかしながら,1,000μm以深浸潤例のすべてが追加手術の絶対適応になるわけではない。SM浸潤度1,000μm以上であっても9割程度はリンパ節転移がないわけであり,SM浸潤度以外のリンパ節転移危険因子,個々の症例の身体的・社会的背景,患者自身の意思等を十分に考慮したうえで追加治療の適応を決定することが重要である。また,癌の組織型を主組織型ではなく最も低い分化度成分で評価した場合,SM浸潤度以外のリンパ節転移リスク因子がすべて陰性のSM浸潤度1,000μm以上のリンパ節転移率は1.3%(95%信頼区間0‒2.4%)と報告されている。しかしながら転移再発した場合はサルベージ手術が適応できない場合が多く,癌死の可能性もあり,そのリスクを十分外科医も含めて議論する必要がある。2009年版で追加治療を考慮すべき因子として簇出(budding)を追加したが,さらに他の病理組織学的因子に関するプロジェクト研究も現在進行中である。多施設共同研究からは本基準の妥当性の検討結果が報告されている。なお,海外における追加治療の適応基準として,欧州消化器内視鏡学会(ESGE)のガイドラインでは,脈管侵襲陽性,SM浸潤度1,000μm以上,垂直断端陽性,SM浸潤部の低分化腺癌が推奨されている。
CQ 2:最大径2cm以上の腫瘍性病変に対する内視鏡的切除としてESDは推奨されるか?
内視鏡的切除にあたっては,正確な術前内視鏡診断が必須条件であり,術者の内視鏡的切除の技量を考慮して切除法を選択する。
癌を疑う病変であれば一括切除が原則であり一括EMRが困難と判断すれば,しかるべき技量をもった内視鏡医によるESD(一括切除)を強く推奨する。(推奨度1・エビデンスレベルB)
腺腫,cTis癌およびcT1軽度浸潤病変が内視鏡治療のよい適応で,cT1高度浸潤癌は病変の大きさにかかわらず適応外である。切除標本の正確な病理診断のために癌病変の一括切除が要件であり,一般にスネアのサイズからEMRで一括切除が可能な病変は最大径2cm程度である。
しかし,腺腫成分を伴う病変(腺腫内癌)では腺腫部分での分断による計画的分割EMR(癌部分は一括切除する)の根治性が確認されており,最大径2cm以上のLST(laterally spreading tumor)の一部は分割EMRのよい適応となる。ただし,分割EMRには確実なスネアリング技術が必要であることに留意すべきであり,また正確な組織学的判定が困難となるような多分割切除は避けるべきである。なお,腺腫部と癌部の判別には,インジゴカルミン散布やクリスタルバイオレット染色による色素内視鏡観察や拡大観察によるNBI/BLIなどの画像強調観察やpit pattern 診断が有用である。ESDを用いれば径2cm以上の病変も一括切除が可能であるが,ESDは手技の難度がEMRと比べると高く,非熟練者が施行した場合は,穿孔などの偶発症発症率も高くなることを考慮すべきである。しかしながら保険収載に伴い大腸ESDの件数が近年飛躍的に増加しており,デバイスの改良,ESD strategyの確立に伴い,熟練者が施行すれば安全に施行できるようになっている。
CQ 3:早期大腸癌の内視鏡的切除後にサーベイランスは推奨されるか?
早期大腸癌を内視鏡切除した後の異時性大腸腫瘍発生を評価した報告はほとんどなく,多くの報告はhigh grade dysplasia(HGD)(本邦のpTis癌に相当)を含むadvanced neoplasia(AN)の切除後の検討である。初回検査でHGDを有する場合の経過観察中の異時性ANの発生リスク比は大腸腫瘍がなかった群の6.9倍であり,10mm以上の腺腫,絨毛腺腫と同等である。サーベイランスの是非については,米国のThe National Polyp Studyの長期コホート研究の結果から,HGDを含む,大腸腫瘍切除後にサーベイランス検査が定期的に実施されれば,15.8年の経過観察において大腸癌死亡率が53%抑制されたと報告された。一方,AN切除後,サーベイランスを行わない場合,サーベイランス群と比較し,異時性大腸癌のリスクが4.26倍に増加したという報告がある。以上より早期大腸癌の内視鏡切除後のサーベイランスは必須と考えられる。米国および欧州のガイドラインではHGD切除後の推奨サーベイランス間隔は3年と設定されている。一方,本邦からは20mm以上の大腸腫瘍切除後3年以内の異時性ANの発生は22.9%であり20mm未満(9.5%)より有意に高率であったという報告がある。また,Japan Polyp Studyグループでランダム化比較試験前に実施した後方視的コホート研究では初回検査で6mm以上の全腫瘍性病変切除後の経過観察中に1年以内に0.13%,2年以内に0.21%の浸潤性大腸癌が発生した。1年以内であっても,浸潤性大腸癌の発生が起こりうるため,3年の間隔を空けると腸管温存できない可能性がある。以上より,初回に早期大腸癌の内視鏡切除を行った後の最初のサーベイランス間隔は1年前後が妥当である。
早期大腸癌の内視鏡切除の結果が分割切除,水平断端陽性であった場合には内視鏡切除の方法にかかわらず,局所再発のリスクが上昇する。特に分割切除後の局所再発は9.1~27.5%で2年以内に発生することが多い。欧州のガイドラインおよび本邦の「大腸EMR/ESDガイドライン」では,分割切除後の次回内視鏡経過観察を6カ月前後に実施することが推奨されている。エビデンスレベルはCであるが,経過観察しなかった場合,局所再発を内視鏡でサルベージできない危険性がある。害と益のバランスを考慮し,委員の投票の結果「強い推奨」に決定した。また,初回の内視鏡検査において前処置不良やポリープ回収等に伴う検査精度の低下があった場合には,post colonoscopy colorectal cancerの原因の一つと考えられており1年以内の短い間隔でのサーベイランスが望ましい。
本邦の多施設後方視的コホート研究(787名,60.5カ月)の結果,追加治療考慮因子を有するpT1癌の内視鏡切除単独群は5年の無再発生存率が89%で,再発が6.6%であった。特に直腸癌では結腸癌と比較し再発率が著明に高く(1.4% vs. 16.2%),追加切除が施行できない場合には,手術後に準じた画像診断や腫瘍マーカーを含む,慎重な経過観察が必須である。また,本研究においては追加治療考慮因子を有さない直腸pT1癌においても6.3%の再発を認めた。以上より,pT1癌で追加腸切除を行わなかった症例においては,CTなどの画像診断や腫瘍マーカーなどを用いたサーベイランスが推奨される。
CQ 4:大腸癌に対して腹腔鏡下手術は推奨されるか?
局所進行癌,肥満や癒着症例は難度が高いので,個々の手術チームの習熟度を十分に考慮して適応を決定する。
海外の大規模ランダム化比較試験やコクランレビューにおいて,結腸癌およびRS癌に対する腹腔鏡下手術の有用性が開腹手術との比較で検討され,腹腔鏡下手術では手術時間が長い一方,出血量が少ない,腸管運動の回復が早い,在院期間が短いなどの短期成績が優れていること,合併症発生率および再発率・生存率は同等であることが報告されている。本邦で行われた大規模ランダム化比較試験であるJCOG0404試験では主要評価項目の全生存期間において,開腹手術群に対する腹腔鏡下手術群のハザード比は1.056(90%信頼区間 0.790‒1.413),p=0.0732であり,腹腔鏡下手術の非劣性は示されなかったものの,5年生存率は開腹手術群で90.4%(95%信頼区間 87.5‒92.6),腹腔鏡下手術群で91.8%(同:89.1‒93.8)でどちらも良好であり,腹腔鏡手術も治療の選択肢として位置づけられる。ただし,本研究では,横行結腸癌,下行結腸癌や直腸癌は対象患者から除外されており,大腸癌全般の適応に関するエビデンスとしては一定のバイアスがかかっている可能性がある。また,同試験のサブグループ解析ではRS,cN2,肥満例やT4にて腹腔鏡下手術の予後が悪い傾向があり,これらを考慮して慎重に適応を決定する必要がある。
横行結腸癌は多くのランダム化比較試験で除外条件とされている。解剖学的特性による支配血管根部周囲の郭清手技の難度を考慮して適応を決定する。その他,肥満例は開腹手術への移行率が高く,手術時間が長く,合併症率も高いこと,開腹既往歴を有する症例は癒着のために難度が高く,開腹手術への移行率が高いことも考慮する。
直腸癌を対象としたCOREAN試験,COLORⅡ試験では,開腹手術群と腹腔鏡下手術群で生存率に差はなかったと報告されている一方,ACOSOG Z6051試験およびALaCaRT試験での腫瘍学的切除成功率の検討では,腹腔鏡下手術群の非劣性は証明されなかった。いずれの試験も術前放射線化学療法が多くの症例で用いられていること,側方郭清を行っていないなど,本邦の治療と乖離していることを考慮する。
単孔式手術などポート数を減らした腹腔鏡下手術も試みられているが,有効性と安全性を多数例で検討した報告はなく,十分に確立されていない。現時点では適正に計画された臨床試験として実施するのが望ましい。大腸癌に対するロボット支援下手術は,従来式の腹腔鏡下手術を比べて開腹移行率の減少,泌尿生殖器機能障害の減少を認めるが,コストが高く,長期予後に関する報告は少なく十分に有用性が確立されていない。2018年4月に保険適用となったが,現時点では対象は直腸癌のみである。
CQ 5:直腸癌に対して側方郭清は推奨されるか?
本邦での後方視的研究によると,下部直腸癌症例の16~23%に側方リンパ節転移が存在する。一般的にこれらの予後は不良であるが,R0切除し得た症例では40~50%に5年生存が得られることが多数報告されており,特に転移個数や領域が限局した症例の郭清効果は高い。大腸癌研究会全国登録における1995~2004年のpT3・T4下部直腸癌症例の傾向スコア解析法を用いた解析でも,側方郭清例の5年全生存率は非郭清例と比較して良好であった(68.9% vs. 62.0%)。後方視的研究の限界として一定のバイアスがかかっている可能性があるものの,複数の研究において郭清効果を示唆する一貫した結果が得られており,側方郭清により生存改善が期待される意義は大きいと考えられる。エビデンスレベルはCであるが,害と益のバランスを考慮し,委員の投票の結果「強い推奨」に決定した。したがって,腫瘍下縁が腹膜反転部より肛門側に存在する直腸癌で,側方領域に転移を疑うリンパ節を有する症例に対しては積極的に側方郭清を行うことが推奨される。術前化学放射線療法を施行した症例においても,治療前に腫大した側方リンパ節が存在する場合には側方リンパ節転移が高率であることが報告されており,側方郭清の省略は推奨されない。
明らかな側方リンパ節転移のない症例における側方郭清の意義に関して,JCOG0212試験では術前CTまたはMRIにて短径10mm以上の側方リンパ節が存在せず,腫瘍下縁が腹膜反転部より肛門側に位置する直腸癌を対象に,無再発生存期間を主要評価項目として直腸間膜切除(ME)群の直腸間膜切除+側方郭清(ME+LLND)群に対する非劣性が検討された。その結果,無再発生存期間において,ME+LLND群に対するME群のハザード比は1.07(90.9% 信頼区間 0.84‒1.36)であり,非劣性マージンの上限を1.34とした本試験において,ME群のME+LLND群に対する非劣性は統計学的に証明されなかった(Pnon‒inferiority=0.0547)。局所再発の頻度はME群(12.6%)に比べてME+LLND群で有意に低率(7.4%)であった。一方,両群の無再発生存曲線は極めて近似しており,副次的評価項目である全生存率,無局所再発生存率のいずれにも有意差はなく,側方郭清の生存改善効果は限定的であることも示唆された。またME+LLND群には約100分の手術時間延長と約240mlの出血量増加が認められ,Grade3~4の手術合併症はME群(16.0%)と比較してME+LLND群(21.7%)で多い傾向があった。排尿機能,男性性機能には有意な差がないものの,中等度以上の勃起機能障害の発生はME群よりもME+LLND群に多い傾向が窺われた。以上より,局所制御の観点から側方領域に腫大したリンパ節が存在しない症例においても側方郭清を一律に省略することは推奨されず,局所制御や生存改善に関して側方郭清に期待される効果の程度を認識し,手術リスク・術後機能障害とのバランスを総合的に考慮して適応を決定すべきである。
現時点では側方郭清を省略できる症例の基準は明らかでない。術前放射線療法と側方郭清の治療効果が同等とのRCTの結果も報告されているが検討症例数が少なく,この結果の再現性を検証した試験もない。また,側方リンパ節転移の術前診断の精度についても十分でなく,診断基準の確立はいまだ焦眉の課題である。大腸癌研究会の後方視的研究によると,MRIによる側方リンパ節転移の診断能は短径10mmをカットオフとするよりも短径5mmをカットオフとしたほうが良好であるが,従来の撮影法によるリンパ節径のみを基準とした診断能の限界も示されている。現在,高解像度MRIを用いた側方転移の診断基準の確立に関する大腸癌研究会の多施設研究が進行中であり,この研究の成果が待たれる。
CQ 6:切除不能な遠隔転移を有する症例に原発巣切除は推奨されるか?
原発巣による症状がない場合は,原発巣を切除せず全身薬物療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB)
切除不能な遠隔転移を有する大腸癌の原発巣切除の適応は議論の多い問題である。閉塞や出血など,保存的療法では制御困難な症状を緩和する目的で行われる原発巣切除あるいは人工肛門造設やバイパス手術については異論が少ない。論文や学会発表による明確なエビデンスはないが,害と益のバランスを考慮して,委員の投票の結果「強い推奨」に決定した。過大侵襲とならない切除であれば,原発巣を切除して早期に全身薬物療法を行うことが強く推奨される。
一方,無症状ないし症状が軽微な症例に対する適応にはさまざまな考え方があり,予測される症状の出現に先んじて原発巣切除を行うことの有用性が問題となる。このような症例に対し,原発巣切除を先行したほうが薬物療法を先行した症例より生存期間が延長し,症状に対する緊急的な対応が回避できたとの後方視的研究のメタアナリシスの報告があるが,限られた生命予後のなかで原発巣の切除が症状緩和などのQOLの改善にどれほど寄与するかを予測することは容易ではない。本病態は高度の進行担癌状態であり,手術合併症や手術死亡のリスクが高いことから,原発巣を切除せず全身薬物療法を行う治療方針を考慮する必要がある。
最近本邦から,切除不能転移を伴う無症状の大腸癌における原発巣切除に関する無作為比較試験(JCOG1007)の結果が発表され,主評価項目である全生存は原発巣切除を行って薬物療法(mFOLFOX6またはCapeOX+bevacizumab)を行った患者群と薬物療法単独の患者群との間に差がない(生存期間中央値25.9月vs. 26.4月)ことが報告された。副次評価項目である有害事象,薬物療法の転移巣に対する奏効の結果R0切除が行われた症例の頻度にも両群間で差はなかった。しかしながら本試験では全周性の病変やスコープ通過不能病変など,現時点では無症候であるが癌の進行や薬物療法の効果によっては原発巣による症状が早期に出現する可能性がある症例における原発巣切除の意義は十分に検証されているとはいえない。本試験の薬物療法単独群において,原発巣による症状が出現して手術を要した患者の割合は13%であった。既報においては原発巣を切除せず分子標的薬併用の薬物療法を行った場合に,閉塞や穿孔などの原発巣合併症の累積発生率は16%(2年)と報告されている。また,患者のQOLに関しても検証されていない。したがって多くの場合で無症状の原発巣に対する切除を先行させる必要はないと考えられるが,原発巣の症状,転移の状態,全身状態のほか,生命予後,手術のリスク,切除による症状緩和の効果予測などの臨床的な状況を総合的に判断する必要があると考えられる。現在海外においても無作為比較試験が数試験進行中であり,これらの結果で無症状の原発巣に対する切除の意義はより一層明らかになることが予想される。
CQ 7:腹膜転移を認めた場合,原発巣と同時に切除することは推奨されるか?
切除による予後の改善や長期生存例が報告されており,過大な侵襲を伴わずに切除可能な同時性限局性転移(P1,P2)は原発巣とともに切除することが望ましい。特に,血行性転移を伴わないP1‒P2では原発巣と共に切除することがより有効である。生存改善が期待される意義は大きいと考えられ,エビデンスレベルはCであるが,委員の投票の結果「強い推奨」に決定した。
海外からは,広汎に転移を認める場合(P3)には,腫瘍減量手術(cytoreductive surgery)と腹腔内温熱化学療法(hyperthermic intraperitoneal chemotherapy:HIPEC)との有用性が報告されている。しかしながら,実際に本療法を実施しているのは海外でも限られた医療機関のみで,本邦においてはほとんど治療実績を有しておらず,一般の医療機関で実施できる治療法ではない。
CQ 8:肝転移と肺転移の双方を同時に有する症例の転移巣の切除は推奨されるか?
同時期に肝転移と肺転移をともに有する症例でも,切除により長期生存あるいは治癒が得られることがある。しかしながら,肝肺転移をともに有する症例では原発巣や転移巣の進展が高度であることや,肝肺以外にも転移を認めることが多く,完全切除の可能性は一定の見解が得られていない。Adamらの報告では,肝および肝外病変を有する186例213病変のうち108病変(51%)が肺転移で,そのうち42病変(39%)で完全切除が可能であった。その一方で本邦におけるKobayashiらの集計によれば,351例の肺転移切除例のうち47例に肝転移切除が行われたが,同時期に肝肺転移が切除されたのは7例(2%)のみであった。このような希少性から,切除後の予後に関してはこれまで大規模な検討はなされていなかった。近年の大腸癌肝転移R0/R1切除後の症例を集積した大規模データベース(Liver-MetSurvey)における検討では,肝・肺切除を行った症例の予後は,肝転移のみがあり肝切除を行った症例の予後とほぼ同等であった。一方,両転移巣切除後の長期生存は,肺転移が孤立性の場合のみ得られるとの報告や,肝肺転移のうち肺転移が切除不能でも肝転移を切除すると予後が改善するという報告がある。
肝・肺切除が有効な症例を予測する因子は十分には解明されていない。術前CEAとCA19‒9,無再発期間,肝転移・肺転移個数,原発巣の占居部位,年齢,胸腔内リンパ節転移の有無が予後因子として重要との報告がある。同時性転移よりも異時性転移のほうが予後良好であるが,現時点では切除に関する明確な適応基準はない。また,近年のOX,IRIや分子標的薬を含む薬物療法の進歩は,肝肺転移症例に対する手術成績にも影響を与えている。現在の薬物療法のもとでの肝肺同時転移症例の治療成績を評価することが必要であろう。
肝・肺転移をともに有する症例に対する外科治療に関して,報告されているのはすべて後方視的研究であるが,肝肺転移の切除が予後改善に寄与する症例が一定の割合で存在することは確かであり,真に肝肺転移巣切除の恩恵を受けられる患者集団を明らかにするためには,前向きな臨床研究が求められる。
現状では,手術適応基準を決するに足るデータはないこと,治癒率は高くないこと,切除後の予後予測因子は不明であることなどに関し,十分なインフォームド・コンセントを得る必要がある。
CQ 9:切除可能な肝転移に対する術前・術後補助化学療法は推奨されるか?
切除可能な肝転移に対する最も効果が高い治療法は根治的な外科切除である。しかし,肝転移巣切除後の再発率は約45~70%と高く,治療成績の向上が必要である。そのため,再発を抑制して予後を改善する目的に術前もしくは術後や術前後両方に補助化学療法が検討されてきた。
術前補助化学療法に期待される効果は,腫瘍縮小に伴う肝切除量の減少や切離端の確保,微小転移巣の早期治療,薬物療法の奏効性判定などである。一方で,術前補助化学療法を行っている間に非奏効例が切除不能となるリスク,抗がん剤による肝障害や周術期合併症のリスクとなるなどの問題もある。一方,術後補助化学療法では治療開始の遅延のリスクや,治療の強度や完遂率が下がる可能性がある。
術前補助化学療法は,奏効例の予後が良好である可能性が後方視的研究により報告されているが),術前化学療法から切除に至る過程で条件の良い症例を選択している可能性があり,術前化学療法+肝切除と肝切除単独の生存期間を前向きに比較した試験の結果は公表されておらず,その有用性は示されていない。
EORTC(European Organization for Research and Treatment of Cancer)で外科的切除単独とFOLFOX4の術前・術後化学療法+外科的切除のランダム化比較試験(EORTC40983試験)が行われFOLFOX4群で無増悪生存期間が優れていたと報告されたが,その試験デザインや結果の解釈にはいくつかの問題点が指摘され,また,続報で全生存期間におけるFOLFOX4群の優越性は認められなかった(5年全生存率:FOLFOX4群51.2%,手術単独群47.8%)。
実地臨床では,再発リスクが高い症例や非R0手術のリスクがある症例に対して化学療法が手術に先行して行われる場合があるが,個々の症例で慎重に判断すべきであり,治癒切除可能な肝転移に対する術前補助化学療法を行わないことを弱く推奨する。
肝切除後の補助化学療法は,肝動注療法と全身薬物療法に関するエビデンスが報告されている。肝動注療法は,残肝への再発抑制効果は示されているものの,肝以外の遠隔転移再発抑制や生存期間延長には寄与しないことが報告されている。一方,全身薬物療法は,現在まで3つのランダム化比較試験(FFCD09002試験,Hasegawaらの試験,JCOG0603試験)と1つの統合解析にて有用性に関する報告がある。FFCD09002試験は,肝転移治癒切除例を対象に手術単独と5-FU+LV療法による術後補助化学療法の比較試験であり,5年無再発生存率は化学療法群が有意に良好であったが,全生存期間は有意差を認めなかった。本試験と欧州,カナダで実施されたENG試験を合わせた統合解析において,5-FU+l-LV療法による術後補助化学療法群は手術単独と比べて,有意差はないものの無増悪生存期間,全生存期間が良好であり,多変量解析では術後補助化学療法の実施は独立した予後良好因子であることが報告された。Hasegawaらの試験は,肝転移治癒切除例を対象に手術単独とUFT+LV療法を用いた術後補助化学療法が比較され,3年無再発生存期間は術後UFT+LV群で有意に良好(ハザード比 0.56,95% 信頼区間 0.38‒0.83)であったが,全生存期間では有意差を認めなかった(ハザード比 0.80,95% 信頼区間 0.48‒1.35)。JCOG0603試験は,手術単独とmFOLFOX6療法を用いた術後補助化学療法のランダム化比較試験であり,主要評価項目の無増悪生存期間は術後補助化学療法群で有意に良好(ハザード比 0.63,95% 信頼区間 0.45‒0.89)であったが,全生存期間は有意差を認めなかった(ハザード比 1.35,95% 信頼区間 0.84‒2.19)。
以上より,肝転移切除後の全身化学療法は,その再発抑制効果は示されたが,生存期間の延長は示されていない。再発の抑制あるいは再発時期の遅延は,補助療法が適切に施行されれば,患者の利益となり得ると考えられ,術後の補助化学療法が弱く推奨される。ただし,実施の判断は,生存期間の延長効果が示されていない現状を踏まえ,治療に伴う通院や有害事象による患者への負担,肝障害による再発した場合の再肝切除への影響なども考慮して個々の患者に応じて行う。大腸癌肝転移切除後の主な予後因子として,原発巣組織型や壁深達度,リンパ節転移個数,肝転移時期(同時,異時),肝転移最大径,肝転移個数などが報告されているが,再発高リスクの定義は確立していない。術後補助化学療法の治療レジメンはフッ化ピリミジン単独療法とoxaliplatin併用療法が選択肢となり,期待される効果と有害事象,患者背景などを考慮して選択する。
CQ 10:薬物療法が奏効して切除可能となった肝転移,肺転移に対する切除は推奨されるか?
近年,全身薬物療法後に根治切除が可能になる(conversion therapy)症例が一定の割合で存在することが判明してきた。また,薬物療法の奏効割合と肝転移巣の切除率には密接な関連があることが報告されている。全身薬物療法に分子標的薬を加えたレジメンで高い肝転移の切除率が報告されているが,分子標的薬を加えても切除率は変わらないとする報告もある。
切除不能の肝限局転移において,薬物療法が奏効して肝切除を行った症例では,切除可能に至らなかった症例に比べ,予後が良好であったとの報告があり,薬物療法が奏効して切除可能となった肝転移には切除を考慮する。しかしながら,薬物療法が奏効して切除可能となった症例では,転移診断時から切除可能な肝転移例ほどの予後は期待できないとの報告がある。さらに,薬物療法後の肝転移に対する肝切除の安全性に関しては,いまだ十分なエビデンスの集積はなされてはいないのが現状である。
一方,薬物療法が奏効して切除可能となった肺転移例の報告は少なく,かつ,肝転移に比べて切除率は非常に低い。有効性のエビデンスに乏しいが,薬物療法後に肺切除可能となった症例の中には長期生存の報告もあり,肺外病変がなければ現時点では切除を考慮してもよい。
CQ 11:薬物療法が奏効して画像上消失した肝転移巣の切除は推奨されるか?
当初は切除不能であったが,薬物療法がよく奏効して切除可能となった肝転移患者において,薬物療法後にCT画像上で消失したと診断された肝転移病変(disappearing liver metastases:DLM)が1つ以上存在することは,独立した強い予後因子であるといわれている465)。転移性肝病変の約20~25%が,6~12コースの薬物療法によって消失すると報告されているが,画像上の完全奏効が認められたとしても,常に病理学的な完全奏効(腫瘍細胞の消失)が得られているわけではない。
現在のところ,DLMの報告は非常に限られている。報告はすべて単施設で行われた後方視的観察研究であり,術前にDLMと診断されたもののうち,術後に画像上の再発を認めないか,あるいは病理学的完全奏効であった病変の割合は33~83%とさまざまである。これらの結果から分かることは,術前に画像上で消失したDLMと診断されても,依然として腫瘍細胞が残存している可能性が高いということである。そのため,多くの報告の中でDLMが存在していた部位の切除が推奨されている。一方で,将来の残肝再発に対する再肝切除を見据えて,できるだけ多くの残肝を温存することを企図して,同定可能な病変のみを切除もしくは焼灼することを推奨する意見もあるが一定の見解は得られていない。実際の日常臨床では,術前の画像上で診断されたDLMが術中に超音波で同定可能かつ切除しやすい箇所に存在する場合,DLMは切除される傾向にある。他方でDLMが術中超音波でも同定不可能である場合は,切除されずそのまま残される傾向にあり,現在の日常診療で標準的に用いられているCTとMRIの両方で画像診断された所見と,病理組織学的所見との関連についての十分なデータは存在しないため,DLMの最適な治療法はいまだ議論のあるところである。DLMに対して最適な画像診断モダリティを決定し,DLMの細胞学的特性を明らかにするため,薬物療法にて消失した大腸癌肝転移病変に対するCTとMRIの術前診断能の妥当性に関する,日欧共同の観察研究(JCOG1609INT)が進行中であり,これらの成果が待たれるところである。
CQ 12:大腸癌肝転移に対する腹腔鏡下手術は推奨されるか?
本邦における傾向スコア解析を用いた多施設共同研究や,海外の多施設共同研究やメタアナリシスにおいて,大腸癌肝転移に対する腹腔鏡下手術の有効性および安全性が開腹手術と同等であると報告されている。海外の単施設のランダム化比較試験では,適応を部分切除のみとした場合,腹腔鏡群は開腹群に比べ,術後合併症率が低く,在院期間が短かった。本邦において,特定の施設で腹腔鏡下肝切除の死亡例が多発し,社会問題となったことがあったが,National Clinical Databaseを用いた大規模調査が行われ,比較的悉皆性の高いデータでも腹腔鏡下肝切除の死亡率は開腹に劣らない点が示された。
ただし,腹腔鏡下肝切除では開腹手術に比べ難度は高く,手技の習得に,より多くの時間を要する。腫瘍の位置・切除術式・腫瘍径・主要脈管との関係・肝機能などから腹腔鏡下肝切除手技の難度を判定し,術者の経験に応じた症例を選択するなど,慎重に適応を検討する必要がある。Couinaudの肝区域1,4a,7,8の切除,高度肥満例,再肝切除例,術前化学療法施行例,などは特に高難度とされる。2016年4月より腹腔鏡下肝切除術のすべての術式が保険収載されたが,部分切除と外側区域切除以外の腹腔鏡下肝切除を実施するためには,10例以上の腹腔鏡下肝切除を術者として経験した医師の常勤・当該施設が年間20例以上の肝切除と年間100例以上の腹腔鏡手術を行っていること,などの施設基準を満たす必要がある。加えて,部分切除と外側区域切除以外の術式に関しては前向き登録を行うことが義務となっている。
一方,大腸癌肝転移に対する腹腔鏡下肝切除の長期成績における意義は確立されていない。現時点で開腹群と腹腔鏡群の長期成績に関するランダム化比較試験による報告はなく,後方視的研究による比較検討のみである。ただし,技術的に開腹アプローチのみで切除可能となる症例はあるが,腹腔鏡を使わねば対処し得ない条件は,現在のところ存在しない点は考慮する必要がある。また,腹腔鏡下手術で実施される術式が,標準治療である開腹手術で想定される術式と異なり,非がん部の切除量に違いが生じることがあり得る。もし,腹腔鏡下手術の採用のため,開腹での想定術式よりも切除量が大きくなれば,肝内再発に対する繰り返し切除の選択肢を狭める可能性があり,ひいては長期成績の面で不利になり得ることは認識する必要がある。
以上より,腹腔鏡下肝切除は十分に経験を積んだ手術チームが腫瘍の位置などに配慮して,慎重に適応を選べば,安全に施行可能といえる。長期成績に関して,開腹肝切除とのランダム化比較試験はなく,十分なエビデンスはない。推奨度決定会議では「推奨度なし」案を出発点として,議論された。そこでは一部の術式で制限があるものの,そこでは実地臨床で広く普及してきている現状を考慮し,「推奨しない」とはいいがたいとの意見もあり,一方であくまで技量・経験・症例の条件などの前提があったうえでの実施であるべきとの指摘もなされた。1回目の投票では推奨度決定に至らなかったが,2回目の投票にて最終的に「推奨度なし」の結論となった。
CQ 13:肝転移巣に対する熱凝固療法は推奨されるか?
肝腫瘍に対する穿刺局所療法にはエタノール注入法やマイクロ波凝固療法(microwave coagulation therapy:MCT),ラジオ波焼灼療法(radiofrequency ablation:RFA)がある。RFAは他の方法に比べて凝固範囲が広く,穿刺回数が少ないため,大腸癌の肝転移巣に対しては主にRFAが用いられる。RFAの利点は肝切除よりも低侵襲であり,繰り返し施行が可能であることである。しかし,報告されているRFA後の局所再発率は1.7~66.7%と,ばらつきがあるものの肝切除よりも高率であるのは明らかである。RFA後の局所再発の危険因子としては,原発巣の組織型(大腸癌は肝細胞癌や内分泌腫瘍に比べ局所再発率が高い),腫瘍径が大きい場合(3cmを超える),辺縁の焼灼が不十分な場合(マージン1cm未満),主要脈管と隣接している場合などがあげられている。RFA後の5年生存率は14~55%と報告されているが,総じて肝切除を上回るものではない。異時性肝転移に対する肝切除とRFAの比較では,RFAは再発までの期間が短い,局所再発および肝内再発が多い(ただし肝外再発では有意差なし)ことが報告されているが,十分な症例数を前向きに比較検討した報告は少ない。以上より,PSが良好な患者の切除可能な肝転移に対する標準治療は肝切除であり,肝切除の代替としてのRFAは推奨されない。エビデンスレベルはCであるが,害と益のバランスを考慮し,委員の投票の結果「行わないことを強く推奨」に決定した。ただし,低侵襲であるという利点を活かして,PS不良例や,基礎疾患や併存症のため肝切除のリスクが高いと判断される症例に対しては,治療選択肢として考慮に値する。一方,切除不能肝転移症例においては,全身薬物療法と全身薬物療法+RFAを比較した海外のランダム化第Ⅱ相試験(EORTC40004)で,RFAによる全生存期間の上乗せ効果が認められず,また,RFA単独の有効性についてもエビデンスは乏しい。姑息的治療として一定の効果が得られる可能性はあるが,その有効性は確立しているとはいえない。
CQ 14:直腸癌局所再発の切除は推奨されるか?
ただし,手術侵襲とリスク,術後のQOLを考慮したうえで適応を決定すべきである。骨盤内臓全摘,骨性骨盤壁切除などは高難度であり,個々の手術チームの習熟度を十分に考慮する必要がある。
直腸癌局所再発に対し,外科治療と放射線療法を比較したランダム化試験はないが,再発切除例の報告は1990年代にはじまり,本邦からもいくつか報告されている。R0切除が最も受容性の高い予後因子であるが,近年の報告に限ってもR0切除率は37~63%とばらつきは大きい。局所再発手術においては骨盤内臓全摘,骨性骨盤壁切除などの技術的高難度手術が必要になる場合も少なくなく,泌尿器科や整形外科なども含めた個々の手術チームの習熟度を十分に考慮し,R0切除が可能と判断した場合に限り切除を考慮する。術後の高い合併症率やダブルストマなどの術後QOLについて,本人および家族への十分なインフォームド・コンセントも必要不可欠である。R2切除例では予後,局所制御とも明らかに不良であり,またQOLの改善も期待できないため,R0切除が見込めない場合の切除は推奨できない。吻合部再発・前方再発例と比較し,側方再発例でのR0切除率は大きく下がる。仙尾骨や恥坐骨など骨性骨盤壁合併切除によりR0切除が可能となるものがあるが,仙骨切除は第2仙骨下縁に留めるのが一般的である。遠隔転移を有する症例であっても,同時または分割切除により全病変を切除できれば根治が得られる場合もあるが,適応は慎重かつ厳格に考慮すべきである。
術前放射線照射はR0切除率を向上させ,予後を改善するとの報告があり,放射線既治療例に対しても,照射法を工夫することで比較的安全に実施可能と報告されている。また一方,初回放射線既治療例での手術成績は,未治療例と比較し予後が悪いとの報告もある。
術中照射は,実施可能な施設が限られるものの,術前化学放射線療法後に10~20Gyの術中照射を行い,予後が改善したという報告があり,特に他臓器浸潤例または再発例で切除断端が陽性もしくは近接している場合には局所制御率の向上のために考慮してもよい治療法である。
近年,全身薬物療法後に根治切除を行う症例は増加している。しかしながら,切除可能症例に対して手術を前提とした術前化学療法の有効性および安全性を示したエビデンスは皆無であり,留意が必要である。
また近年,重粒子線による手術治療に匹敵する良好な成績が報告されている。2018年4月現在,公的保険適用はないものの,先進医療で施行可能であり,R0切除が困難な症例や手術拒否例などでは選択肢の1つと成り得る。
CQ 15:StageⅢ結腸癌に術後補助化学療法は推奨されるか?
Dukes’BおよびDukes’Cを対象とした欧米での3つのランダム化比較試験の統合解析において,5-FU+l-LVは手術単独と比較して無再発生存期間および全生存期間の延長を示した。その後,StageⅢ結腸癌を対象とした術後補助化学療法において,6カ月のoxaliplatin(OX)併用療法(CAPOX療法およびFOLFOX療法)は,6カ月の5-FU+l-LVに比べて再発・死亡の相対リスクを約20%減少させることが確認され,CAPOX療法およびFOLFOX療法は本邦においても最も有効な治療選択肢として推奨される。一方,ハイリスクStageⅢ(大腸癌取扱規約第7版によるN2もしくは主リンパ節陽性)結腸癌を対象として実施されたACTS‒CC 02試験において,UFT+LVに対するSOXの優越性は示されなかったことからSOX療法は推奨されない。
一方,StageⅢ結腸癌を対象とした術後補助化学療法においてフッ化ピリミジン単独療法も推奨される:(1)5-FU+l-LVに対する(2)Cape(X‒ACT試験)および(3)UFT+LV(NSABP C‒06試験,JCOG0205)の非劣性,UFT+LVに対する(4)S-1の非劣性(ACTS‒CC試験)が示された一方,Capeに対するS-1の非劣性は証明されていない(JCOG0910試験)。なおMSI‒H大腸がんは予後良好であり,5つのランダム化比較試験の統合解析において,StageⅢに対するフッ化ピリミジン単独療法による術後補助化学療法の,手術単独に対するベネフィットは示されていない。
有害事象については,OX併用療法は5-FU+l-LVに比べて有意にgrade3~4の治療関連有害事象の発生が高いことが報告されている。特に末梢神経障害は,治療期間中だけでなく長期に残存することが問題となるが,現時点で強く推奨される有効な予防・治療法はない。このような有害事象と期待される効果のバランスをとるべく,治療期間に関する検討も行われた。StageⅢ結腸癌を対象としたOX併用療法(FOLFOX,CAPOX)による術後補助化学療法の検討で,国内のRCT(JFMC47‒1202:ACHIEVE試験)を含む6つのRCT(TOSCA試験,SCOT試験,IDEA France試験,C80702試験,HORG試験,ACHIEVE試験)の統合解析が行われた(IDEA collaboration)。主評価項目の無病生存率における3カ月投与群(試験群)の6カ月投与群(対照群)に対する非劣性は統計学的には証明されなかった(N=12834人,3年無病生存率74.6% vs. 75.5%,ハザード比 1.07,95% 信頼区間 1.00‒1.15)。一方,有害事象発生割合は3カ月投与群で低く,特にgrade2以上の感覚性末梢神経障害の発現頻度も大幅に低いことが示された(6か月群FOLFOX/CAPOX 48%/45%,3カ月群FOLFOX/CAPOX 17%/14%)。また,治療効果と治療レジメン(FOLFOX群とCAPOX群)との間に交互作用が認められ,FOLFOX群では6カ月投与群の3カ月群に対する優越性が示される一方で,CAPOX群では3カ月群の6カ月群に対する非劣性が示された。また,事前に計画された別のサブグループ解析ではないが,再発低リスク症例(T1‒3かつN1)ではCAPOX 3カ月投与群の非劣性が確認された。また,本邦で実施されたACHIEVE試験は,CAPOX群が75%と多数を占めるものの,3カ月投与と6カ月投与の3年無病生存は同程度であり(6カ月77.9%,3カ月79.5%),IDEA試験と同様の傾向が確認された。また,感覚性末梢神経障害の発現も3カ月投与で有意に少なかった。
コストについては,MOSAIC試験(StageⅢ結腸癌を対象にOX併用療法とフッ化ピリミジン単独療法を比較)の患者レベルデータをもとに本邦で実施された費用対効果解析の報告を含め,OX併用療法は費用対効果に優れた治療であると報告されている。
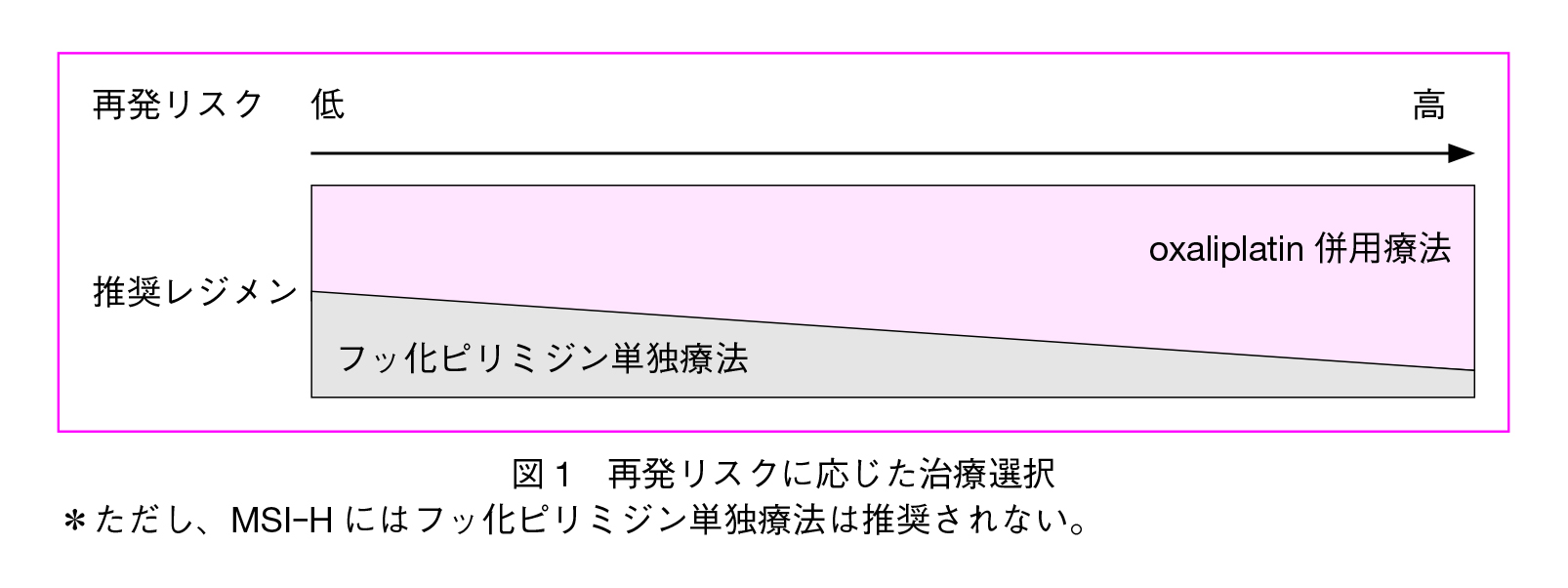
以上より,StageⅢ結腸癌に対してOX併用療法による術後補助化学療法を行うことが推奨されるが,実地臨床では,再発リスクと期待される効果(図1),有害事象,治療コスト,通院回数などの充分な情報提供のもとに,患者の全身状態や治療意欲等も含め,総合的な判断のもとに治療と治療期間を選択することが望ましい。特に再発低リスク例においてはCAPOX3か月間投与が有力な治療選択肢となり得ると考えられる。考慮すべき再発リスク因子としては,病理学的ステージ・T因子・N因子,RAS/BRAF遺伝子型,MSI statusなどが挙げられる。また大腸癌研究会のホームページには,日本人データを用いた結腸癌術後予後予測ノモグラムが用意されている(http://nomogram.jsccr.jp/nomograms)。
直腸癌については,FU単剤による術前化学放射線療法後のypStageⅡ‒Ⅲ直腸癌治癒切除症例に対する,術後FOLFOXと5-FU+l-LVの比較試験において,OX併用による有意に優れた再発抑制効果が示されており(ハザード比 0.657,95% 信頼区間 0.434‒0944),結腸癌と同様にOX併用の効果が期待できる。フッ化ピリミジン単独療法については,StageⅢ直腸癌におけるUFT単独(1年間)の手術単独に対する無再発生存における優越性(ハザード比 0.52,95% 信頼区間 0.33‒0.81,P=0.0014)(NSAS‒CC試験),StageⅡ/Ⅲ直腸癌におけるS-1(1年間)のUFT単独(1年間)に対する優越性(ハザード比 0.77,95% 信頼区間 0.63‒0.96,P=0.0165)が示されている(ACTS‒RC試験)。
CQ 16:StageⅢ大腸癌術後補助化学療法の治療期間は6カ月が推奨されるか?
5-FU+levamisole(LEV)(12カ月)を対照群として,5-FU+l-LV(Mayo法を27週,またはRPMI法を32週)および5-FU+l-LV+LEV(6カ月投与)の比較が行われ,3.8年後の無再発生存期間および生存期間には4群間の差が認められなかった(Intergroupプロトコール‒0089試験)。毒性,コスト,患者の利便性の観点から,5-FU+l-LVの6~8カ月投与が好ましいと結論された。また,NCCTGとNCICは2×2要因デザインで5-FU+LEVもしくは5-FU+l-LV+LEVの6カ月と12カ月投与を比較し,いずれのレジメンおよび投与期間も無再発率,全生存率に有意な影響を及ぼさないことが示された(NCCTG 89‒46‒51)。一方,Mayo法の24週投与と5-FU持続静注(300mg/m2)の12週投与を比較した試験では,無再発生存期間と生存期間に有意差はなく,持続静注は下痢や好中球減少などの有害事象が少なかったと報告されている。以上から,5-FU+l-LVの6カ月投与(週1回投与)は,5-FU+LEVや5-FU+l-LVの1年間投与と同等の有効性と考えられ,副作用,コストの観点から6カ月間の治療期間が推奨される。
一方,UFT+LV,capecitabine(Cape)は,5-FU+l-LV との同等性を検討したNSABP C‒06とX‒ACT試験では静注法と同じく6カ月投与が採用されていた。StageⅡB/Ⅲ(TNM‒6版)結腸癌を対象とした術後補助化学療法における,UFT+LVの投与期間は本邦のRCTにて比較され,18カ月投与の6カ月投与に対する優越性は証明されなかった(JFMC33‒0502試験)。また,StageⅢ結腸癌に対するCapeの投与期間も本邦のRCTにて比較され副次的評価項目の無再発生存期間,全生存期間では12カ月群が良好であったが,主要評価項目の無病生存率について12カ月投与の6カ月投与に対する優越性は証明されなかった(JFMC37‒0801試験)。以上より,UFT+LV,Capeについても術後補助化学療法の治療期間は6カ月が推奨される。
また,StageⅡ/Ⅲ直腸癌に対する術後補助化学療法において,S-1(12カ月投与)のUFT単独(12カ月投与)に対する優越性が示されている(ACTS‒RC試験)。本試験は,本邦で実施されたNSAS‒CC試験において直腸癌でUFT12カ月投与の有効性が示唆されたことから,両群ともに12カ月投与がプロトコール治療として採用されている。よって,S-1については治療期間6カ月が推奨されるものの,直腸癌に対するS-1療法を選択する場合には12カ月の治療期間も許容される。
Oxaliplatin(OX)併用療法の術後補助化学療法では,5-FU+LVに対する優越性を検証したMOSAIC試験,NSABP C‒07試験,XELOXA試験などで標準治療群および試験治療群ともに6カ月投与で比較され,OX併用療法6カ月の有用性が示されている。さらにStageⅢ結腸癌を対象として術後補助化学療法における,OX併用療法(FOLFOX,CAPOX)の投与期間が国内のRCT(JFMC47‒1202:ACHIEVE試験)を含む6つのRCT(TOSCA試験,SCOT試験,IDEA France試験,C80702試験,HORG試験,ACHIEVE試験)の統合解析にて比較された。3カ月投与の6カ月投与に対する非劣性は統計学的には証明されなかった(3年無病生存率 74.6% vs. 75.5%,ハザード比 1.07,95% 信頼区間 1.00‒1.15)(IDEA collaboration)。一方,有害事象発生割合は3カ月投与群で低く,特にGrade2以上の感覚性末梢神経障害の発現頻度も大幅に低いことが示された(6カ月群FOLFOX/CAPOX 48%/45%,3カ月群FOLFOX/CAPOX 17%/14%)。また,治療効果と治療レジメン(FOLFOX群とCAPOX群)との間に交互作用が認められ,FOLFOX群では6カ月投与群の3カ月群に対する優越性が示される一方で,CAPOX群では3カ月群の6カ月群に対する非劣性が示された。また,再発リスク別のサブグループ解析でも,再発低リスク症例(T1‒3かつN1)ではCAPOX 3カ月投与群の非劣性が確認された。また,本邦で実施されたACHIEVE試験は,CAPOX群が75%と多数を占めるものの,3カ月投与と6カ月投与の3年無病生存は同程度であり(6カ月77.9%,3カ月79.5%),IDEA試験と同様の傾向が確認された。また,感覚性末梢神経障害の発現も3カ月投与で有意に少なかった。
以上より,OX併用療法でも6カ月間の術後化学療法が推奨されるが,特に再発低リスク例においてはCAPOX 3カ月間投与も治療選択肢となり得ると考えられる。
CQ 17:70 歳以上の高齢者に術後補助化学療法は推奨されるか?
欧米で行われた5-FUベース術後補助化学療法のランダム化比較試験のpooled analysisやレジストリデータに基づく解析の結果から,70歳以上の患者においても,70歳未満の患者と同程度の再発抑制効果と生存期間延長が示されている。米国において,SEER等のがん登録や大規模コホート研究を併合した5,489名のリアルワールドデータの解析から,75歳以上の患者における5-FUベース術後補助化学療法の生存期間延長も報告された。有害事象については,高齢者では好中球減少が強く出る傾向にあるが,他はほぼ同程度である。よって,PSが良好で主要臓器機能が保たれており,化学療法に対してリスクとなるような基礎疾患や併存症がなければ,70歳以上の高齢者にも,術後補助化学療法を行うことを強く推奨する。
一方,フッ化ピリミジン単独療法にoxaliplatin(OX)を併用するベネフィットは,70歳以上に対しては,70歳未満に比べると小さくなる可能性がある。フッ化ピリミジン単独療法とOX併用療法を比較した3つの第Ⅲ相試験であるMOSAIC,NSABP‒C07,XELOXAを統合したデータにおいて,70歳以上(1,119名)に限った解析を行うと,5-FUベース術後補助化学療法にOXを併用する効果は観察されなかった(無病生存期間のハザード比 0.94,全生存期間のハザード比 1.04)。一方,X‒ACT(5-FU+l-LV群),XELOXA(5-FU+l-LV群,CAPOX群),NSABP C‒08(FOLFOX群),AVANT(FOLFOX群)の各試験から該当する群を併合したデータの解析では,OX併用の再発抑制効果は70歳未満に比べて小さくなるものの,70歳以上(345名)でも観察された(無病生存期間のハザード比70歳未満0.68,70歳以上0.77)。以上,70歳以上に対するOX併用療法は,一貫した結果が得られていないことを考慮すると,70歳未満の患者でのリスクベネフィットバランスと異なると考えられ,その適用は慎重に判断する必要がある。
CQ 18:StageⅡ大腸癌に術後補助化学療法は推奨されるか?
再発高リスクの場合には補助化学療法を行うことを弱く推奨する。(推奨度2・エビデンスレベルB)
3,238名の結腸・直腸癌(StageⅡ:91%,結腸癌:71%)を対象とした5-FU+LV±levamisoleと手術単独を比較したQUASAR試験では,化学療法群の再発率および生存率は有意に良好で,5年生存率で3~4%の上乗せ効果がみられたが,StageⅡの2,146名のみでは有意差は認められなかった。国内のランダム化比較試験においても,StageⅡ結腸癌に対する1年間のUFT投与は,手術単独に対し5年生存率はそれぞれ94.5%,94.3%(ハザード比 0.93;95% 信頼区間 0.66‒1.31)と有意な再発抑制効果は証明されなかった(SACURA試験)。メタアナリシスやSEER database reviewでも,化学療法群の生存期間が良好な傾向があるものの有意差は示されていない。また,フッ化ピリミジンベース治療と比較してoxaliplatinベース治療の優位性を検証したMOSAIC試験及びNSABP C‒07試験では,それぞれ40%,29%のStageⅡの患者が含まれたが,StageⅡ結腸癌のサブグループ解析において再発,生存ともに上乗せ効果は証明されていない。以上より,StageⅡ大腸癌では,再発リスクを考慮せず一律に術後補助化学療法を行うことは推奨されない。
海外のガイドラインでは,StageⅡ結腸癌のなかに再発高リスク群を設定し,期待される効果と予想される副作用を十分説明したうえで術後補助化学療法を行うことが推奨されている(表1)。現在StageⅡ結腸癌の再発高リスク因子は,臨床病理学的因子で定義されているが,高レベルのエビデンスに基づくものではない。
エビデンスは不足するものの,これら予後不良なサブグループに絞って補助化学療法を行うという戦略は妥当と考えられる。R0手術が行われた再発危険因子を持つstageⅡ大腸癌における手術単独群に対するUFT/LV療法の臨床的有用性を比較検討するJFMC46‒1201試験が国内で施行され,登録症例の殆どが非ランダム化群ではあるがその論文化が待たれる。現時点では再発高リスク群において患者とエビデンスを共有して,患者の価値観を踏まえて一緒に治療方針を決定することが推奨される。なお,臨床病理学的因子を元に個々の再発リスクを予測するいくつかのWebツールが利用可能であるが,患者と治療の検討するため,大腸癌研究会のホームページにも日本人データを用いた結腸癌術後予後予測ノモグラムが用意されている(http://nomogram.jsccr.jp/nomograms)。再発高リスクとは逆にミスマッチ修復(MMR)機能欠損を有するStageⅡ結腸癌は,頻度は低いものの(5%から8%程度)極めて予後は良好である。国内外の臨床試験結果からフッ化ピリミジン単独療法は再発リスクが高まる可能性があり行わないことが推奨されるため,治療前のMMRもしくはMSI検査(保険収載)が必要である。さらに,再発リスクを推定する方法として遺伝子発現プロファイルや,CDX2などの病理学的診断の有用性が報告されているが,中でもctDNAは非常に高感度にmolecular residual disease(MRD)を検出し再発を予測することが可能で現在最も期待されている検査方法である(いずれも本邦未承認)。
再発高リスクStageⅡ大腸癌に対する治療レジメンと治療期間については,議論が続いている。原則的にはStageⅢ結腸癌に準じた治療法と投与期間が妥当と考えられる。フッ化ピリミジンベース治療であれば6カ月である。oxaliplatinベース治療の投与期間についてはCQ16にあるように,IDEA collaborationの結果からStageⅢ結腸癌T1~3かつN1症例においてはCAPOX 3カ月も推奨されている。一方,再発高リスクStageⅡ大腸癌の至適投与期間の検討をしたIDEA collaborationの統合解析の結果は,6カ月投与に対する3カ月投与の非劣性は示されなかったが,StageⅢ同様,CAPOXであれば3カ月と6カ月投与の有効性は臨床的に同程度であった。CAPOXの3カ月投与は末梢神経障害をはじめ毒性が抑えられることから再発高リスクStageⅡ大腸癌においても治療選択肢の一つである。統合解析に含まれる本邦の試験においてもoxaliplatinベースの補助化学療法の治療期間の短縮はgrade2以上の末梢神経障害を有意に減少させ,有効性も3年DFSは3カ月投与と6カ月投与は同等で3カ月投与が選択肢として肯定される結果であった。T4における3カ月投与は6カ月投与に比較しやや治療成績が不良な傾向が見られるが,治療選択にあたっては長期投与の毒性とのバランスを考慮することが望まれる。

CQ 19:肝転移以外の遠隔転移巣切除後の補助化学療法は推奨されるか?
切除可能な肺転移や腹膜播種に対する最も効果が高い治療法は外科切除である。しかし,遠隔転移巣切除後の再発率は50~70%と高いことから,治療成績の向上のために術後化学療法の実施が検討されてきた。
肝転移の術後補助化学療法に関してはCQ 9のようにこれまでいくつかのランダム化比較試験が行われ一定のエビデンスが積み重ねられてきた445,453)。肝転移以外の遠隔転移に関しての臨床試験は少なく,腹膜播種切除後の全身化学療法やHIPECの有用性を検討したランダム化比較試験が行われてきたが明確な有用性を示した報告はない。肺転移切除例や腹膜転移切除例の後方視的検討において,補助化学療法の実施が予後良好因子であったとの報告がある一方,予後の改善がないなど様々な結果が報告されている。現時点では,転移臓器によって薬物療法の有効性が異なるという明確なエビデンスがないため,肝転移で示された補助化学療法の再発抑制効果を参考に,肝以外の肺転移,腹膜転移の術後補助化学療法の実施についても考慮する。
遠隔転移切除後の補助化学療法の最適な治療レジメンおよび治療期間は現時点では確立していない。肝転移再発抑制効果を示したランダム化比較試験は,フッ化ピリミジン単独療法(5-FU+l-LV療法,UFT+LV療法)を用いた試験であったが,StageⅢ術後の補助化学療法の推奨レジメンであるoxaliplatin併用療法を,StageⅢよりも再発リスクが明らかに高い遠隔転移切除例に適用することも実地臨床では選択肢の一つと考えられる。ただし,転移巣手術では手術侵襲が原発巣手術よりも大きく,患者の回復が遅いことが多いことを考慮する必要がある。治療期間に関してStageⅢの低リスクでは補助化学療法の3カ月投与への期間短縮も推奨されているが,明らかに再発率の高い遠隔転移術後は6カ月投与が原則と考えられる。
CQ 20:切除不能大腸癌に対する一次・二次治療として分子標的治療薬の併用は推奨されるか?
二次治療としては,
①血管新生阻害薬を併用することを強く推奨する。(推奨度1・エビデンスレベルA)
②抗EGFR抗体薬を併用することを弱く推奨する。(推奨度2・エビデンスレベルA)
切除不能進行再発大腸癌に対する一次治療における分子標的治療薬併用の有用性は,bevacizumab(BEV),抗EGFR抗体薬であるcetuximab(CET)およびpanitumumab(PANI)においてのみ示されている。また,近年報告されたマイクロサテライト不安定性陽性の大腸癌においてはpembrolizumab(Pembro)単独療法の有用性が証明され承認されている(CQ 22 参照)。
一方,ramucirumab(RAM),aflibercept beta(AFL),regorafenib(REG),binimetinib(BINI)は,一次治療における有用性は検証されておらず,併用は推奨されない。
FOLFOX/CAPOXおよびcapecitabine療法に対してBEV併用療法はプライマリーエンドポイントである無増悪生存期間における上乗せ効果を示した。また,国内で実施されたSOFT試験,WJOG4407G試験,TRICOLORE試験で,SOX,FOLFOX,FOLFIRI,S-1+IRIとBEVの併用療法は,同程度の良好な治療成績を示し,毒性も忍容可能であったことが示された。FOLFOXIRIに対しては,TRIBE試験を含む2つのRCTの統合解析から,FOLFOXIRI療法に対してBEV併用の無増悪生存期間,全生存期間への上乗せ効果が示されている。
RAS野生型において,FOLFIRI/FOLFOXと抗EGFR抗体薬の併用療法はプライマリーエンドポイントである無増悪生存期間およびセカンダリーエンドポイントである全生存期間,奏効割合での上乗せ効果を示した。しかしながら,経口フッ化ピリミジン薬+OXもしくはIRIと抗EGFR抗体薬との併用療法は,その有用性は確認されていないことに注意が必要である。経口フッ化ピリミジン薬+抗EGFR抗体薬との併用療法は,第Ⅱ相試験で有効性と安全性が報告されており,強力な治療が適応とならない患者での一次治療としては選択肢となり得る。
RAS野生型に対する,6つのRCT(FIRE‒3試験,CALGB/SWOG80405試験,PEAK試験,CRYSTAL試験,PRIME試験,20050181試験)の統合解析にて,原発巣占居部位(右側[盲腸,上行結腸,横行結腸]または左側[下行結腸,S状結腸,直腸])と分子標的治療薬(BEVまたは抗EGFR抗体薬)の治療効果との相関が報告され,RAS/BRAF野生型大腸癌には,原発巣占居部位が左側ではより抗EGFR抗体薬が,右側ではよりBEV併用が推奨される。ただし,分子標的治療薬の副作用プロファイルなどを考慮した選択も可能である。なお,RAS変異またはBRAFV600E変異大腸癌には原発巣占居部位によらずBEV併用が推奨される。
以上より,切除不能進行再発大腸癌に対する一次治療において,使用禁忌がない限り,BEV,抗EGFR抗体薬,そしてMSI‒HにおけるPembroのいずれかを併用することが推奨される。RAS/BRAF野生型では,副作用プロファイル,併用レジメン,患者の嗜好,原発巣占居部位などを考慮してBEV,抗EGR抗体薬いずれかを選択する。一次治療レジメン選択前にRASおよびBRAFV600E遺伝子検査,MSI検査を実施することが望ましい。
一次治療に分子標的治療薬が併用されていない場合の二次治療に関しては,BEV(FOLFOX±BEV(ECOG3200試験)),AFL(FOLFIRI±AFL(VELOUR試験))は第Ⅲ相試験により,有意な生存期間の延長が示されている。抗EGFR抗体薬(CET,PANI)併用療法は,大多数が一次治療に分子標的薬が投与されていない二次治療としての第Ⅲ相試験(EPIC試験,181試験)の結果,無増悪生存期間の延長,奏効割合の増加,QOL向上に寄与することが示されたが,全生存期間は,IRIベースの化学療法単独群に対して有意な改善は確認されなかった。以上より,二次治療として抗EGFR抗体薬は提案される治療であるが(腫瘍縮小効果を期待したい状況や病勢により三次治療までの継続が困難であることが予想される症例,など),血管新生阻害薬(BEV/RAM/AFL)併用が可能な場合には二次治療としてBEV/RAM/AFL併用療法を行い,三次治療として抗EGFR抗体薬の投与を行うことが望ましい。
BEVを含む一次治療が施行された場合の二次治療における分子標的治療薬の併用に関しては,化学療法+BEVの継続投与(bevacizumab beyond progression:BBP)(ML18147試験),FOLFIRI+RAM併用療法(RAISE試験)FOLFIRI+AFL併用療法(VELOUR試験)はそれぞれ第Ⅲ相試験により,プライマリーエンドポイントである全生存期間を有意に延長した。一方,RAS野生型を対象にBEVを含む一次治療後の二次治療として抗EGFR抗体の併用効果を検証した第Ⅲ相試験は報告されていない。BEV併用療法後の二次治療として抗EGFR抗体薬併用療法とBEV併用療法を比較するランダム化第Ⅱ相試験(SPIRITT試験,WJOG6210G試験,PRODIGE18試験)では,奏効割合はいずれも抗EGFR抗体薬併用群が良好であったが,全生存期間,無増悪生存期間はいずれも有意差を認めなかった。以上より,一次治療でBEVを投与した場合の二次治療におけるBEV/RAM/AFL療法は,いずれも全生存期間の延長を示しており,推奨される。抗EGFR抗体薬は,一次治療でBEVを投与した後の二次治療において腫瘍縮小効果を期待したい状況(治癒切除の可能性や症状緩和など)や病勢により三次治療までの継続が困難であることが予想される症例に対しては考慮される。また,BEV/RAM/AFLの選択は副作用プロファイル,医療コストなどを含めリスクベネフィットを考慮し,化学療法単独の選択肢も含めて治療法を選択することが望ましい。血管新生阻害薬の使い分けに関しては,各臨床試験におけるsubset解析やバイオマーカー解析からいくつか検討に値する因子は公表されているが,まだ確立されたものはない。
一次治療に抗EGFR抗体薬が投与された場合の二次治療に関しては,併用する分子標的治療薬を評価する第Ⅲ相臨床試験は実施されておらずエビデンスは乏しい。しかしながら,BEV使用例が含まれていないという観点からはECOG3200試験やVELOUR試験で認められた血管新生阻害薬の併用効果が抗EGFR抗体薬後の二次治療としても期待できると考えられる。また,有効な治療薬を使い切るという観点からも,抗EGFR抗体薬後の二次治療としても血管新生阻害薬の併用療法は推奨される治療と考える。一方,抗EGFR抗体薬の増悪後の継続使用(beyond progression)は,その有効性に関するエビデンスが不十分で確立されておらず,副作用の観点から現時点では推奨されない。
CQ 21:切除不能大腸癌に対する後方治療は推奨されるか?
・Regorafenib療法(推奨度1・エビデンスレベルA)
・FTD/TPI療法(推奨度1・エデビデンスレベルA)
・FTD/TPI+BEV療法(推奨度2・エビデンスレベルB)
切除不能大腸癌では,フッ化ピリミジン,oxaliplatin,irinotecan,血管新生阻害薬,抗EGFR抗体薬(RAS野生型の場合)に不応または不耐(投与不適を含む)となった際の後方治療として,regorafenib療法(REG)およびtrifluridine(FTD)/tipiracil塩酸塩(TPI)単独療法(TAS‒102,以下FTD/TPI)の有用性が,日本人患者も含まれたプラセボ対照国際共同第Ⅲ相試験CORRECT試験およびRECOURSE試験により,検証されている(CORRECT試験:全生存期間中央値 6.4 vs. 5.0カ月,ハザード比 0.77,95% 信頼区間 0.64‒0.94,p=0.0052;RECOURSE試験:全生存期間中央値 7.1 vs. 5.3カ月,ハザード比 0.68,95% 信頼区間 0.58‒0.81,p<0.001)。
有害事象として,REGでは手足皮膚反応,疲労,下痢,高血圧等の非血液毒性が,FTD/TPIでは白血球・好中球減少症などの血液毒性の頻度が高く,有害事象のプロファイルが異なる。以上より,REGおよびFTD/TPIはいずれも生存期間の延長が確認されており,副作用に留意が必要であるが,推奨される治療である。なお,PS2以上の患者に対してはREGおよびFTD/TPIのいずれも有効性・安全性は確立されておらず,治療適応外とし対症療法を選択するのが望ましい。また,安全性を高めるため,REGについては,160mg/日の標準用量で治療を開始せず,80mgあるいは120mgから開始し副作用が軽度であれば増量していくストラテジーが試みられており,有効性を損なわずに安全に投与できる可能性が示唆されている。
REGおよびFTD/TPIのどちらが先に実施するのが良いかは,両治療を直接比較したRCTがないため,現時点では明らかではない。大腸癌研究会が行った後方視的研究における650名の傾向スコア解析では,生存期間のハザード比は0.96(95% 信頼区間 0.78‒1.18,p=0.69)であり,両薬剤の有効性は同程度と考えられることから,リスクとベネフィットを考慮したうえで選択することが望ましい。
また,FTD/TPIとBEVの併用療法は,本邦で実施された第Ⅰ/Ⅱ相試験にて良好な有効性が示唆され,欧州で実施されたFTD/TPI療法とのランダム化比較第Ⅱ相試験では,主要評価項目である無増悪生存期間の有意な延長が示された(中央値 4.6 vs. 2.6カ月,ハザード比 0.45,95% 信頼区間 0.29‒0.72,p=0.0015)。一方で,有害事象としてGrade3以上の重篤な好中球減少の増加も報告されていることに留意が必要である(67% vs. 38%)。以上より,後方治療としてのFTD/TPIとBEVの併用療法は,好中球減少を含む有害事象に留意が必要であるものの,FTD/TPI療法と比較して有効性が高い可能性が示唆されている。第Ⅲ相試験での検証が必要ではあるものの,治療選択肢の限られた後方ラインにおいて,現時点までのエビデンスでも治療選択肢として考慮されることに一定のコンセンサスが得られたことから,弱い推奨として掲載した。
抗EGFR 抗体薬に不応のRAS野生型に対し,一定期間抗EGFR 抗体薬を含まない治療を行った後に再度抗EGFR 抗体薬を投与するリチャレンジ療法の開発が行われている。一次治療としてFOLFIRI+抗EGFR 抗体薬併用療法を行い奏効が認められた患者を対象に,二次治療としてBEV併用療法を施行後,三次治療としてCET+IRI療法を行う第Ⅱ相試験(CRICKET試験)では奏効割合21%,病勢制御割合54%と報告されている。また,奏効が認められた患者では,治療前の血液循環腫瘍DNA(circulating tumor DNA;ctDNA)検査にてRAS変異が認められなかったことが報告されている。本邦でも,ctDNAからRAS遺伝子変異を検出するOncoBEAMTM RAS CRCキットが2020年8月に保険償還されている。しかしながら,ctDNA検査でRAS遺伝子型を確認することの臨床的意義やその結果に基づく抗EGFR 抗体薬のリチャレンジ療法は,現時点ではランダム化比較試験により有用性を示したエビデンスはなく,後方治療としての推奨について現時点では明確とは言えず今後の検討課題と考えられる。
CQ 22:切除不能大腸癌に対する免疫チェックポイント阻害薬は推奨されるか?
DNAミスマッチ修復(mismatch repair:MMR)機能に欠損がある腫瘍は(deficient MMR:dMMR),高頻度マイクロサテライト不安定性(microsatellite instability‒high:MSI‒H)を示し,細胞内に体細胞変異の蓄積を来し(hypermutation),ネオアンチゲン数も多くなることから,免疫原性が高くなり免疫チェックポイント阻害薬の効果が期待される。一方,切除不能のdMMR/MSI‒H切除不能大腸癌は予後不良な傾向があり,フッ化ピリミジンを含む治療の有効性が乏しいことが報告されている。本邦大腸癌におけるMSI‒Hの頻度は約4%と報告されている。
KEYNOTE‒177試験はMSI‒H/dMMRの切除不能大腸癌初回治療例を対象に抗PD‒1 抗体薬のpembrolizumab(Pembro)と標準治療(mFOLFOX6/FOLFIRI±BEV/CET)を比較した臨床第Ⅲ相試験であり,主要評価項目の一つであるPFSはPembro群で有意に延長した(Pembro vs. 標準治療;PFS 中央値 16.5カ月 vs. 8.2カ月;ハザード比 0.60;95% 信頼区間 0.45‒0.80;p=0.0002)。安全性に関してはGrade3以上の有害事象がPembro群で56%,標準治療群で78%とPembro群で低い傾向にあり,免疫関連有害事象はPembro群で多い傾向であった(31% vs. 13%)。以上の結果に基づき,2021年8月にMSI‒Hの切除不能大腸癌初回治療例に対してPembroの適応が拡大された。以上から,MSI‒H切除不能大腸癌の初回治療としてPembro療法が強く推奨され,治療開始前にMSI検査を実施してMSI statusを明らかにしておくことが望ましい。2021 ASCO Annual Meetingにおいてもう一つの主要評価項目であるOSの結果が報告され,ハザード比 0.74;95% 信頼区間 0.53‒1.03;p=0.0359 とPembro群で良好な傾向を認めたが,統計学的設定を達成することはできなかった(p<0.0246)。その理由として,標準治療群の後治療として試験で設定されたクロスオーバー(36%)を含む60%の症例が後治療としてPD‒1またはPD‒L1抗体薬を含む治療を受けていたこと,また最終解析時点におけるイベント数が計画より不足(190イベントに対して140イベント)していたことが考えられた。
MSI‒HまたはdMMRの切除不能大腸癌既治療例を対象とした第Ⅱ相試験としてPembro,抗PD‒1 抗体薬のnivolumab(Nivo),抗CTLA‒4 抗体薬のipilimumab(Ipi)とNivoの併用療法について報告されている。PembroについてはKEYNOTE‒164試験で,奏効割合33%であった。また,1年,2年無増悪生存(PFS)率はコホートA(2レジメン以上の治療歴あり)で各々34%,31%,コホートB(1レジメン以上の治療歴あり)で41%,37%と長期の病勢コントロールが得られる症例を認めた。Nivoは,CheckMate‒142試験において,奏効割合36%,1年,2年PFS率44%とPembroと同程度の有効性を示した。また,CheckMate‒142試験の既治療例に対するIpiとNivoの併用療法コホートにおいて,奏効割合55%,1年PFS率71%と良好な成績を示した。CheckMate‒142試験は比較試験ではないものの,グレード3以上の有害事象の頻度はNivoで20%,Ipi+Nivoで32%,なかでもAST上昇が各々0%,8%,ALT上昇が各々1%,7%と肝機能障害の頻度が高い傾向であった。以上の結果から,もし一次治療で抗PD‒1 抗体薬療法が使用されなかった場合,二次治療以降で抗PD‒1 抗体薬療法,もしくは抗PD‒1 抗体薬+ 抗CTLA‒4 抗体薬併用療法を実施することを推奨する。
一方,pMMR(MMR proficient)またはNon‒MSI‒H大腸癌に対しては,抗PD‒1 抗体薬単剤療法は無効であり,推奨されない。現在,免疫チェックポイント阻害薬併用療法の臨床試験が行われているが,現時点ではその有用性は明らかではなく臨床試験以外では使用されるべきではない。
免疫チェックポイント阻害薬の使用の際には,免疫関連の有害事象が一定の頻度で認められ,さらに抗CTLA‒4 抗体薬併用療法では,他癌腫における報告と同様,抗PD‒1 抗体薬単剤療法と比較して,その頻度が高くなることから,使用にあたっては注意深いモニタリングと発現時の適切な対応が必要である(がん免疫療法ガイドライン第2版,適正使用ガイド等を参照のこと)。
近年,腫瘍遺伝子変異量が高い(tumor mutation burden‒high:TMB‒H)固形癌に対する免疫チェックポイント阻害薬の有効性が報告され,米国FDAは2020年6月に大腸癌を含むTMB‒H(>10mut/Mb)固形癌既治療例に対してPembroを承認した。またコンパニオン診断薬としてFoundationOneCDxアッセイも承認された。本邦でも,2021年3月にPembroのTMB‒H固形癌機治療例への適応拡大申請がされている。
CQ 23:BRAFV600E変異切除不能大腸癌に対するBRAF 阻害薬は推奨されるか?
BRAFV600E変異を有する切除不能大腸癌は極めて予後が不良であり,薬物療法の効果が乏しいことが知られている。
BEACON CRC試験は,BRAFV600E変異切除不能大腸癌を対象に,BRAF阻害薬のencorafenib(ENCO)とcetuximab(CET),MEK阻害薬のbinimetinib(BINI)の3剤併用療法,およびENCOとCETの2剤併用療法の有効性を,irinotecan(IRI)+CETまたはFOLFIRI+CETを対照群に検証した臨床第Ⅲ相試験である。主要評価項目である対照群と3剤併用療法群のOSは各々5.4カ月,9.0カ月(ハザード比 0.52;95% 信頼区間 0.39‒0.70;p<0.001),ORRは各々2%,26%(p<0.001)と3剤併用療法群で有意に良好であった。また,2剤併用療法群も対照群と比較し,OS中央値は8.4カ月(ハザード比 0.60;95% 信頼区間 0.45‒0.79;p<0.001),ORRは20%(p<0.001)と有意に良好であった。安全性は,3剤併用療法群,2剤併用療法群,対照群におけるグレード3以上の有害事象発生頻度は各々58%,50%,61%,有害事象による治療中止割合は7%,8%,11%であった。
以上より,化学療法歴のあるBRAFV600E変異切除不能大腸癌に対して,ENCO+CETまたはENCO+BINI+CET療法は推奨される。前述のBRAFV600E変異切除不能大腸癌の特性を考慮すれば,二次治療以降の治療として有効性が期待できる本治療を,後方治療に取っておくのではなく,二次治療として実施することが適切であると考えられる。
なお,BEACON CRC試験の探索的解析において,3剤併用療法は2剤併用療法と比較して,死亡リスクの低下効果に差を認めなかったことから,まずは2剤併用療法の適否を検討すべきである。しかしながら,3剤併用療法でORRおよび奏効の深さ(標的病変の腫瘍径和の縮小率)が2剤併用療法よりも良好な傾向を示し,2剤併用療法と3剤併用療法のサブグループ解析では,ECOG Performance Statusが1,転移臓器3個以上,血清CRP高値(>1mg/dL),原発巣切除歴なし,のグループでは2剤併用療法よりも3剤併用療法の死亡リスクが低い傾向にあった。つまり,これら比較的腫瘍量が多いと考えられる患者集団では,2剤併用療法では治療効果が不十分である可能性が示唆される。安全性は,3剤併用療法は2剤併用療法と比較して下痢,嘔吐,皮疹などの有害事象の発生頻度が高いことに留意が必要である。一方,2剤併用療法は頭痛,関節痛,色素性母斑,続発性悪性腫瘍などの発生頻度が高い傾向があることから,一概に3剤併用療法と比較して2剤併用療法の安全性が高いという訳ではない。
以上より,実地診療では,3剤併用療法および2剤併用療法で有効性が期待できる集団と安全性プロファイルが異なる点,ならびに治療コストなどを総合的に考慮してレジメンを選択し,週1回のCET投与のための来院の際に注意深く患者を観察するとともに,適正使用ガイドなどを参考に適切に減量,休薬しながら治療を進めることが推奨される。なお,安全性に懸念がないと考えられる場合は,利便性の観点から,CET投与は隔週投与法(500mg/m2)とすることも可能である。
CQ 24:切除不能大腸癌に対する包括的がんゲノムプロファイリング検査は推奨されるか?
包括的ゲノムプロファイリング検査(以下,CGP検査)は,2018年12月に腫瘍組織を用いた「OncoGuideTM NCCオンコパネルシステム」,「FoundationOne® CDxがんゲノムプロファイル」が薬事承認され,2019年7月より保険適用となった。包括的がんゲノムプロファイリング検査(CGP検査)の目的は,多数の遺伝子を網羅的に解析するゲノムプロファイルから治療方針策定の補助となる遺伝子異常の情報を得て,最適ながん薬物療法を提供することである。大腸癌では,CGP検査を実施することでNTRK,ALK,ROS1などの融合遺伝子異常やTMB‒H,ERBB2増幅など標的治療の対象となる遺伝子異常が同定されることがある。このうちNTRK融合遺伝子陽性例にはentrectinib/larotrectinib療法が既に保険診療として実施可能である。またTMB‒Hに対するpembrolizumab療法,ERBB2増幅(HER2陽性)例に対するtrastuzumab+pertuzumab療法は単群前向き試験で有効性が示されており,本邦でも承認申請中である。他にもERBB2増幅例に対するHER2標的療法,ALKやROS1などの融合遺伝子陽性例に対する阻害薬など治験や患者申出制度の活用などにより治療を提供できる可能性がある。ただし,各遺伝子異常の頻度は低く,これらに対する治療薬と標準治療の有用性を直接比較したデータはない。また,検査実施施設・治験実施施設も限定されている(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/gan/gan_byoin.html)。なお,2021年3月には血漿検体を用いたCGP検査として新たにFoundationOne® Liquid CDxが薬事承認された。組織CGPと比較して,①検体採取が容易,②採取時点における腫瘍遺伝子異常情報が取得可能,③結果判明までの時間が短い,などの利点がある一方で,①腫瘍量が十分でない場合など偽陰性が高くなる可能性,②加齢に伴うクローン性造血(clonal hematopoiesis of indeterminate potential;CHIP)により偽陽性が高くなる可能性,③遺伝子増幅や融合など検出されにくい遺伝子異常がある,などの課題も指摘されている。血漿CGPと組織CGPの最適な使い分けについては今後の課題である。
CGP検査の留意事項には「標準治療がない固形がん患者又は局所進行若しくは転移が認められ標準治療が終了となった固形がん患者(終了が見込まれる者を含む。)であって,関連学会の化学療法に関するガイドライン等に基づき,全身状態及び臓器機能等から,本検査施行後に化学療法の適応となる可能性が高いと主治医が判断した者に対して実施する場合に限り算定できる。」と記載されている(保医発0531 第1号 令和元年5月31日)。切除不能大腸癌では,一次治療を開始後,約15%の患者で治癒切除が可能となる(conversion)一方,大部分の患者では一次治療途中から延命目的の緩和的薬物療法となり,いずれかのタイミングで標準治療が終了することが見込まれる。一方で,後方治療として推奨されるREGおよびFTD/TPIは,無増悪生存期間中央値2カ月程度と報告されており,これらによる後方治療中もしくは終了した時点で本検査を実施した場合,結果返却までに,患者の全身状態が悪化し,CGP検査で有望な治療が提案されたとしても実際に治療を受ける機会を逸する可能性が懸念される。また,entrectinib/larotrectinib療法,およびTMB‒H大腸癌に対するpembrolizumab療法は,1レジメン以上の治療歴を有する固形癌患者に対し臓器横断的な有効性が認められており,二次治療以降での有用性が示されている。また,「全身状態及び臓器機能等から本検査施行後に化学療法の適応となる可能性が高い」との記載があることから,すでにECOG PSが不良,重度の肝機能障害,腎機能障害などで回復の見込みがない場合には,CGP検査の適応はないと考えられる。また,CGP検査の有益性を最大限高めるためには,検査結果返却までに通常4週間以上を要することを考慮して検査のタイミングを判断する必要がある。
以上より,切除不能進行再発大腸癌の患者に対し,一次治療開始後から後方治療移行時までの適切な時期に,CGP検査を実施することが望ましい。検査のタイミングは,腫瘍量,腫瘍進行速度や治療抵抗性には個体差が大きいことを十分考慮し,患者の病態に応じた適切なタイミングで本検査を実施する。さらに,実地臨床において本検査を患者に提案する際には,実際に検査を受けた患者のうち治験に参加できる患者の割合は全がん種で8.1%と報告されていること(https://www.ncc.go.jp/jp/c_cat/index_kan_jya.html),実際の患者さんの治験実施施設への通院などの負担にも配慮する必要がある。
なお,検査の詳細や注意点については,次世代シークエンサー等を用いた遺伝子パネル検査に基づくがん診療ガイダンス(日本臨床腫瘍学会/日本癌治療学会/日本癌学会),大腸がん遺伝子関連検査等のガイダンス(日本臨床腫瘍学会),ゲノム診療用病理組織検体取り扱い規程(日本病理学会/https://pathology.or.jp/genome_med/),血中循環腫瘍DNAを用いたがんゲノムプロファイリング検査の適正使用に関する政策提言(日本臨床腫瘍学会/日本癌治療学会/日本癌学会)等も参照のこと。
CQ 25:R0 切除可能な直腸癌に対して術前治療は推奨されるか?
直腸癌に対して側方郭清が行われない欧米で行われた臨床試験では,術前化学放射線療法による生存率の向上は認めなかったが,局所再発率の低下が示されている。一方,術前放射線療法には腸管障害,排便機能障害,性機能障害,2次癌発生などの有害事象があることは周知の事実である。
本邦の大腸癌専門施設においては,下部直腸進行癌に対してはTME(あるいはTSME)+側方郭清が標準的に行われており,生存率,局所再発率ともに良好な成績が報告されており,欧米で標準である術前化学放射線療法は積極的には行われていないのが現状である。
側方リンパ節転移がないと診断された症例において術前照射後における側方リンパ節郭清の有無を比較した本邦におけるランダム化比較試験では,両群の無再発率,全生存率に差はなく,側方郭清を施行しない群で有意に排尿障害,性機能障害が少ないことが報告されているが,45例と少数例の検討であることから,この報告の意義は限定的である。
以上より,本邦における術前化学放射線療法の局所再発低減における上乗せ効果,あるいは側方郭清の代替としての有効性については,現時点で明らかなエビデンスはなく,適切に計画された臨床試験での評価が必要である。
現在,oxaliplatin,irinotecanや分子標的薬を併用した術前化学放射線療法の治療開発が行われており,本邦からも第Ⅱ相試験の良好な成績が報告されているが,生存率向上に寄与するかは今後の検討を待つ必要がある。
強度変調放射線治療(intensity modulated radiotherapy:IMRT)を用いた術前化学放射線療法の第Ⅱ相試験においては,急性期消化器毒性の軽減効果は認められず,現時点では臨床試験として行うことが推奨される。今後,遅発性有害事象軽減も含めたIMRTの有用性についての評価も必要である。
欧米を中心として術前化学放射線療法の著効例に対する直腸温存治療(局所切除や切除を行わない経過観察)の可能性が検証されているが,まだ十分なデータがあるとはいえず,有効性と安全性は確立していない。
放射線照射による有害事象を回避し,遠隔転移の制御による生存率の向上を目指した放射線照射を伴わない術前化学療法は,第Ⅱ相試験において12~25%のpCR割合,90~100%のR0切除率が報告されているが,第Ⅲ相試験や長期成績のデータはなく,有効性は確立していない。
CQ 26:遠隔転移のない切除不能な局所進行再発直腸癌に対する化学放射線療法は推奨されるか?
一方,切除が望めない場合には継続的な腫瘍制御という目的で,全身薬物療法を実施することが妥当と考える。局所病変への照射に関しては症状の有無,期待される効果,予測される有害事象を考慮し実施するのが望ましい。
切除不能局所進行再発直腸癌に対しては,継続的に腫瘍制御を行う目的で,切除不能進行再発大腸癌に対する薬物療法の項を参考に全身薬物療法を実施することが妥当と考える。局所への照射に関しては局所病変による症状の有無,期待される効果,予測される有害事象を考慮し実施を検討することが望ましい。
無症状の遠隔転移のない切除不能な局所進行/局所再発直腸癌に対しては,さまざまな治療法が選択されている。化学放射線療法は積極的な救済治療の選択肢の一つと考えられている。治療による腫瘍縮小効果によりR0切除が可能になる(marginal resectable)と判断される症例に対し,切除を指向した化学放射線療法を行うことを弱く推奨する。本対象に対し,放射線療法と薬物療法の局所効果について比較したデータは存在しないが,局所進行直腸癌(Ⅱ/Ⅲ期)に対する術前化学療法(mFOLFOX6)は,5-FU/LVまたはmFOLFOX6+46~50Gyの術前化学放射線療法と比べ,病理学的完全奏効割合(pCR割合)が低いとの報告もあり,局所効果については放射線治療が全身薬物療法を上回る可能性を考慮すべきである。
一方,放射線治療に対する薬物療法の上乗せ効果についてはさまざまなレジメンが検討されている。切除不能(T4)直腸癌を対象としたランダム化比較試験では,5-FU/LV+50Gyの化学放射線療法群は,やや毒性が高いものの一般診療レベルで実施可能と判断された。化学放射線療法群は放射線単独療法群に比べて,完全切除率(84% vs. 68%,p=0.009),5年骨盤内制御率(82% vs. 67%,p=0.03),疾患特異生存率(72% vs. 55%,p=0.02)において優れていたが,再発例や膀胱・前立腺浸潤例を含む症例の検討であり,結果の解釈には注意が必要である。近年,5Gy×5回の短期骨盤照射後にFOLFOXを行う治療法や,60Gy程度にまで線量増加をした(化学)放射線療法におけるR0切除率の向上やその有害事象などが検討されている。しかし現時点では,報告も少なく,経過観察期間も短いことから,その有用性に関しては今後のさらなる報告を待ちたい。
有症状症例に対しては,以下のように層別化された緩和治療が行われている。①全身状態が良好であり薬物療法が実施可能な症例に対しては,できるだけ長期間にわたり症状緩和効果を得て患者のQOLを高く保つことを期待して,化学放射線療法が考慮される。②全身状態が不良であり薬物療法が実施困難な症例に対しては,短期間かつ低毒性に,疼痛緩和や止血などの症状が軽減されることを期待して,緩和的放射線単独療法が選択されることが多い。
既に放射線療法が行われた症例の症状緩和には,薬物療法を併用した加速過分割照射が有用であったと報告されている。
近年,三次元原体照射や強度変調放射線治療などが利用できるようになり,有害事象が危惧される小腸などの隣接臓器への線量を低下させながら,病変部への線量を増加することが可能となってきた。また,炭素イオン線,陽子線などの粒子線を用いた治療により卓越した線量分布が可能となり,特に炭素イオン線は高い生物学的効果が期待されている。今後はこれらの新しい放射線療法を用いて,標的体積の設定法,線量増加,併用薬剤等による有効性と安全性の向上について,適正に計画された臨床試験を実施していく必要がある。
CQ 27:閉塞性大腸癌にステント治療は推奨されるか?
原発巣による閉塞症状を伴う切除不能進行再発大腸癌や,切除可能であるが耐術不能な症例に対する姑息的治療としてのステント治療は,人工肛門造設を含む外科手術に比べ,患者の身体的・心理的負担が少ない有益な治療であり,欧州消化器内視鏡学会(ESGE)のガイドラインで推奨されている。姑息的ステント治療と外科手術を比較した海外のメタアナリシスでは,ステント治療群で人工肛門造設率や術後早期の合併症発生率,死亡率が低かった。
ただし,薬物療法や放射線療法を予定している患者では,治療による腫瘍の縮小や組織壊死による穿孔・穿通の可能性があるため,ステント留置の適応は慎重に判断すべきである。特に,ステントを留置した場合,穿孔のリスクが高まるとの報告があるbevacizumabの使用は避ける必要があり(regorafenib,ramucirumab,afliberceptについてもこれに準ずる),このことが患者の予後に与える影響を十分に考慮すべきである。また,放射線療法または薬物療法の既往がある患者でも,ステント留置による穿孔の報告があり,注意が必要である。
根治的外科的切除を前提としたBTSとしてのステント治療では,早急な口側腸管の減圧により緊急手術を回避し,適切な検査・準備を経て待機手術を行うことで,術後合併症を減らすことができる。BTSステント治療と緊急手術を比較した海外のメタアナリシスでは,ステント治療群で人工肛門造設率が低く,一期的吻合率が高く,術後合併症が少ないことが示されている。また,経肛門イレウス管による減圧に比べ,洗浄が不要,経口摂取ができ一時退院が可能,口側大腸の観察が可能などの利点がある。
一方で,ステント留置が長期予後に与える影響については十分なエビデンスがないのが現状である。過去のRCT等より,ステント留置の際の穿孔が局所再発や腹膜転移を惹起する可能性が示唆されており,ESGEのガイドラインでは,BTSは標準治療として推奨できないとしているが,手技の向上に伴い近年のメタアナリシスでは長期予後に差がないとも報告されている。現在,英国や本邦でRCTが行われており,結果が待たれる。切除不能の遠隔転移を伴うStageⅣ大腸癌における,原発巣切除を前提としたBTS目的のステント治療では,長期予後への影響に拘泥する意義は低く,治療選択肢の一つとなり得る。
いずれにしても,ステント治療は穿孔などの重大な偶発症のリスクを伴うことに留意し,手技に精通した医師が,偶発症に対する十分な対策(緊急手術など)がとれる環境で行うべきである。本邦の多施設共同前向き観察研究では,技術的・臨床的成功率は90%以上である一方,偶発症の発生率は姑息的ステント留置では穿孔2.3%,閉塞10.3%,逸脱6.9%,BTS目的のステント留置では穿孔1.6%,閉塞1.0%,逸脱1.3%と報告されている。
臨床的に閉塞症状がない症例や,細径内視鏡が通過可能な程度の狭窄に対する予防的なステント留置は,不必要な偶発症の発生を惹起するだけでなく,ステント逸脱の可能性も高くなるため,施行すべきではない。
CQ 28:大腸癌治癒切除後に多重がん(多発癌および重複がん)のサーベイランスは推奨されるか?
大腸癌には,大腸多発癌,重複がんの高い発生リスクを有する遺伝性大腸癌がある。日常診療においては,遺伝性大腸癌を鑑別することが重要であり,遺伝性大腸癌に対しては適切なカウンセリングのもとに多重がんのサーベイランスを実施する必要がある(『遺伝性大腸癌診療ガイドライン』参照)。
一般的に,異時性大腸癌の発生頻度は1.5~3%とされる。これは一般集団と比較した場合の1.3~1.5倍と高く,大腸癌罹患歴は異時性大腸癌の危険因子である。
特に診断年齢が若年な症例や同時性多発癌を有する症例では,以後に発生する異時性大腸癌のリスクは高い。定期的な内視鏡検査により発見される異時性大腸癌の約90%が治癒切除可能であり,異時性大腸癌を標的とした術後サーベイランスは予後の改善に有効と考えられる。
推奨される術後の大腸内視鏡検査のスケジュールは確立されたものがない。異時性大腸癌は術後3年以内の発見率が高い。大腸癌の初回手術時に多発癌を合併する頻度は2~7%と比較的高く,術後早期に発見される異時性大腸癌には術前検査で見逃した同時性大腸癌も含まれると考えられる。術後初回の大腸内視鏡検査の至適施行時期は術前検査の質に左右されるが,一般的には術後1年時の検査が推奨され,術前に全大腸の観察が不能であった症例には,より早期の実施が望ましい。
一方,重複がんを標的とするサーベイランスを散発性大腸癌に行うことの妥当性は十分に検証されていない。本邦における異時性重複がんの発生頻度は1~5%とされる。臓器別には,胃が最多であり(1~3%),肺や肝臓がこれに続くとする報告が多い。近年,大腸癌術後の重複がん発生頻度は一般集団の罹患率を上回る可能性を指摘する報告もあるが,散発性大腸癌症例における重複がんのサーベイランスの有効性を証明したコホート研究はない。また,前立腺癌,子宮体癌,卵巣癌,乳癌,小腸癌,女性の甲状腺癌などの発生頻度が高いとする報告があるが,多くは欧米からの報告であり,遺伝性大腸癌との関連も明確ではない。
以上から,重複がんのサーベイランスに関しては,医療経済的側面も考慮した検討が必要であり,重複がん発生リスクの評価基準の確立が急務であるが,現状では大腸癌術後に重複がんを標的とするサーベイランスを実施する根拠は乏しい。がん検診の必要性を啓発し,定期的な検診を勧めるのが妥当である。









