第34回
生検標本における大腸早期癌とdesmoplastic reaction藤盛孝博(社会医療法人神鋼記念会神鋼記念病院病理診断センター長
福島県立医科大学特任教授)ほか
監修コメント
Desmoplastic reaction(DR:間質反応)とは癌細胞が浸潤する際にみられる間質での線維芽細胞等の増生する状態で,大腸癌では浸潤するにしたがってみられるといわれている。癌細胞のαvβ6 integrinが何らかの形でTGF-β1(transforming growth factor-β1)を活性化し,間質内の正常な線維芽細胞を筋線維芽細胞に分化転換(transdifferentiation)させるといわれている。さらに,癌に伴う間質のfibroblastsが腫瘍のprogressionに関与するという報告もある。生検材料におけるDRの存在は,癌が粘膜下層深部まで浸潤していることを想定できる所見と考えられる。また最近ではmatrix crosslinking forcesなどの論文も認められ,癌の局所での発育進展と間質とのかかわり合いが注目されている。
大腸SM癌では,pSM癌をpSM1(<1,000μm)とpSM2(≧1,000μm)に二分することが臨床病理学的に重要な因子であるとの認識から『大腸癌取扱い規約』,『大腸癌治療ガイドライン 医師用2016年版』いずれにも標準化を目指し記載されている。その一方でnarrow band imaging(NBI)システムやFUJI intelligent chromo endoscopy(FICE)などといった拡大観察でpSM1とpSM2の判別が可能になってきているが,広く一般化するには現状では限界がある。そこで,今回,通常内視鏡の観察および生検で診断可能なDRおよびその診断意義について診断のポイントを本項でとりあげることにした。
早期大腸癌に対する内視鏡治療前の診断をいかに的確に行うかが診断学,治療学の基本であることに変わりはない。内視鏡治療前から追加治療が必要と思われる症例まで,病巣を切除した標本の結果から考えるにはあまりにも安易な診断学である。早期癌の内視鏡治療適応外と判断したとき,生検DR陽性が簡便な補助診断の手法として内視鏡医の治療選択に貢献できることが目的である。生検がそのあとの内視鏡治療の障害になるという批判も目的から考えると的外れである。もちろん,その診断の問題点(特異度と感度)について触れる必要があり,免疫染色などによるDRの診断についても検討する必要がある。
(監修コメント=社会医療法人神鋼記念会神鋼記念病院病理診断センター長/福島県立医科大学特任教授 藤盛孝博)
pSM1, vs. pSM2(リンパ節転移)
1,000μm以上の浸潤症例のリンパ節転移率は84/435(19.3%)であり,有茎性とそれ以外に分けてリンパ節転移を検討したのが表1である。有茎性とそれ以外に二別することの重要性,また非有茎性であれば1,000μmを越えた浸潤(pT1b:SM2)以上の浸潤であれば深くなってもリンパ節転移率が変わらないことを示している。SM2群のリンパ節転移危険に関する層別化による因子の検討が必要である。内視鏡診断で有茎(Ip)かそれ以外に分けることで同じSM癌であっても転移再発が異なる。内視鏡診断での有茎の評価が重要である。
表1 SM癌浸潤距離とリンパ節転移
(pNはリンパ節転移,症例は外科手術標本での検討結果:SM癌のリンパ節転移率,87/724:12%)
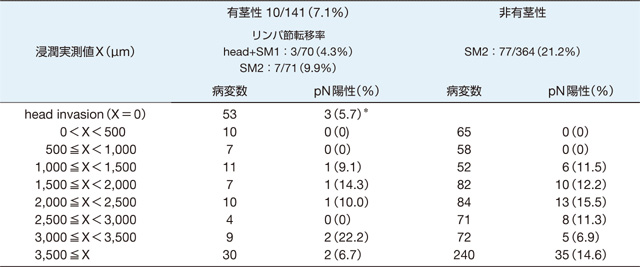
*:head invasion例でpN陽性であった3例はすべてly陽性であった。(文献1より引用)
・参考資料
田中信治.内視鏡的な有茎性と非有茎性の鑑別はどうすればよいですか?大腸癌FRONTIER.2009;2:25-6, Watanabe T, et al. Int J Clin Oncol. 2015;20:207-39.
Ip vs. non Ip
表2の松田論文2)によれば,有茎性と診断することで転移再発がなく,内視鏡治療で完治が期待できることになる。一方,非有茎(non-Ip)型癌ではいかにSM1とSM2とを簡便に選択するかが治療選択上重要である。Narrow band imaging(NBI)システムやFUJI intelligent chromo endoscopy(FICE)などの拡大観察でこれらの判別が可能といわれているが,未だ均霑化には至っていない。DRとは癌細胞が浸潤する際にみられる間質での筋線維芽細胞の増生する状態を指す。これらが出現する背景や線維芽細胞を筋線維芽細胞に分化転換(transdifferentiation)させるかなど,学問的なところについては成書あるいは本誌(前身2008年創刊『大腸癌 FRONTIER』)の特集を参考にしていただきたい。いかに的確にDRを生検で診断するかである。ヘマトキシリン・エオジン染色(HE染色)での評価(図1)が基本であることに変わりはないが,免疫染色が有効で感度,特異度ともに診断精度をあげることができる。
表2 有茎(Ip)型早期大腸癌384例におけるhead invasionとstalk invasionにおけるリンパ節転移と再発率
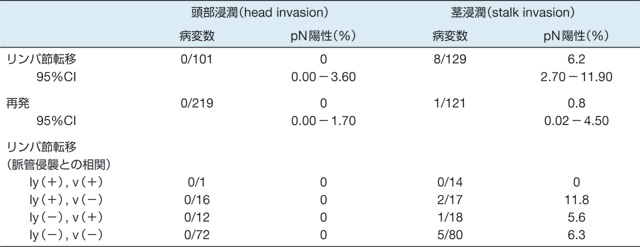
ly:リンパ管侵襲,v:静脈侵襲(文献2より改変引用)
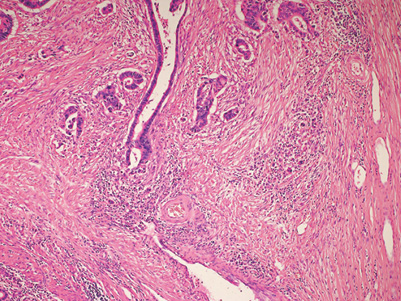
図1 DR(HE染色)
癌浸潤とともにみられる間質の筋線維芽細胞の増生。ときに肉芽組織との鑑別が困難な場合がある。特に有茎型では粘膜筋板が錯綜し,生検組織でDRと診断される場合がある。有茎型では生検でのDR診断は頭部浸潤(head invasion),茎浸潤(stalk invasion)かの鑑別には役に立たない。生検でのSM1 or SM2の診断にDRが有効なのは非有茎(non-Ip)型早期癌に限る。
(文献3を参考)
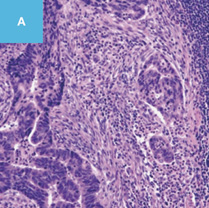
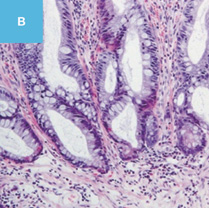
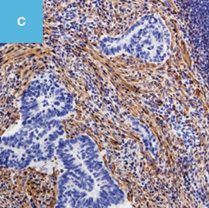
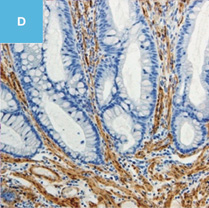
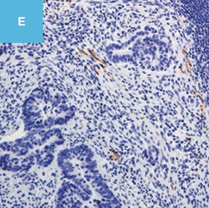
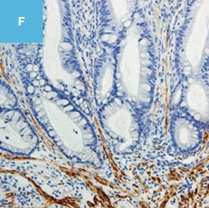
図2 正常粘膜(癌浸潤ではないMPS)における間質と癌浸潤に伴う間質を免疫染色で比較した図
A,C,E:典型的な癌浸潤にみられたDR。
A:HE染色。
C,E:免疫染色。
C:α-smooth muscle actin(SMA)。
E:Desmin(D)染色,SMA陽性部分でDesminは陰性である。一方,B,D,Fでは間質におけるSMA,Desmin染色ともに陽性になっている。
D:粘膜筋板を示している。粘膜筋板,固有筋層,血管平滑筋ではDesminやSMAはともに陽性になるが,DRではDesmin陰性,SMA陽性となる。
表3 非有茎型(non-Ⅰp)早期大腸癌の生検組織におけるDRの粘膜下層浸潤度判別能の比較
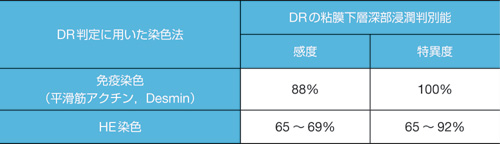
非有茎型(non-Ip)早期大腸癌の生検組織におけるDRの粘膜下層浸潤度判別能について左記免疫染色とHE染色を比較したものである。
(文献3より引用)
表4 DR陽性と浸潤
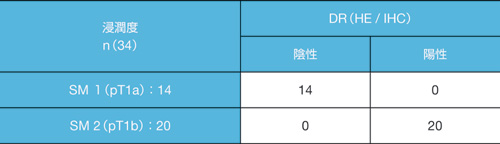
HE:hematoxylin-eosin stain,
IHC:immunohistochemical stain
(文献3より引用)
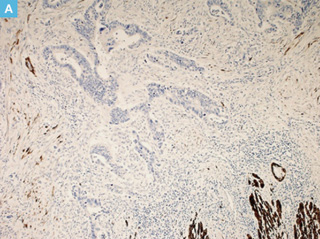
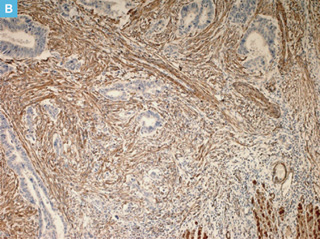
図3 DRの免疫染色
A:Desmin,B:α-SMA
まとめ
内視鏡診断で有茎型(Ip)と非有茎型(non-Ip)に二別することは大腸早期癌の内視鏡治療で基本的なものである。Ipは完全切除後の病理診断でその後の治療選択が可能であり,head invasionであれば内視鏡治療で完治が可能である。一方,non-Ipは非連続的浸潤,脈管侵襲,断端評価が困難な場合があり,内視鏡治療の適応の拡大にはリスクもあると思われる。
拡大観察などの最新の診断学とは別に,内視鏡治療のより正確な適応を模索する方向性として,一般化している生検診断を活用することも考慮されるべき簡便な手段の一つであろうと思われる。
参考
表5 pTis vs. pT1(食道・胃・大腸の比較)
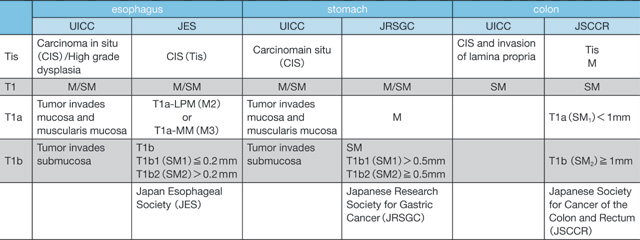
日本での早期消化管癌は,食道では粘膜内癌,胃・大腸では粘膜下浸潤癌でリンパ節転移を問わない。
Head invasion(有茎性:Ipだけが対象となるポリープの頭部に限局した癌浸潤)は基準線(Haggitt level 2)より表層での浸潤であることから,粘膜内癌相当の臨床経過(表2)も含めてhead invasion≒Mにする方がよいとの意見もみられるが表5で示すように浸潤距離0μmは1,000μm(1mm)未満に含まれているので現行ではpT1a(直接浸潤距離:0)という記載になる。
pTis:Mの記述を上皮内病変(in situ)ではないhead invasionに使いにくい大腸だけがこの部分で食道・胃と異なることを表5で理解してもらいたい。
● 文 献
1)大腸癌治療ガイドライン 医師用2016年版.大腸癌研究会(編).東京:金原出版;2016.
2)Matsuda T, et al. Cancer Sci. 2011;102:1693-7.
3)Okamoto Y, et al. Pathol Int. 2013;63:539-45.









